
29 Билет
Электролиз– это совокупность ОВ процессов, протекающих на электродах в растворах и расплавов электролитов под действием постоянного эл.тока. Процессы окисления протекают на положительно заряженном аноде, процессы восстановления на катоде.
Анодные процессы (отдача)
Катодные процессы (присоединение)
Характер процессов при электролизе опр-ся природой электролитов и значениями электродных потенциалов.
Процессы на катоде:
Восстановление катионов до свободных атомов или молекул.
Восстановление катионов до более низких степеней окисления.
Восстановление молекул воды до свободного Н₂
Правила:
В первую очередь восстанавливаются частицы имеющие максимальное значение ϕ°.
а ) Кt, стоящие в электро-химическом ряду напряжений до алюминия не могут быть восстановлены из водных растворов.
б ) в концентрированных растворах ионы металлы расположены в коэффициент химической реакции между алюминием и водородом восстановления.
в ) Катионы металла с ϕ>0 восстановлены до свободных.
г ) Если раствор содержит несколько ионов металла, то восстановление их происходит в порядке уменьшить ϕ°.
Процессы на аноде:
Растворение металлов, из которого сделан анод.
Окисление анионов.
Повышение степени окисления ионов.
Окисление ионов воды.
Правила:
Окисляются частицы с меньшим значением.
Кислотные остатки (кислородосодержащие) не окисляются - вместо них окисляется вода.
В водных растворах не окисляются ионы F⁻ до свободных
В случае растворимых анодов происходит процесс растворения металлов (рафинирование)
электролиз растворов солей с растворимым анодом сводится к окислению материала анода (его растворению) и сопровождается переносом металла с анода на катод. Это свойство широко используется при рафинировании (очистке) металлов от загрязнений.
30 Билет
1 закон Фарадея:
Масса вещества, окисленного на аноде или восстановленного на катоде при электролизе пропорционально количеству электричеству, происходящего через электролиз.
m = K*Q, где М – количество выделенного вещества,
K – электрохимический эквивалент,
Q – количество электричества.
K
=
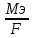 ;
F
= 95459 Кл (число фарадея)
;
F
= 95459 Кл (число фарадея)
Q
= Y*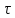 ,
где τ – время,Y
– сила
тока.
,
где τ – время,Y
– сила
тока.
2 закон Фарадея:
Равное количество электричества окисляет или восстанавливает из различных растворов эквивалентное количество вещества.
m
=
 для газов ν =
для газов ν =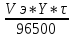
Электролиз находит широкое применение в технике.
Очистка или рафинирование металлов. Процесс происходит в электролитической ванне. Анодом служит металл, подлежащий очистке, катодом — тонкая пластинка из чистого металла, а электролитом — раствор соли данного металла, например, при рафинировании меди — раствор медного купороса. В загрязненных металлах могут содержаться ценные примеси. Так, в меди часто содержится никель и серебро. Для того чтобы на катоде выделялся только чистый металл, необходимо учитывать, что выделение каждого вещества начинается лишь при некоторой определенной разности потенциалов между электродами, называемой "потенциалом разложения". При надлежащем ее выборе из раствора медного купороса на катоде выделяется чистая медь, а примеси выпадают в виде осадка или переходят в раствор.
Электрометаллургия. Некоторые металлы, например, алюминий, получают методом электролиза из расплавленной руды. Электролитической ванной и одновременно катодом служит железный ящик с угольным полом, а анодом — угольные стержни. Температура руды (около 900°С) поддерживается протекающим в ней током. Расплавленный алюминий опускается на дно ящика, откуда его через особое отверстие выпускают в формы для отливки.
Гальваностегия — электролитический способ покрытия металлических изделий слоем благородного или другого металла (золота, платины), не поддающегося окислению. Например, при никелировании предмета он сам служит катодом, кусок никеля — анодом. Пропуская через электролитическую ванну в течение некоторого времени электрический ток, покрывают предмет слоем никеля нужной толщины.
Гальванопластика, или электролитическое осаждение металла на поверхности предмета для воспроизведения его формы, была изобретена в 1837 г. русским ученым Б. С. Якоби, предложившим использовать электролиз для получения металлических отпечатков рельефных предметов (медалей, монет и др.). С предмета снимают слепок из воска или вырезают выпуклое изображение на деревянной доске и делают его проводящим, покрывая слоем графита. Затем опускают слепок или доску в качестве катода в электролит. Анодом служит кусок металла, используемого для осаждения. Этим способом изготовляют, например, типографские клише.
