
26 Билет
Электрохимияизучает ОВ процессы(ОВП), которые идут под действием постоянного эл.тока(электролиз)или сами яв-ся его источником. Основным предметом электрохимии яв-ся процессы, протекающие на электроде и при прохождении тока в растворах(в электролите).
Двойной эл.слой. при погружении металла(пластинки) в воду или в раствор своей соли под действием полярных молекул воды, металл посылает в раствор свои ионы по схеме:
Ме0-ne→Me(n+). Me(n+)+ne→Me0. Электроны
остаются на пластинке и заряжают ее
отрицательно, а ионы, перешедшие в
раствор, заряжают жидкость положительно.
Ионы металла удерживаются вблизи
металлич.пластинки силами электростатического
притяжения, возникает двойной эл.слой
шириной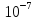 см
с определенной разностью потенциалов.
С течением времени устанавливается
динамическое равновесие: Ме0↔Ме(n+)+ne.
см
с определенной разностью потенциалов.
С течением времени устанавливается
динамическое равновесие: Ме0↔Ме(n+)+ne.
Активные металлы посылают свои ионы в раствор Zn0-2e→Zn2+. Малоактивные забирают на свою поверхность ионы из раствораCu2++2e→Cu0.
Электродный потенциал-разность потенциалов, возникающих на границах электронных электролитов (ɛ; ϕ[B]). Он зависит от природы металла, концентрации его ионов в электролите и отt.
Если концентрация иона составляет
1моль/л при t=25 C,
ϕ обозначают как Е
C,
ϕ обозначают как Е ϕ
ϕ и наз-сястандартным электродным
потенциалом.Абсолютное значение
электродного потенциала определить
невозможно. Поэтому определяют разность
электродных потенциалов исследуемого
металла и электроды сравнения –водородного электрода.Формула
Нернстаϕ= ϕ
и наз-сястандартным электродным
потенциалом.Абсолютное значение
электродного потенциала определить
невозможно. Поэтому определяют разность
электродных потенциалов исследуемого
металла и электроды сравнения –водородного электрода.Формула
Нернстаϕ= ϕ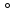 +
+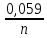 lg[
lg[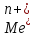
Электрохимические процессыэто окислительно-восстановительные реакции, которые сопровождаются возникновением электрического тока или вызываются электрическим током.
В электрохимических процессах окислительная и восстановительная полуреакции пространственно разделены, а электроны переходят от восстановителя к окислителю не непосредственно, а по проводнику внешней цепи, создавая электрический ток. В О.В.Р этого типа наблюдается взаимное превращение химической и электрической форм энергии.
Выделяют две группы электрохимических процессов:
· процессы превращения электрической энергии в химическую (электролиз);
· процессы превращения химической энергии в электрическую (гальванические элементы).
Простейшая электрохимическая система состоит из двух электродов – проводников первого родас электронной проводимостью, находящихся в контакте с жидким (раствор, расплав) или твердым электролитом - ионным проводникомвторого рода.Электроды замыкаются металлическим проводником, образующим внешнюю цепь электрохимической системы
В настоящее время за нуль принят потенциал стандартного водородного электрода. Такой электрод состоит из платинированной платины, контактирующей с газообразным водородом, находящимся под давлением 101 кПа p=1, и раствором, в котором активность ионов H+ равна единице (рис. VII.3). Водородный электрод относится к газовым электродам, т. е. электродам, в котором по крайней мере один из реагентов является газообразным
Если из всего ряда стандартных электродных потенциалов выделить только те электродные процессы, которые отвечают общему уравнению
![]()
то получим ряд напряжений металлов. В этот ряд всегда помешают, кроме металлов, также водород, что позволяет видеть, какие металлы способны вытеснять водород из водных растворов кислот. в отличие от периодической системы элементов, ряд напряжений металлов не является отражением общей Закономерности, на основе которой можно давать разностороннюю Характеристику химических свойств металлов. Ряд напряжений Характеризует лишь окислительно-восстановительную способность Электрохимической системы «металл — ион металла» в строго определенных условиях: приведенные в нем величины относятся к водному раствору, температуре 25 гр и единичной концентрации (активности) ионов металла.
