
24 Билет
Водаочень слабый электролит,
диссоциирует незначительно.H2O↔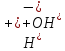
 =
= =1,8*
=1,8*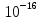 ,
где [H+], [OH-]
–молярные концентрации частиц в воде.
,
где [H+], [OH-]
–молярные концентрации частиц в воде.
Ионное произведение воды:
 =
=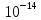 =const.
[H+][OH-]=
=const.
[H+][OH-]=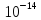 .
Чтобы охарактеризовать реакцию среды
любого раствора, указывают концентрацию
ионов водорода (редко гидроксогрупп).В чистой воде[H+]=[OH-]=
.
Чтобы охарактеризовать реакцию среды
любого раствора, указывают концентрацию
ионов водорода (редко гидроксогрупп).В чистой воде[H+]=[OH-]=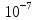 .
Нейтральная среда [H+]=[OH-]=
.
Нейтральная среда [H+]=[OH-]=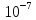 .
.
Кислая среда [H+]>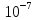 >[OH-].
Щелочная среда [H+]<
>[OH-].
Щелочная среда [H+]<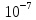 [OH-].
[OH-].
Для удобства концентрацию ионов водорода характеризуют водородным показателем pH.
pH=-lg[H+].pH-это качественная характеристика среды. В лаборат.условиях для замеровpHиспользуют индикаторную бумагу,pH-метры. (моль/л)
Диссоциацию воды часто записывают в более простом виде:
Н2О = Н++ ОН‾.
Водородным показателем, илиpH, называется взятый с обратным знаком десятичный логарифм концентрации водородных ионов в растворе:
![]()
25 Билет
Гидролиз-это реакция взаимодействия соли с водой, в результате которой образуется слабодиссоциированное в-во.
Различают 3 случая гидролиза:
1)гидролиз соли, образованный сильным основанием и слабой кислотой.
а) записываем ур-ие диссоциации соли. CH3COONa↔CH3COO-+Na+. Определяем ион, который подвергается гидролизу, этот ион соответствует слабому электролиту. Ацетат ион хар-ся уксусной кислотой, а уксусная кислота-слабый электролит. Именно ацетат ион взаимодействует с водой. б)записываем ур-ие гидролиза в ионном виде:CH3COO-+H+OH-↔CH3COOH+OH-pH>7.
в)записываем ур-ие гидролиза в молекулярном виде: CH3COONa+H2O↔CH3COOH+NaOH. Для многоосновных кислот гидролиз протекает ступенчато, при этом образуется кислая соль. Гидролиз протекает по первой ступени.
K2CO3↔2K++CO3-2
1)CO3-2+H+OH-↔HCO3-+OH-pH>7
K2CO3+H2O↔KHCO3+KOH
2)HCO3-+H+OH-↔H2CO3+OH-
KHCO3+H2O↔H2CO3+KOH
2)Гидролиз соли, образованной сильной кислотой и слабым основанием(гидролиз протекает по катиону).Продуктами такого гидролиза яв-ся или основная соль, или слабое основание.NH4Cl↔NH4++Cl- В ионном виде:NH4++H+OH-↔NH4OH+H+pH<7 В молекулярном виде:NH4Cl+H2O↔NH4OH+HCl. Гидролиз многокислотных солей протекает ступенчато. В растворе происходит образование основной соли.
3) гидролиз соли, образованной слабым основанием и слабой кислотой(полный гидролиз).CH3COONH4↔CH3COO-+NH4+ В ионном виде не имеется. В молекулярном виде:CH3COONH4+H2O↔CH3COOH+NH4OH pH>=7.
4)если соль образована сильным основанием и сильной кислотой, то гидролизу не подвергается.NaCl+H2Oгидролиз не идет.
Совместный гидролиз. При сливании растворов солей, кроме реакции ионного обмена, вероятно протекание взаимного гидролиза. Взаимный гидролиз протекает по схеме: 1.FeCl3.Fe3+ +HOH↔FeOH2+ +H+. Раствор содержит ионыFe(слабый электролитFe(OH)3), который подвергается гидролизу по 1 ступени.FeCl3+H2O↔FeOH2+Cl2- +HCl. 2.Na2CO3. Раствор имеет в своем составе карбонат ион(анионы слабой угольной кислоты), которое подвергается гидролизу по 1 ступени.
Ионный вид: CO3- +H+OH-↔HCO3- +OH-.
В молекулярном виде: Na2CO3+H2O→Na+HCO3- +NaOH.
При сливании двух солей идет нейтрализация FeOHCl2+NaHCO3↔6NaCl+Fe2(CO3)3+H2O.
Образованный в результате реакции карбоната железа подвергается полному гидролизу: Fe2(CO3)3+6H2O→2Fe(OH)3↓+3H2O+3CO2↑. Получаем суммарное ур-ие совместного гидролиза: 2FeCl3+3Na2CO3+3H2O→6NaCl+2Fe(OH)3↓+3CO2↑
водных растворах электролитов химические реакции протекают с участием ионов, такие реакции называютсяионно-обменными, а уравнения этих реакций – ионными уравнениями.
