
22 Билет Растворы
Растворы- гомогенные смеси переменного состава, состоящие из двух или более компонентов. Растворы делят по размеру частиц растворенного в-ва на истинный и коллоидный.
Истинные р-ры: в таких растворах растворенное в-во диспергированно до атомного или молекулярного состояния. Истинные р-ры термодинамически устойчивы и неограниченно стабильны во времени.
Коллоидные р-ры:это гетерогенные дисперсные системы, в которых частицы растворенного в-ва обладают ультрамикроскопической (коллоидной) степенью дробления. Растворы так же делят по кол-ву растворенного в-ва на разбавленный, концентрированный и насыщенный.
Насыщенный р-р-такой р-р, который находится в равновесии с избытком растворенного в-ва (скорость растворения=скорость кристаллизации).Такой р-р содержит максимально возможное для данных условий кол-во растворенного в-ва. Если скорость растворения превышает скорость кристаллизации, то р-ры образуютсяненасыщенные.
Если наоборот, то пересыщенныер-ры. По соотношению кол-ва растворенного в-ва и растворителя различают растворы разбавленные и концентрированные(р-ры близкие к состоянию насыщения). Концентрация насыщенного р-ра (V,tconst)при строго определенных условиях (p,tconst-растворимость).
Растворсостоит из растворителя, который преобладает в растворе, и растворенного в-ва - это и есть компоненты раствора.
Растворимость-способность в-ва
растворяться в растворителе. По
растворимости в-ва делят на 3 группы:
1)хорошо растворимые (Р) (10г в-ва на 1л приt=20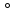 ).
).
2)малорастворимые (М) (от 0,01г до 10г на 1л воды).
3)нерастворимые (Н) (менее 0,01г на 1л).
Растворимость зависит от природы растворенного в-ва, от tи отpдля газов.
Способы выражения концентрации растворов.
1)Массовая концентрация, массовая доля
ω-отношение массы растворенного в-ва
m[X] к массе
всего р-раm[S]
ω=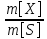 ×100%p[S]=
×100%p[S]=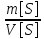 ,
гдеp-плотность р-раS[г/
,
гдеp-плотность р-раS[г/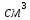 ]
]
2)Молярная концентрация, молярность
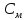 (М)-число
молей растворенного в-ва
(М)-число
молей растворенного в-ва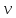 [X],
содержащегося в 1л р-раV[S],[моль/л;моль/
[X],
содержащегося в 1л р-раV[S],[моль/л;моль/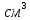 ]
М=
]
М= =
=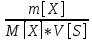
3)Эквивалентная концентрация,
нормальность
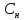 -число
эквивалентов растворенного в-ва
-число
эквивалентов растворенного в-ва
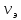 ,
содержащихся в 1л раствораV[S]
[экв/л; моль/л; моль/
,
содержащихся в 1л раствораV[S]
[экв/л; моль/л; моль/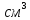 ]
]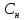 =
=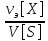 =
=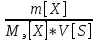
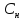 =
=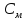 *В
*В
4)Моляльная концентрация, моляльность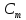 -число
молей растворенного в-ва ν[X],
приходящихся на 1кг растворителя
-число
молей растворенного в-ва ν[X],
приходящихся на 1кг растворителя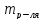 [моль/кг]
[моль/кг]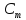 =
=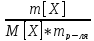
5)Титр(Т)показывает кол-во граммов
растворенного в-ваm[X],
содержащихся в 1мл раствораV[S]
[гр/мл] Т= =
=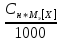 =
=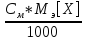
Температурный коэффициент растворимости характеризует зависимость растворимости от температуры. Чем больше этот коэффициент, тем круче возрастает растворимость соли в воде по мере повышения температуры
Зависимость между растворимостью и температурой очень удобно изображать графически — в виде кривых растворимости. Для построения кривой растворимости откладывают на горизонтальной оси температуру, а на вертикальной — растворимость вещества при соответствующей температуре
23 Билет
1)Молекулы при растворении или расплавлении распадаются на ионы. Катионы(+ионы), анионы(-ионы). Процесс распада молекул электролитов на ионы наз-ся электролитической диссоциацией.
2)В растворе или расплаве ионы движутся хаотически, при пропускании через раствор или расплав катионы(+ионы) движутся к катоду(-электрод), а анионы(-ионы) к аноду(+электрод).
3)Диссоциация-процесс обратимый.
Параллельно идут два процесса:
диссоциация(распад) и ассоциация(объединение).
NaCl↔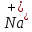 +
+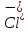
Св-во электролитов в различной степени
диссоциации выражается степенью
диссоциацииα=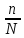 *100%
*100%
Степень диссоциации - это число, показывающее какая доля молекул распалась на ионы и равная отношению числа распавшихся молекул на ионы(n) к общему числу молекул(N).
По степени диссоциации электролиты делятся на сильные и слабые:
Сильныеэлектролиты полностью диссоциируют на ионы.
Слабыеэлектролиты частично диссоциируют на ионы,
α>30% 1) HCl, HBr, HI, HNO3, H2SO4, HClO4, HClO3, H2CrO4, H2Cr2O7, HMnO4.
2)щелочи
3)почти все растворимые соли; α<3%
1) HF, H2S, HCN, H3BO3, H2CO3, H2SiO3, HNO2, H3PO4, H2HPO3, HClO2, HClO.
2)нерастворимые основания +NH4OH.
3)некоторые соли: ZnCl2,HgCl2.
Степень диссоциации α зависит от природы растворителя, природы электролита, от t, от концентрации. К электролитам относится большинство неорганических кислот, оснований и солей. К неэлектролитам относятся многие органические соединения, например спирты, углеводы. Слабые электролиты в растворах диссоциируют не полностью, и с течением времени устанавливается динамическое равновесие между ионами и непродиссоциированными молекулами.
Под электролитической диссоциацией понимается распад молекул электролита в растворе с образованием положительно и отрицательно заряженных ионов — катионов и анионов
Для характеристики слабых электролитовиспользуют константу диссоциации(константу
равновесия для процесса диссоциации).
Для уксусной кислоты этот процесс можно
записать:CH3COOH↔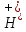 +
+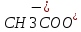
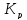 =
=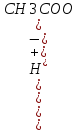
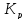 зависит: от природы диссоциирующих в-в,
растворителя иt. Не зависит
от концентрации. Чем выше его значение,
тем легче в-во распадается на ионы, и
тем сильнее электролит. Многоосновные
кислоты диссоциируют ступеньчато и
каждая ступень имеет свое значение
константы диссоциации. На примере: 1.H2CO3↔
зависит: от природы диссоциирующих в-в,
растворителя иt. Не зависит
от концентрации. Чем выше его значение,
тем легче в-во распадается на ионы, и
тем сильнее электролит. Многоосновные
кислоты диссоциируют ступеньчато и
каждая ступень имеет свое значение
константы диссоциации. На примере: 1.H2CO3↔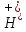 +HCO3
+HCO3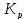 1=
1=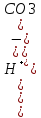 =4,5*
=4,5*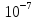 .
2.
.
2.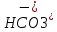 ↔
↔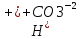
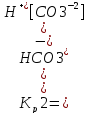 =4.7*
=4.7*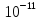
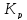 1
всегда выше
1
всегда выше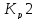 и намного выше
и намного выше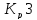 .
В растворах диссоциация протекает по
первой ступени.
.
В растворах диссоциация протекает по
первой ступени.
константа диссоциации, которая зависит от температуры и природы электролита и растворителя, но не зависит от концентрации электролита.
Константы диссоциации малорастворимых солей и гидроксидов металлов называются произведением растворимости соответствующих веществ (обозначается ПР) Оствальда закон разбавления
соотношение, выражающее зависимость
эквивалентной электропроводности
разбавленного раствора бинарного
слабого электролита (См. Электролиты)
от концентрации раствора: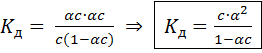
Здесь К — константа диссоциации электролита,с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрацииси при бесконечном разбавлении. Соотношение является следствием Действующих масс закона и равенства λ/λ∞= α, где α — степень диссоциации. О. з. р. выведен В. Оствальдом в 1888 и им же подтвержден опытным путём. Экспериментальное установление правильности О. з. р. имело большое значение для обоснования теории электролитической диссоциации (См. Электролитическая диссоциация).
Закон Оствальда справедлив для бинарных электролитов, т.е. веществ, молекулы которых в растворе распадаются на два иона – катион и анион. В случае сильных электролитов, когда α близка к 1, знаменатель дроби стремится к нулю, а константа диссоциации Кд – к бесконечности. Этот закон, установленный физико-химиком Вильгельмом Оствальдом в 1888 г., позволяет, в частности, с высокой точностью определять константы диссоциации многих веществ (за исключением очень сильных электролитов). Дело в том, что величину α удается опытным путем связать с электропроводностью раствора. Таким образом, зная концентрацию раствора, и выяснив в опыте степень диссоциации электролита, можно вычислить и величину Кд.
