
fiz
.pdf
Напряжение пр , при котором происходит разрушение тела, называется пределом прочности
детали (точка 4 графика).
Все сооружения и конструкции должны эксплуатироваться при напряжениях, значительно меньших их предела прочности.
Число n , показывающее, во сколько раз допустимое напряжение меньше предела прочности пр данного сооружения или конструкции, называется его запасом прочности:
n пр
Запас прочности зависит от материала, из которого изготовлено сооружение или деталь, характера нагрузок, испытываемых ими, последствий разрушений, и др. и колеблется от 1,5 до десятков. Так, запас прочности рельсовой стали должен быть не менее десяти.
Материалы, разрушение которых происходит без предшествующей ему пластической деформации,
называются хрупкими. У них на графике отсутствует горизонтальный участок 2-3. К хрупким материалам относятся фарфор, мрамор, чугун и др. При температурах, близких к абсолютному нулю, многие материалы изменяют свои физические свойства и становятся хрупкими, даже резина. При сверхнизких температурах ее можно расколоть молотком.
Теория упругости твердых тел лежит в основе расчетов на прочность материалов в строительном и горном деле, авиа- и ракетостроении, сейсмологии, биомеханике и других науках. Объектами теории упругости являются разнообразные тела: механизмы, конструкции, сооружения, горные и ледяные массивы и т. д., подверженные действию сил, температурных полей, радиоактивных облучений, изменяющих их физические свойства.
Пластичность
Пластичность это свойство тел сохранять деформацию после прекращения действия деформирующей силы. У таких тел на графике рис. 82-2 отсутствует участок 0-2, т. е. точки 0 и 2 совпадают.
Пластичными должны быть вещества, подвергающиеся ковке, штамповке, прокату. Учет пластичности веществ необходим при расчете прочности сооружений.
. Усилить пластичность веществ можно их нагреванием. Например, упругая сталь при нагревании становится пластичной и легче поддается обработке.
При пластической деформации молекулы и атомы в узлах кристаллической решетки смещаются относительно положения равновесия, но разрушения кристаллической решетки еще не происходит, хотя отдельные слои кристаллов начинают проскальзывать относительно друг друга. Скольжение таких слоев начинается там, где есть нарушения периодичности решеток. Каждый кристалл из-за анизотропии имеет свои направления наиболее легкого проскальзывания слоев. У поликристаллов пластические деформации начинаются при больших напряжениях, чем у монокристаллов, поэтому поликристаллы прочнее.
Тепловое расширение тел
Все тела при нагревании расширяются, а при охлаждении сжимаются. Исключение составляет только вода в интервале температур от 0 до 4°С.
При нагревании воды от 0°С она сжимается и при температуре 4°С имеет максимальную плотность несоответственно, минимальный для данной массы воды объем. При дальнейшем нагревании воды, т. е. выше 4°С, она начинает расширяться, а при охлаждении ниже 0°С лед начинает сжиматься, как и все остальные вещества.
Благодаря этой особенности воды существует жизнь на Земле, которая зародилась, как известно, в воде. При понижении осенью температуры воздуха и воды до 4°С верхние слои воды, приобретая такую температуру, становятся наиболее плотными и тяжелыми и опускаются на дно водоема. Там они и остаются всю зиму, а над ними располагаются более холодные и легкие слои с температурой 3, 2, 1, 0°С, а выше – лед. Поскольку вода плохо проводит тепло, то на дне глубоких водоемов всю зиму сохраняется температура 4°С, при которой возможна жизнь рыб и других организмов.

При нагревании тел увеличиваются промежутки между молекулами, поэтому увеличиваются их линейные размеры, т. е. длина, ширина, высота, диаметр и т. д. Зависимость длины тела от температуры устанавливает следующая формула:
|
l l0 1 t |
|
или |
|
l l0 1 t |
|
(83.4) |
|
|
|
|
|
|
|
|
|
|
где T T T0 , T0 273 K . |
|
|
|
|
|
|
||
Здесь l – длина тела при температуре t C |
или |
T , |
l0 – длина при 0°С = 273 К, |
T – изменение |
||||
температуры тела (по Цельсию или Кельвину, все равно), |
– температурный коэффициент линейного |
|||||||
расширения вещества.
Физический смысл температурного (термического) коэффициента линейного расширения:
температурный коэффициент линейного расширения вещества численно равен относительному изменению длины при нагревании вещества на один кельвин:
|
l l0 |
|
l |
. |
l T |
|
|||
|
|
l T |
||
0 |
|
0 |
|
|
Температурный коэффициент линейного расширения – скалярная положительная величина. В СИ он измеряется в кельвин в минус первой степени (К-1). Температурный коэффициент линейного расширения разных веществ приводится в справочной литературе.
Вследствие линейного расширения тел при нагревании их объем увеличивается. Зависимость объема
тел от температуры определяет формула: |
|
|
|
V V0 1 t |
или |
V V0 1 t , |
(83.5) |
где T T T0 , T0 273 K . |
|
|
|
Здесь V – объем тела при температуре t C |
или |
T , V0 – его объем |
при 0°С или 273 К, T – |
изменение температуры, – температурный коэффициент объемного расширения твердого тела.
Физический смысл температурного коэффициента объемного расширения: температурный коэффициент объемного расширения численно равен относительному изменению объема тела при его нагревании на один кельвин,
|
V V0 |
|
V |
. |
V T |
|
|||
|
|
V T |
||
0 |
|
0 |
|
|
Между линейным и объемным температурными коэффициентами одного и того же твердого вещества имеет место соотношение:
3 |
(83.6) |
|
|
Коэффициент объемного расширения твердого вещества равен его утроенному коэффициенту линейного расширения. Единица в СИ тоже К-1.
Поскольку жидкости не имеют собственных линейных размеров, так как не сохраняют форму, их тепловое расширение определяет только формула (83.5).
Коэффициент объемного расширения жидкостей – постоянная для каждой жидкости величина,
имеющаяся в справочной литературе. Коэффициент объемного расширения твердых веществ в справочниках не приводится, так как его можно вычислить, утроив взятый из справочника коэффициент линейного расширения данного вещества.
Поскольку масса тела при нагревании не меняется, но его объем увеличивается, значит, плотность этого тела при нагревании уменьшается. Пусть плотность и объем тела при 273 К были равны, соответственно, 0 и V0 , а при температуре Т К они стали равны, соответственно, и V .
Поскольку m 0V0 и m V , то 0V0 V , откуда
|
0V0 |
|
|
|
|
0V0 |
|
|
или |
|
|
|||
V |
|
V0 |
1 T T0 |
|
|
|
|
|||||||
|
|
|
0 |
|
|
или |
|
0 |
|
(83.7) |
||||
1 T T0 |
|
1 t |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Формула (83.7) выражает зависимость плотности вещества от температуры.

Плотность твердых и жидких веществ при 0°С приводится в справочной литературе. Плотность газов, близких к идеальному, при данной температуре можно определить, воспользовавшись уравнением Менделеева-Клапейрона:
Vm pMRT .
84.ВНУТРЕННЯЯ ЭНЕРГИЯ И СПОСОБЫ ЕЕ ИЗМЕНЕНИЯ. КОЛИЧЕСТВО ТЕПЛА. УДЕЛЬНАЯ И МОЛЯРНАЯ ТЕПЛОЕМКОСТИ. УДЕЛЬНАЯ ТЕПЛОТА ПЛАВЛЕНИЯ, ПАРООБРАЗОВАНИЯ И СГОРАНИЯ
Мы приступаем к рассмотрению основ термодинамики – раздела физики, в котором свойства тел изучаются вне зависимости от движения отдельных молекул, из которых состоят тела, а рассматриваются законы, по которым происходит переход тепловой энергии от одних тел к другим с целью использования этой энергии для производства работы или, наоборот, совершения работы для получения тепловой энергии. Практическое применение законов термодинамики огромно, поскольку превращение тепловой энергии в ее иные виды сопутствует всем явлениям природы и жизни людей
Термодинамика – раздел физики, в котором изучаются наиболее общие свойства макроскопических систем, т. е. систем, состоящих из огромного количества микроскопических частиц, а также закономерности перехода тепловой энергии от одних тел к другим.
Термодинамической системой может быть названа любая система тел или частиц, в том числе и молекул. Если эта система не взаимодействует с другими телами или системами тел, то она называется
изолированной (замкнутой).
Одним из важнейших параметров, описывающих состояние термодинамической системы, является ее
внутренняя энергия U .
Внутренняя энергия тела равна сумме кинетических энергий движения его молекул и потенциальных энергий их взаимодействия:
|
N |
N |
|
|
|
U EKi |
EПi |
|
|
|
i 1 |
i 1 |
|
|
N |
|
|
N |
|
Здесь EKi – сумма кинетических энергий всех молекул тела от 1-ой до N-ой, |
EПi – сумма всех |
|||
i 1 |
|
|
i 1 |
|
потенциальных энергий их взаимодействия.
Внутренняя энергия идеального газа равна сумме только кинетических энергий его молекул, ведь молекулы идеального газа не взаимодействуют на расстоянии. Как известно из молекулярной физики, мерой кинетической энергии поступательного движения молекул является температура. Поэтому внутренняя энергия данной массы идеального газа зависит только от одного параметра – ее температуры. Вывод формулы внутренней энергии идеального газа сделан в п. 86.
Внутренняя энергия реальных газов, жидких и твердых тел помимо суммы кинетических энергий их молекул, включает в себя и сумму их потенциальных энергий. А потенциальная энергия молекул зависит от расстояний между ними, т. е. от объема тел. Поэтому внутренняя энергия тел как термодинамических систем в общем случае определяется их объемом и температурой.
Изменить внутреннюю энергию термодинамической системы можно двумя различными путями: путем совершения работы или путем теплопередачи.
Теплопередачей (или теплообменом) называют передачу тепловой энергии от одной термодинамической системы другой без совершения работы и при этом тепловая энергия не превращается в другие формы энергии.
Возможны три разных способа теплопередачи: теплопроводность, конвекция и излучение.
Теплопроводность – это передача тепла от горячего тела холодному при их непосредственном соприкосновении.
Конвекция – это передача тепла путем взаимного перемещения теплых и холодных слоев жидкости или газа. При этом теплые слои как более легкие поднимаются вверх, а на их место сверху опускаются

более тяжелые холодные слои, которые нагреваются и тоже поднимаются вверх, и т. д. Таким путем нагревается воздух в комнате от горячей батареи.
Излучение – это передача тепла с помощью электромагнитных волн. Так, тепло от Солнца мы получаем, благодаря излучаемым Солнцем инфракрасным лучам, которые переносят его на Землю через холод космического пространства на расстояние в 150 миллионов километров.
При теплопередаче на границе между горячим и холодным телами молекулы горячего тела отдают часть своей кинетической энергии молекулам холодного тела и поэтому начинают двигаться медленнее, а молекулы холодного тела – быстрее. Из-за этого температура горячего тела понижается, а холодного повышается и в конце процесса теплопередачи их температуры выравниваются.
В процессе теплообмена одни тела отдают, а другие получают некоторое количество теплоты Q .
Количество теплоты – это мера изменения внутренней энергии тела, не связанного с совершением работы и переносом вещества.
Количество теплоты – скалярная величина. В СИ количество теплоты измеряется в тех же единицах, что работа и энергия, т. е. в джоулях. В старой учебной и научной литературе встречаются внесистемные единицы количества теплоты: калория (сокр. кал) и килокалория (ккал). Полезно знать, что
1 кал = 4,186 Дж и 1 ккал = 4186 Дж.
Если до передачи теплоты внутренняя энергия тела была U1 , а после передачи она стала равна U 2 , то переданное этому телу количество теплоты Q без совершения механической работы равно:
Q U2 U1 |
при |
A 0 . |
(84.1) |
|
|
|
|
А. Удельная теплоемкость
Для одинакового изменения температуры тел, имеющих одинаковую массу, но изготовленных из разных веществ, требуется разное количество теплоты. Так, чтобы нагреть 1 кг воды на 1 К требуется 4186 Дж теплоты, а чтобы нагреть 1 кг свинца тоже на 1 К требуется только 130 Дж теплоты. Способность разных веществ к поглощению теплоты при их нагревании характеризуется удельной теплоемкостью веществ.
Удельная теплоемкость вещества с равна отношению количества теплоты Q , полученной им при
нагревании, к массе вещества т и изменению его температуры T T2 |
T1 : |
||||||||
|
|
|
|
|
|
|
|
|
|
|
c |
Q |
|
или |
c |
Q |
|
(84.2) |
|
|
m T |
|
m T2 T1 |
|
|
||||
|
|
|
|
|
|
|
|
|
|
Поскольку изменение температуры по шкале Кельвина равно изменению температуры по шкале Цельсия T K t C , то формулу удельной теплоемкости можно записать и так:
c |
Q |
|
или |
c |
Q |
|
(84.3) |
|
|
|
|
||||
m t |
|
m t2 t1 |
|||||
|
|
|
|
|
|
|
|
Физический смысл удельной теплоемкости: удельная теплоемкость равна количеству теплоты, поглощаемому веществом при нагревании его единицы массы на один кельвин.
Поскольку при охлаждении данной массы вещества выделяется такое же количество теплоты, какое поглощается при нагревании на столько же кельвин, то физический смысл удельной теплоемкости состоит также в следующем: удельная теплоемкость вещества равна количеству теплоты, которое выделится при охлаждении единицы массы вещества на один кельвин.
Удельная теплоемкость – скалярная величина. Ее единица в СИ джоуль на килограмм – кельвин
(Дж/(кг∙К).
Удельная теплоемкость чугуна с = Дж/(кг∙К). Это значит, что для нагревания 1 кг чугуна на 1 К ему требуется передать 500 Дж тепловой энергии или что при охлаждении 1 кг чугуна на 1 кельвин он выделит 500 Дж тепловой энергии.
Удельная теплоемкость разных веществ приведена в справочной литературе.
Иногда в условии задачи речь идет не об удельной теплоемкости вещества, а о теплоемкости тела CT (отсутствует слово «удельная»). Это совсем другая величина.

Теплоемкость тела это величина, равная отношению количества теплоты Q , поглощенной телом при нагревании, к изменению его температуры T при этом:
CT |
Q |
|
|
CT |
|
|
Q |
|
|
|
|
или |
CT |
|
Q |
|
|
T |
|
|
T2 |
T1 |
|
t |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CT |
Q |
|
|
|
|
|
(84.4) |
|||||
|
|
|
|
|
t2 t1 |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Физический смысл теплоемкости тела: теплоемкость тела равна количеству теплоты, поглощенному телом при нагревании или выделенному при его охлаждении на 1 кельвин.
Теплоемкость тела – скалярная величина, зависящая от вещества и массы тела. Ее единица в СИ – джоуль на кельвин (Дж/К). Понятно, что эта величина в справочниках не приводится, ведь массы тел из одного и того же вещества, т. е. с одинаковой удельной теплоемкостью, могут быть разными.
Из сравнения формул (84.3) и (84.4) следует, что теплоемкость тела равна произведению удельной теплоемкости вещества, из которого оно изготовлено, и массы этого тела:
Из формул (84.2) – (84.4) можно определить количество теплоты Q , которое поглощается телом при нагревании или выделяется при охлаждении, если известны удельная теплоемкость, масса вещества или
его теплоемкость и изменение температуры: |
|
|
|
|
|
|
|
|
|
|
|||
|
|
или |
Q cm T2 |
T1 |
|
|
|
|
или |
Q cm t2 t1 |
|
||
|
Q cm T |
Q cm t |
|
(84.5) |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
Q C T |
или |
Q C |
T T |
|
|
|
||||
|
|
|
T |
|
|
T |
2 |
|
1 |
|
|
(84.6) |
|
|
|
|
Q CT t или Q CT t2 t1 |
|
|
|
|||||||
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Б. Молярная теплоемкость |
|
|||||||||
Кроме удельной теплоемкости, способность вещества поглощать или выделять теплоту при нагревании или охлаждении характеризуется молярной теплоемкостью С.
Молярная теплоемкость это физическая величина, равная отношению количества теплоты Q ,
поглощенного веществом при нагревании или выделенного при охлаждении, к количеству молей |
в нем |
||||
и изменению температуры T : |
|
|
|
|
|
|
C |
Q |
|
|
(84.7) |
v T |
|
||||
|
|
|
|
||
Физический смысл молярной теплоемкости: молярная теплоемкость вещества равна количеству теплоты, которое поглощается при нагревании или выделяется при охлаждении 1 моля вещества на 1 К.
Молярная теплоемкость – скалярная величина. Единица молярной теплоемкости в СИ – джоуль на моль – кельвин (Дж/моль∙К).
Из формулы (84.7) следует, что количество теплоты Q , поглощенное при нагревании тела или выделенное им при охлаждении можно еще определить по формулам:
Q Cv T |
или |
Q Cv t |
(84.8) |
|
|
|
|
Установим связь между удельной c и молярной C теплоемкостями одного и того же вещества. Массу этого вещества m можно определить произведением массы одного моля, т. е. его молярной массы M, и количества молей v в нем:
m Mv .
Подставим это выражение в (84.2):
|
|
|
|
|
c |
Q |
|
|
|
|
|
|
|
|
|
. |
|
(84.9) |
|
|
|
|
|
|
Mv T |
|
|||
Теперь разделим (84.7) на (84.9): |
|
|
|
|
|
|
|
||
|
C |
|
|
QMv T |
|
|
|
||
|
|
M , откуда |
C Mc |
(84.10) |
|||||
|
c |
v TQ |
|||||||
|
|
|
|
|
|
|
|||

Связь молярной и удельной теплоемкостей: молярная теплоемкость вещества равна произведению его удельной теплоемкости и молярной массы этого вещества.
В. Удельная теплота плавления
Для того, чтобы расплавить нагретые до температуры плавления кристаллические тела одинаковой массы, но изготовленные из разных веществ, требуется разное количество теплоты. Для характеристики способности веществ поглощать теплоту при плавлении или выделять ее при кристаллизации введено понятие удельной теплоты плавления вещества .
Удельная теплота плавления – это физическая величина, равная отношению количества теплоты Q , поглощенного кристаллическим телом в процессе его плавления, к массе этого тела m :
Qm
Физический смысл удельной теплоты плавления: удельная теплота плавления равна количеству теплоты, необходимому для плавления единицы массы кристаллического тела при его температуре плавления.
Удельная теплота плавления – скалярная положительная величина. Удельную теплоту плавления данного кристаллического вещества можно найти в справочной литературе. Удельная теплота кристаллизации вещества равна его удельной теплоте плавления. Единица удельной теплоты плавления или кристаллизации в СИ – джоуль на килограмм (Дж/кг).
Удельная теплота плавления льда = 330000 Дж/кг. Это значит, что для плавления 1 кг льда при 0°С ему необходимо сообщить 330000 Дж тепловой энергии. Или это значит, что при замерзании 1 кг льда, имеющего температуру 0°С, выделится 330000 Дж теплоты. Вот почему поздней осенью вблизи водоемов теплее, чем вдали от них.
Определив по справочнику удельную теплоту плавления данного кристаллического вещества, можно вычислить количество теплоты, требуемое для того, чтобы расплавить некоторую массу этого вещества при температуре его плавления по формуле:
Q m
Г. Удельная теплота парообразования
Превращаясь в пар при температуре кипения разные жидкости, имея одинаковую массу, поглощают разное количество теплоты. Способность жидкости поглощать то или иное количество теплоты в процессе кипения характеризуется ее удельной теплотой парообразования r (или L ).
Удельная теплота парообразования – это физическая величина, равная отношению количества теплоты, необходимого для превращения жидкости в пар при температуре кипения, к массе этой жидкости:
r Qm
Физический смысл удельной теплоты парообразования: удельная теплота парообразования равна количеству теплоты, поглощаемому единицей массы жидкости при превращении, ее в пар в процессе кипения.
Удельная теплота парообразования данной жидкости равна ее удельной теплоте конденсации. Ее величину можно найти для каждой жидкости в справочной литературе. Единица удельной теплоты парообразования в СИ – джоуль на килограмм (Дж/кг). Удельная теплота парообразования – скалярная величина.
Удельная теплота парообразования воды r = 2200000 Дж/кг. Это значит, что для превращения 1 кг воды при 100°С в пар ей необходимо передать от нагревателя 2200000 Дж тепловой энергии. Или, что столько энергии выделит горячий пар массой 1 кг при 100°С в процессе конденсации.
Зная удельную теплоту парообразования данной жидкости и ее массу, можно определить количество теплоты, которое поглотит эта жидкость при полном превращении ее в пар в процессе кипения, по формуле
Q mr

Д. Удельная теплота сгорания
В процессе сгорания топлива выделяется тепловая энергия, в результате чего уменьшается его внутренняя энергия. Убыль внутренней энергии уменьшается за счет уменьшения средней потенциальной энергии молекул топлива, а их средняя кинетическая энергия в процессе горения практически не изменяется, поэтому и температура горения сохраняется неизменной, пока все топливо не сгорит.
При сгорании разных видов топлива одинаковой массы выделяется разное количество теплоты. Для характеристики способности топлива выделять то или иное количество теплоты ввели понятие удельной теплоты сгорания или теплотворной способности топлива q .
Удельная теплота сгорания топлива – это физическая величина, равная отношению количества теплоты Q , выделенного сгоревшим топливом, к массе этого топлива m :
q Qm
Физический смысл удельной теплоты сгорания топлива: удельная теплота сгорания топлива равна количеству теплоты, которое выделится при полном сгорании единицы массы этого топлива.
Удельная теплота сгорания – скалярная величина. Ее единица в СИ – джоуль на килограмм (Дж/кг). Удельную теплоту сгорания данного топлива можно найти в справочной литературе.
Удельная теплота сгорания керосина q =4,6∙107 Дж/кг. Это значит, что при полном сгорании 1 кг
керосина выделится 4600000 Дж тепловой энергии.
Зная удельную теплоту сгорания топлива и его массу, можно определить количество теплоты, которое выделится при его полном сгорании, по формуле:
Q mq
85. РАБОТА ПРИ ИЗМЕНЕНИИ ОБЪЕМА ГАЗА. ФИЗИЧЕСКИЙ СМЫСЛ УНИВЕРСАЛЬНОЙ ГАЗОВОЙ ПОСТОЯННОЙ
Пусть в некотором цилиндре под поршнем с площадью основания S , расположенном на высоте h1 , над дном цилиндра, содержится газ, занимающий объем V1 h1S (рис. 85-1). Поршень плотно прилегает к стенкам цилиндра и может свободно, т. е. без трения, подниматься и опускаться.
|
Нагреем газ, в результате чего он изобарно расширится и поднимет |
|||
|
поршень на высоту h2 |
над дном |
цилиндра. При этом поршень |
|
|
переместится на расстояние h h2 |
h1 . Газ, действуя на поршень с |
||
|
силой давления, совершит работу |
A , которая, как известно из |
||
|
механики, равна произведению модуля силы давления Fдавл на модуль |
|||
Рис. 85-1 |
перемещения поршня h |
и на косинус угла между направлениями |
||
силы и перемещения. Но поскольку эти направления совпадают (и сила |
||||
|
||||
давления газа на поршень, и перемещение поршня направлены вверх), то этот угол равен нулю, а косинус нуля равен единице, поэтому работа перемещения поршня равна:
A Fдавл h . |
|
|
Из определения давления p имеем: |
|
|
Fдавл pS , поэтому |
A pS h . |
|
Здесь S h V V2 V1 – изменение объема газа |
вследствие его расширения. |
С учетом этого |
получим: |
|
|
A p V |
|
(85.1) |
или |
|
|
A p V2 V1 |
(85.2) |
|
Здесь V1 h1S – начальный объем газа под поршнем (т. е. его объем до нагревания), а V2 h2 S – его конечный объем (т. е. его объем в конце нагревания).

Вывод: работа при изменение его объема.
Рис. 85-2
ведь число молей v Mm .
изобарном изменении объема газа равна произведению давления газа на
Определим работу изобарного расширения газа графически в
координатных осях p V (рис. 85-2). |
Из |
рисунка следует, что работа |
изобарного расширения газа от объема |
V1 |
до объема V2 равна площади |
прямоугольника, одной стороной которого служит отрезок ab , численно равный давлению газа p , а другой – отрезок bc , численно равный изменению объема газа V2 V1 .
Установим физический смысл молярной газовой постоянной R . Для этого
запишем уравнение Менделеева-Клапейрона: |
pV |
m |
RT |
или pV vRT , |
|
M |
|||||
|
|
|
|
Если температура идеального газа изменилась изобарно на T , то при постоянной массе газа его объем изменился на V . Тогда предыдущее уравнение примет вид:
p V vR T или при v = 1 моль p V R T . Но p V A , значит, A R T . Если при этом T = 1 К, то A R .
Физический смысл молярной газовой постоянной: молярная газовая постоянная показывает, что при изобарном нагревании 1 моля идеального газа на 1 кельвин газ совершает работу 8,31 Дж.
Выражения (85.1) или (85.2) справедливы только применительно к изобарному расширению или сжатию газа. При расширении газа силы давления совершают положительную работу, увеличивая объем газа. При сжатии газа внешние силы совершают отрицательную работу, поскольку изменение объема газа в формулах (85.1) и (85.2) меньше нуля, ведь при сжатии конечный объем V2 меньше начального объема
V1 .
Если давление газа в процессе его расширения или сжатия изменяется, то формулы (85.1) и (85.2) применять для определения работы изменения объема газа нельзя. В таких случаях можно определить элементарную работу Ai при очень малом изменении Vi объема газа, столь малом, что изменением
давления при этом можно пренебречь. Тогда элементарная работа |
Ai будет равна: Ai p Vi ,а всю |
работу A при изменении объема газа от V1 до V2 , можно найти, |
просуммировав все элементарные |
работы. Математически работа A в этом случае определяется интегрированием в пределах от V1 до V2 : |
|
V2 |
|
A pdV |
(85.3) |
V1 |
|
Формула (85.3) применима к любому процессу в газе. |
|
Работа при изотермическом изменении объема идеального газа
Применим формулу (85.3) для определения работы при изотермическом изменении объема идеального газа массой m с молярной массой M при температуре T . Запишем уравнение МенделееваКлапейрона:
pV |
m |
RT |
|
||
|
|
||||
|
|
M |
|
||
и определим из него давление p : |
|
|
|
|
|
p |
mRT |
|
(85.4) |
||
|
|||||
|
|
MV |
|
||
Подставим (85.4) в (85.3) и вынесем из-под знака интеграла все постоянные величины (помним, что здесь T const , ведь процесс изотермический), а затем выполним интегрирование и подставим пределы
V1 и V2 :
A 2 |
mRT dV |
mRT 2 |
dV mRT lnV |
|
V2 |
|||||||||||||
|
||||||||||||||||||
|
mRT lnV2 lnV1 |
|||||||||||||||||
V |
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
V |
M V |
|
M V |
V |
|
|
M |
|
|
M |
||||||||
1 |
|
|
|
1 |
|
|
|
|
|
V1 |
||||||||
или |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A |
m |
RT ln |
V2 |
|
(85.5) |
||||||
|
|
|
|
|
|
|
M |
V1 |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
– работа при изотермическом процессе Поскольку согласно закону Бойля-Мариотта при изотермическом процессе объем газа обратно
пропорционален его давлению: |
V2 |
|
p1 |
то формулу (85.5) можно записать еще и так: |
||||||
V1 |
p2 |
|||||||||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
A |
m |
RT ln |
p1 |
|
|
|
|
|
|
|
M |
p2 |
|
|||
Работа при изохорном процессе в газе
Если газ содержится в закрытом сосуде, т. е. его объем постоянный, то процесс, происходящий с ним, изохорный. При этом изменение объема газа равно нулю и, значит, работа изменения его объема тоже равна нулю:
при V const A 0
Таким образом, при изохорном процессе газ работы не совершает.
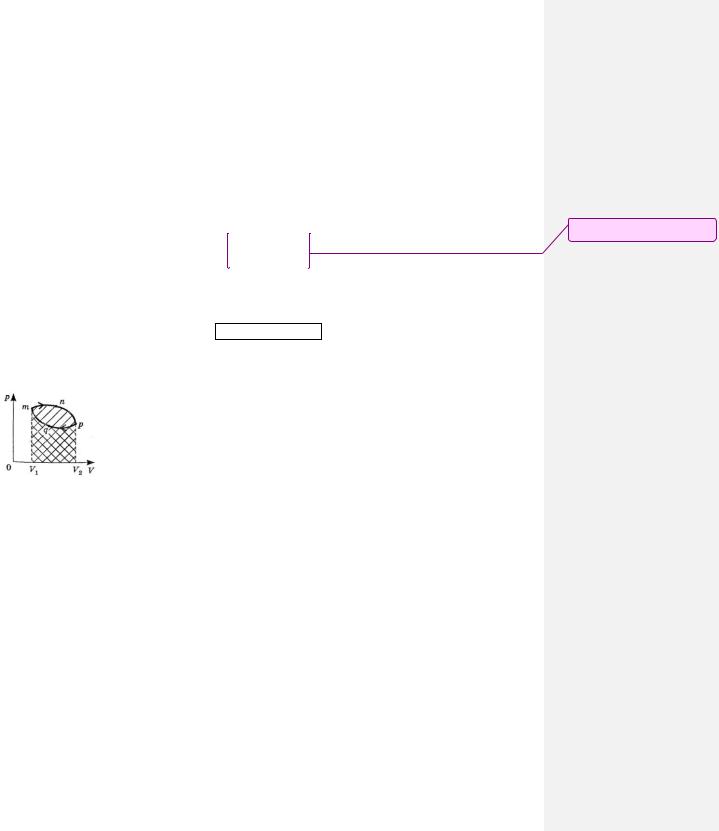
Работа при круговом процессе (цикле)
|
Если в газе происходит круговой процесс (цикл), т. е. такой процесс, по |
|
окончании которого газ переходит в состояние с первоначальными параметрами – |
|
например, когда газ вначале нагревают и при этом он расширяется от объема V1 до |
|
объема V2 (рис. 85-3, участок mnp ), а затем его сжимают при меньшей |
|
температуре до прежнего давления и объема (рис. 85-3, участок pqm ). Работа A , |
|
совершенная при таком замкнутом процессе (цикле) равна сумме работ A1 и A2 , |
Рис. 85-3 |
совершенных на этих участках в отдельности: |
A A1 A2 .
Графически работа A1 равна площади заштрихованной фигуры mnpV2V1 , а работа A2 равна площади заштрихованной фигуры mqpV2V1 с иным наклоном штриховых линий. Работа A2 меньше работы A1 , так
как работа расширения нагретого газа с большей внутренней энергией больше работы сжатия холодного газа с меньшей внутренней энергией. И при этом работа A1 положительна, так как конечный объем газа
V2 больше начального объема V1 , а работа сжатия A2 отрицательна, поскольку теперь конечный объем газа V1 меньше начального V2 . В итоге работа A , совершенная в этом замкнутом круговом процессе (цикле), равна площади криволинейной фигуры, ограниченной замкнутой кривой mnpqm . Подобные круговые процессы осуществляются в разнообразных тепловых двигателях.
Можно реализовать обратный процесс в направлении mqpnm , вынудив газ расширяться при более
низкой температуре, а сжиматься при более высокой. При таком процессе из-за совершенной газом работы расширения его внутренняя энергия станет уменьшаться, вследствие чего газ будет охлаждаться. Подобные процессы применяются в холодильных машинах.
86. ВНУТРЕННЯЯ ЭНЕРГИЯ ОДНОАТОМНОГО ГАЗА
Примечание [А1]: в оригинале ошибка в формуле
Напомним, что внутренней энергией газа, как и любого другого тела, называется сумма кинетических и потенциальных энергий его молекул. Но молекулы идеального газа на расстоянии не взаимодействуют (они взаимодействуют только при непосредственном столкновении друг с другом

подобно абсолютно упругим шарикам исчезающе малого размера). Поэтому сумма потенциальных энергий молекул идеального газа равна нулю. Вследствие этого внутреннюю энергию идеального газа можно определить следующим образом:
UEKi
i 1N
Внутренняя энергия идеального газа равна сумме кинетических энергий его молекул.
Установим зависимость внутренней энергии идеального одноатомного газа от его массы m , молярной массы M и температуры T (т. е. выведем формулу внутренней энергии идеального одноатомного газа). Каждая молекула такого газа (точнее атом, ведь газ одноатомный), в среднем обладает кинетической энергией:
EK 32 kT .
Пусть газ состоит из N молекул. Тогда согласно определению его внутренней энергии она будет равна произведению средней кинетической энергии одной молекулы на их число:
U EK N 32 kTN .
Число молекул N равно произведению числа молей газа v и числа молекул в одном моле, т.е числа Авогадро N A :
N NAv
Тогда U 32 N AvkT , где N Ak R и v Mm . В итоге получим:
U |
3 |
vRT |
или |
U |
3 |
|
m |
RT |
(86.1) |
2 |
2 |
|
M |
||||||
|
|
|
|
|
|
|
Формулу (86.1) называют формулой внутренней энергии идеального одноатомного газа. Из нее следует, что изменение внутренней энергии идеального газа U неразрывно связано с изменением его температуры T и равно:
U |
3 |
vR T |
или |
U |
3 |
|
m |
R T |
(86.2) |
2 |
2 |
|
M |
||||||
|
|
|
|
|
|
|
Следовательно, изменить внутреннюю энергию идеального газа, не меняя его массу, можно, только изменив его температуру. Если в каком-либо процессе температура данной массы идеального газа не изменяется, то и его внутренняя энергия остается прежней.
87. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ. ПРИМЕНЕНИЕ ПЕРВОГО ЗАКОНА ТЕРМОДИНАМИКИ К ИЗОПРОЦЕССАМ В ИДЕАЛЬНОМ ГАЗЕ
Если термодинамическая система получит из внешней среды некоторое количество теплоты Q , то ее
внутренняя энергия может измениться. При этом система может совершить работу против внешних сил, например нагретый газ, расширившись, может совершить работу, переместив под действием силы давления поршень. Соотношение между количеством теплоты Q , переданным термодинамической
системе, изменением ее внутренней энергии U и совершенной системой работой A носит название
первого закона термодинамики.
Первый закон термодинамики: количество теплоты, переданное термодинамической системе, расходуется на изменение ее внутренней энергии и на совершение этой системой работы против
внешних сил: |
|
|
Q U A или |
Q U2 U1 A |
(87.1) |
Первый закон термодинамики можно сформулировать иначе. Если термодинамической системе извне передается некоторое количество теплоты Q , и одновременно внешние силы совершают над этой системой работу A1 (например, когда газ нагревают и одновременно сжимают), то первый закон
