
Protistologia
.pdf
378 Избранные главы общей протистологии
градиентными сигналами. Каждая структура закладывается в том месте, которое предопределено величиной сигнала и, соответственно, удаленнос тью от его источника. Эта модель хоро шо объясняет формирование паттерна у Tetrahymena, а также у разноресничных и брюхоресничных инфузорий. Вторая гипотеза основана преимущественно на работах с Paramecium. Согласно этой гипотезе, поверхность клетки раз
делена на достаточно четко очерченные зоны, которые обособлены по молеку лярным и структурным характеристи кам. Кинетосомы и связанные с ними цитоскелетные элементы предположи тельно играют важную роль в размеще нии вновь образованных структур. Сможет ли одна модель объяснить все явления формирования паттерна у ин фузорий, покажут дальнейшие исследо вания.

Молекулярная биология |
379 |
Молекулярная биология
(Гюнтер Штайнбрюк)
В настоящее время значительно усовершенствованы методы ведения культур, например, культивируются даже такие организмы, как паразити ческие трипаносомы и малярийный плазмодий. Вместе с тем, метод полимеразной цепной реакции (ПЦР) позво ляет проводить многие молекулярнобиологические исследования, имея в наличии всего одну клетку. Эта методи ка дает возможность получить милли оны копий определенного участка ДНК. При этом нам достаточно знать всего несколько пар нуклеотидов в начале и в конце выбранного участка генома, который может насчитывать более 10 ООО пар нуклеотидов. Информация о таких фланкирующих последовательно стях необходима для искусственного синтеза олигонуклеотидов, которые служат праймерами для синтеза ДНК in vitro. Метод ПЦР крайне чувствителен: одна-единственная молекула ДНК в пробе может стать основой для высоко специфичной реакции амплификации. Внедрение этого метода позволило ре шить многие проблемы молекулярной биологии и достичь значительных успе хов в понимании молекулярных ме ханизмов. В будущем молекулярные исследования протистов выведут на об наружение новых феноменов и будут вносить все более весомый вклад в ре шение общих молекулярно-биологиче- ских проблем.
В последние десятилетия было по казано, что по сравнению с высшими организмами протисты демонстрируют поразительное многообразие не только в морфологии и экологических адаптациях, но также в биохимических и мо лекулярных механизмах. Развитие мо- лекулярно-биологических методов и интенсивное изучение протистов оказа лось взаимообогащающим:
•Несколько видов протистов стали модельными объектами в молекулярнобиологических исследованиях эукариот.
•Обнаружение уникальных моле кулярных особенностей, присущих не которым группам протистов, принципи ально изменило наше понимание путей молекулярной эволюции.
Вэтой главе представлены наибо лее яркие открытия молекулярной био логии протистов.
Вариабельные
поверхностные
гликопротеины
трипаносом
Африканские трипаносомы1 вызы вают такие серьезные заболевания, как сонная болезнь человека и нагана круп ного рогатого скота. Жизненный цикл наиболее исследованного вида Trypano soma brucei состоит из нескольких пос-
1 Их часто называют секция Salivaria или саливарные трипаносомы. — Прим. ред.

380 Избранные главы общей протистологии
ледовательных стадий (см. рис. 51). У млекопитающих паразит обитает пре имущественно в кровеносной системе. Когда муха це-це поглощает жгутико носцев при кровососании, паразиты дифференцируются в так называемые проциклические формы. Поверхность клетки у такой трипаносомы покрыта единственным типом гликопротеина — проциклином. Затем паразиты переме щаются из задних отделов кишечника в слюнные железы мухи, где они превра щаются в неделящиеся метациклические формы.
Муха це-це инфицирует млекопита ющее метациклическими формами трипаносом со слюной при кровососании. Поверхность клетки этой формы пара зита покрыта «вариабельными поверх ностными гликопротеинами» (variant surface glycoproteins — VSG). В этот момент у паразита обнаруживается лишь 14 или около того гликопротеинов, причем отдельная особь несет только один VSG. Замена одного гли копротеина на другой у этих форм про исходит очень быстро. Таким образом, «шуба» из VSG преадаптирует метациклических трипаносом к обитанию в млекопитающем-хозяине. Уже находясь в кровяном русле млекопитающего, па разит единовременно экспрессирует одну из 1000 или более имеющихся у него копий VSG гена.
В млекопитающем паразиты под вергаются атаке со стороны иммунной системы хозяина. Стратегия ухода от иммунной атаки состоит в изменении антигенных свойств шубы гликокалик-
са. Новые VSG экспрессируются с ча стотой 10~2-10~6на одно деление клет ки. Иммунная система хозяина перио дически сталкивается с новыми анти генными эпитопами разделившихся клеток, поэтому заражение проявляет ся в виде характерных паразитемических волн. Иммунная система успеш но истребляет большинство паразитов, но те клетки, которые при делении изменили VSG гликокаликса, ускольза ют от иммунного ответа и вызывают вспышку следующей паразитемической волны.
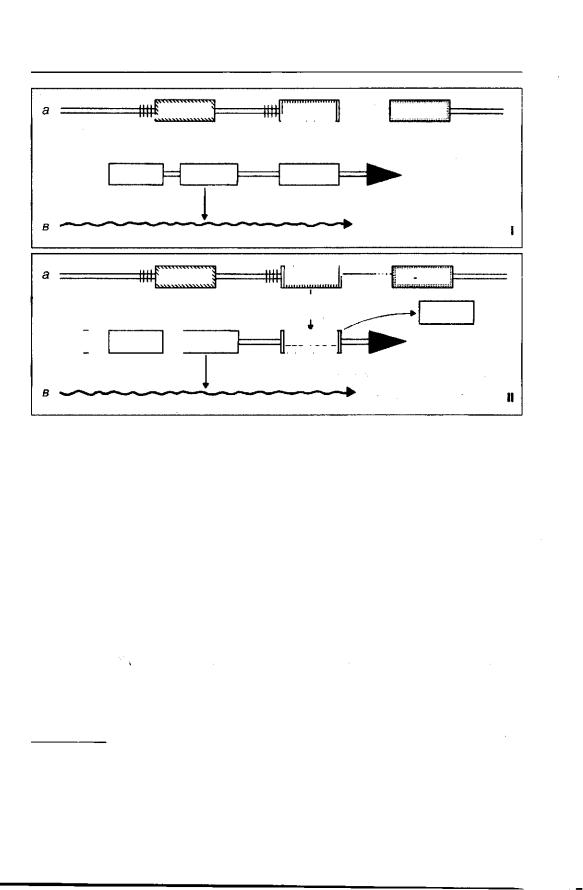
Молекулярные механизмы, стоящие за изменчивостью VSG, изучались весь ма интенсивно и относительно неплохо известны. Замена антигена осуществля ется различными путями. Упрощенная схема, иллюстрирующая два наиболее часто встречающихся, приведена на рисунке 327. Геном Т. brucei состоит примерно из 20 больших и 100 минихромосом. В них обнаружено более 1000 различных, транскрипционно пас сивных копий гена VSG. Эти копии тан демами расположены во внутренних, удаленных от теломер, участках хромо сом1. Несколько сайтов экспрессии ге на VSG располагаются субтеломерно. О сайтах экспрессии будет сказано ниже. Транскрибируется всегда только одна из VSG-копий, находящихся в субтеломерной позиции (ELC-VSG см. рис. 327). В этой связи интересно отметить, что была обнаружена необычная моди фикация ДНК в генах VSG: в ДНК Т. brucei был обнаружен 3-глюкозил- гидроксиметилурацил. Это основание
1 Идет речь о больших хромосомах. Кроме того, молчащие VSG-копии расположены субтело мерно во всех или части минихромосом. — Прим. ред.
|
|
|
|
|
Молекулярная биология |
3 8 1 |
||||
|
„ BC-VSG 1 ; |
BC-VSG 2 |
|
|
|
H # i |
BC-VSG 3 |
|
||
|
|
|
|
|
||||||
|
|
liiitiimiunmni |
|
|
|
|
Wtti |
|
|
|
|
|
|
|
|
|
|
|
|||
б = § = ESAG 1 |
ESAG2 |
ELC-VSG a |
|
|
|
|
|
|
|
|
Полицистронный транскрипт |
|
|
|
|
|
|
|
|
||
|
|
ЩГГ11ПГНТ11Т1ТП' |
1 |
|
|
llll ВГ VSG 3 |
|
|||
|
; BC-VSG 1 |
BC-VSG 2 |
|
|
|
|
||||
|
|
|
|
|
|
|
|
m |
|
|
|
|
Удвоение и перенос |
|
|
|
|
||||
|
|
|
|
|
|
|
||||
|
|
всайт экспрессии |
|
|
|
VSGa |
|
|||
б r==Jp|=: ESAG 1 |
|
I I I H I I I I n l l H n m |
|
|
|
|
|
|
|
|
= J ESAG 2 |
ELC-VSG 2 |
|
|
|
|
|
|
|
|
|
|
|
1111 f Щ Щ II III 1 |
111 |
|
|
|
|
|
||
Полицистронный транскрипт
Рис. 327 . Упрощенная схема механизма замены антигенов у т р и п а н о с о м . Антигенные пе реключения обеспечивают несколько различных механизмов . Здесь приведен наиболее часто встречающийся вариант так называемой дупликативной т р а н с п о з и ц и и . I: ситуация до антигенного переключения: а — тандемы так называемых пассивных копий гена VSG (basic copy VSG, или BC-VSG; в прямоугольных рамках) расположены во внутренних учас тках х р о м о с о м . Короткие вертикальные линии представляют 70 фланкирующих пар нук леотидов, которые маркируют гены VSG; б — потенциально экспрессируемая копия гена VSG (expression linked copy, ELC-VSGa) расположена в составе полицистронного участка на конце х р о м о с о м ы рядом с т е л о м е р о й (обозначена большой черной стрелкой); литера «а» означает, что э т о т сайт в д а н н ы й м о м е н т т р а н с к р и п ц и о н н о активен, в — ELC-VSGa т р а н с к р и б и р у е т с я п о л и ц и с т р о н н о вместе с «генами, связанными с с а й т о м экспрессии» (expression site associated genes) ESAG 1 и ESAG 2 под контролем единого п р о м о т о р а (р). II: антигенное переключение происходит с л е д у ю щ и м о б р а з о м : а — пассивная копия VSG 2 удваивается и переносится в субтеломерную позицию, где становится активной; б — преж няя же активная копия VSGa удаляется и замещается дубликатом VSG 2; в — активиро ванная копия VSG 2 считывается в полицистронный транскрипт .
до сих пор не было найдено ни у одно |
нование задействовано в регуляции ак |
го другого организма1. Предполагается, |
тивации копий гена VSG, находящихся |
что это уникально видоизмененное ос |
в субтеломерной позиции. |
' Гидроксиметилурацил в трех модификациях присутствует в ядерной ДНК динофлагеллят, но ни одна из этих модификаций не идентична видоизмененному основанию трипаносоматид. —
Прим. ред.

382 Избранные главы общей протистологии
Замена активной копии VSG-гена идет либо за счет контроля транскрип ции субтеломерных сайтов, либо путем различных перегруппировок ДНК1. Один из возможных механизмов пока зан на рисунке 327. Альтернативный, реже встречающийся механизм замены активной копии VSG-гена — это обрат ная замена2.
В отличие от большинства эукариотных генов, активная VSG-копия считывается полицистронно совместно с расположенными перед ней генами — так называемыми генами, ассоцииро ванными с сайтом экспрессии3. Промо тор этого полицистронного участка рас положен на расстоянии около 50 т.п.н. выше VSG-гена.
Другая уникальная особенность трипаносом состоит в том, что гены VSG и проциклина считываются РНКполимеразой I. У всех других эукариот эта полимераза транскрибирует только рибосомные гены. При такой транс крипции первичные транскрипты этих генов не кэпируются на 5'-конце. Кэпы эукариотных мРНК играют важную роль в инициации трансляции, а также в транспортировке и обеспечении ста бильности молекул мРНК. У трипано сом мРНК приобретают кэпы в резуль тате уникального процесса созревания,
который называется транс-сплайсингом. Короткая РНК-донор (mini-exon donor RNA) считывается с повторяющихся последовательностей, расположенных в другом участке генома, и кэпируется. Эта РНК-донор сшивается с кодирую щим экзоном, полученным при полицистронном считывании (рис. 328).
Значительные успехи были достиг нуты в анализе структуры белков VSG и способа их прикрепления к плазмати ческой мембране. Для нескольких VSG известна полная последовательность аминокислот. Цепи VSG располагают ся на поверхности клетки трипаносомы, как колосья на поле. В состав VSG вхо дят олигосахариды. Структура их раз личается у разных трипаносом. Тополо гически олигосахариды подразделяют на наружные, которые венчают пептид ную цепь, и внутренние, которые распо ложены в глубине гликокаликса. Удиви тельно, но наружные олигосахариды не служат иммуногенетическими эпитопами; иммунодетерминантами являются только наружные белковые части VSG. Примечательно, что на трипаносомах впервые было четко показано, что по верхностные белки гликокаликса ковалентно связаны через этаноламин с гликозилсульфатидилинозитолом, который служит мембранным якорем (рис. 329).
1 Под первым вариантом автор, по-видимому, подразумевает переключение экспрессии на субтеломерную позицию в другой большой хромосоме; второй вариант включает два субварианта, перечисленные далее в абзаце. — Прим. ред.
2Вероятно, речь идет о следующем механизме. Копии VSG-гена, находящиеся в минихромосомах, хотя и расположены субтеломерно, остаются транскрипционно пассивными. Активизация такой молчащей копии произойдет, если она, за счет обмена концевыми участками хромосом, перейдет в транскрипционно активную субтеломерную позицию на большой хромосоме. —
Прим. ред.
3Несмотря на предпринимаемые усилия, функция этих генов и по сей день остается неизвест ной. — Прим. ред.

Молекулярная биология |
383 |
—г~]—гп—ГП— |
—Щ |
|
1ESAG 11 |
[ESAG 2| |
1 VSG |
||||
транскрипция I |
|
|
|
|
|транскрипция |
||||
РНК-доноры r~j |
|
|
|
|
ESAG 1 |
|
ESAG 2 r |
|
VSG |
|
|
|
|
|
|||||
|
|
|
|
|
полицистронная пре-мРНК |
||||
транс-сплаисинг и . присоединение поли-А
[ j ESAG 11 А2
I JESAG2|A2
СVSG
функциональные мРНК в
Рис. 328 . Транс - сплайсинг у т р и п а н о с о м . Гены, к о д и р у ю щ и е РНК - доноры, транскрибиру ются на с о о т в е т с т в у ю щ и е РНК (а). Гены вариабельных поверхностных г л и к о п р о т е и н о в (variable s u r f a c e g l i c o p r o t e i n s — VSG) и двух «генов, связанных с с а й т о м э к с п р е с с и и » (expression site associated genes — ESAG 1 и ESAG 2), т р а н с к р и б и р у ю т с я с о б щ е г о п р о м о тора (Р) на длинную полицистронную пре-мРНК (б). РНК-доноры затем сшиваются с транс криптами индивидуальных генов в составе полицистронной пре-мРНК (в). Таким о б р а з о м , функциональные 5'-концы п р и с о е д и н я ю т с я к экзонам транскриптов ESAG и VSG, а поли - адениновые (поли-А) хвосты ф о р м и р у ю т с я на их З'-концах (по нескольким авторам) .
Сейчас установлено, что многие мемб ранные белки других клеток заякориваются в мембране ковалентными связя ми с гликолипидным якорем.
Кинетопластная ДНК
иредактирование РНК
Вдополнение к стратегии антиген ной изменчивости, трипаносомы обла дают и другой особенностью, которая была впервые обнаружена в митохонд риях трипаносом: феноменом редакти рования РНК. Позднее этот феномен был найден и у других организмов.
Клетка Trypanosoma обладает одной гигантской митохондрией, у которой
имеется особый участок, называемый кинетопластом (см. рис. 47-50). Кинетопласт содержит необычайно большое количество ДНК. Эта митохондриальная ДНК состоит из кольцевых моле кул: около 50 максиколец и 10 ООО миниколец. Кольца сплетены в сложную сеть (см. рис. 50д, е). Максикольца со держат информацию митохондриальных генов. Функция миниколец долгое время оставалась загадкой. Казалось, что многие митохондриальные гены в ДНК максиколец не функциональны: у них нет кодонов начала трансляции или сдвинута рамка считывания. Однако выяснение последовательностей соот ветствующих мРНК показало, что их кодирующие области функциональны.

384 Избранные главы общей протистологии
Наружные олигосахариды
\
V
не |
|
Г |
-N-концевой домен |
|
|
|
|
|
|
|
|
Внутренние |
|
|
|
|
|
|
экспонированные |
Чувствительная к |
|
|
|
олигосахариды ' |
|
|
|||
|
|
\ |
' протеазе область |
|
|
|
|
|
|
|
|
|
|
|
Этаноламин |
|
|
С-концевой домен |
|
Фосфатидилинозитол |
|
|
|
|
|
|
|
||
|
Олигосахаридный1ИЛИ/или |
\\\\»' |
|
|
|
|
гликолипидный якорь |
|
|
|
|
|
|
|
|
Рис. 329. Схема стро |
|
|
|
|
Плазматическая мембрана |
е н и я |
VSG Trypano |
|
|
|
soma |
congolense (по |
|
Рису).
Это означает, что лишенная смысла последовательность ДНК преобразует ся в осмысленную в мРНК. Этот про цесс называется редактированием РНК (или иногда РНК-редактированием). У трипаносом уридин-монофосфатные (УМФ) основания вставлены в премРНК после транскрипции. У некото рых генов более 50% кодирующих об ластей не найдены в самом гене, но появляются в результате редактирова ния. В ряде случаев удаляется также и уридин. Степень редактирования одно го и того же гена различна у разных видов. Так, у одного вида определенная мРНК подвергается кардинальным из менениям, а тот же ген у другого вида вовсе не редактируется. Было показано, что необходимая для корректной встав ки или удаления уридина информация
кодируется в миникольцах. Это и есть дотоле неизвестная функция миниколец. Короткая РНК, так называемая на правляющая РНК (guide RNA, гидРНК), транскрибируется с миниколец ДНК и снабжает информацией процесс редактирования. Необходимо, чтобы комплементарное спаривание премРНК и направляющей РНК произош ло вплотную к сайту начала редактиро вания. Гипотетическая эдитосома, веро ятно, стабилизирует этот комплекс и участвует в добавлении и удалении УМФ (рис. 330).
Редактирование РНК теперь обна ружено и у других организмов. Оно идет в митохондриях Physarum и расте ний, у вирусов и даже в ядрах млекопи тающих. Однако механизм редактиро вания и его особенности у этих организ-

Молекулярная биология |
3 8 5 |
ДНК |
1- |
|
|
Транскрипция J |
Транскрипция^ |
|
3 ' - * С А А С — 5' |
|
гид-РНК |
Эдитосома
Отредакти |
|
рованная |
|
мРНК |
UGU ААС CUG UUG CUU AAC GUC |
Рис. 330 . Редактирование РНК в митохондрии т р и п а н о с о м (по Ш у с т е р и Бренике) .
мов отличаются от тех, что найдены у трипаносом.
Является ли процесс редактирова ния РНК реликтом времен пребиотической РНК (что кажется маловероят ным), или он дает дополнительную эво люционную пластичность, или имеет другое неизвестное значение? Ответ еще предстоит найти.
Специфика
молекулярных процессов у инфузорий
В результате интенсивного изучения методами молекулярной биологии ин фузории стали предметом особого ин тереса с общебиологических позиций сразу в нескольких аспектах.
Структура генома и его преобразования
Самая яркая особенность инфузо рий — ядерный дуализм. Каждая клет ка содержит от одного до нескольких мелких микронуклеусов, которые вы полняют генеративную функцию, и от одного до нескольких крупных и содер жащих большое количество ДНК мак ронуклеусов, которые отвечают за сома тические, или вегетативные функции. Микронуклеус содержит нормальные эукариотные хромосомы и делится пу тем митоза или мейоза. Макронуклеу сы, наоборот, не имеют классических хромосом и делятся при помощи ами тоза. Наличие генеративного и вегета тивного ядер в одной клетке, а также подозрительное несходство двух типов

3 8 6 Избранные главы общей протистологии
SI Pb Ld Lc Sc Т, Тг Т3
Рис. 3 3 1 . Разделение фрагментированной макронуклеарной ДНК Tetrahymena мето д о м пульс - электрофореза . Макронуклеар-
ная ДНК двух клонов Т. |
thermophila (Tv |
Т2) |
и б л и з к о р о д с т в е н н о й Т. |
pyriformis (Т3 ) |
ра |
зогнаны на агарозном геле. Для сравнения в форез включены: макронуклеарная ДНК
Stylonychia |
lemnae |
(SI) |
и |
Paramecium |
bursaria (Pb), |
а также х р о м о с о м ы д р о ж ж е й |
|||
{Saccharomyces cerevisiae, |
Sc), |
конкатеме- |
||
р ы 1 фага лямбда (Lc) и ДНК фага лямбда, обработанная гидролазами (Ld). Длина по втора в конкатемерах фага лямбда состав ляет 49 т.п.н. Размеры фрагментов макро нуклеарной ДНК Tetrahymena варьируют от 20 до более 1000 т .п.н. Гораздо меньшие по размеру молекулы ДНК других видов ин фузорий уходят за пределы геля п р и этих условиях.
1 Конкатемер ДНК образован тандемно повто ряющимися единицами генома. — Прим. пер.
ядер давно заинтересовали исследова телей, которые стали активно изучать организацию генома и структуру гена инфузорий.
Из тысяч видов инфузорий деталь но изучены лишь немногие из подклас са Hymenostomata (преимущественно представители родов Tetrahymena и Paramecium) и ряд видов из подклассов Stichotrichia и Hypotrichia (главным об разом, Stylonichia, Oxytricha и Euplotes).
Сравнения геномов микро- и макронук леуса у этих видов привели к обнаруже нию удивительных и совершенно нео жиданных различий в их молекулярной организации.
Новый макронуклеус начинает раз виваться из микронуклеуса после поло вого процесса (в форме конъюгации или автогамии). Незрелый макронукле ус называют макронуклеарным зачат ком. В ходе развития макронуклеуса его геном претерпевает глубокие измене ния. В макронуклеарном зачатке Tetra hymena 10-20% нуклеотидов исходного генома удаляется в ходе сложных пере строек. Микронуклеарная ДНК предпо ложительно хромосомного размера фрагментируется примерно на 200 от дельных молекул ДНК, размер которых варьирует от 20 до 1 500 т.п.н. (рис. 331). Самые мелкие молекулы ДНК в макронуклеусе представлены димерамн генов рРНК. Одиночный ген рРНК микронуклеарного генома вырезается и уд ваивается, и эти две копии сшиваются в палиндромный димер, то есть «голо ва к голове». В ходе фрагментации к концам всех молекул ДНК присоединя ются специальные теломеры. За идет амплификация; количество копий разных фрагментов неодинаково.

У некоторых цилиат происходит более кардинальная реорганизация мак ронуклеуса. В результате нескольких циклов репликации исходных хромосом в зачатке макронуклеуса этих видов формируются политенные хромосомы (см. рис. 302). Иногда репликация идет избирательно, и тогда разные гены по лучают неодинаковое количество ко пий. У Stylonychia удаляется до 98% нуклеотидов микронуклеарной ДНК, у других видов меньше. Причем удаляют ся как уникальные, так и повторяющи еся последовательности, и в первую очередь элиминируются транспозонподобные элементы. Наконец, ДНК фрагментируется на мелкие участки размером в один ген, насчитывающие от 100 до 15 ООО п.н. (рис. 332). У Tetra hymena каждый фрагмент снабжается особыми теломерами и амплифицируется до специфичного для каждого гена количества копий, которое варьирует от немногих сотен до более чем миллиона. Общая организация макронуклеарных молекул ДНК размером в ген у стихотрих и гипотрих показана на рисунке 333.
К настоящему времени более 50 ге нов инфузорий клонированы и полнос тью секвенированы. Для ряда генов уда лось прочесть полную последователь ность нуклеотидов и в микронуклеусе, и в макронуклеусе. Сопоставление этих двух версий одного и того же гена вы явило очередную странную черту гено ма инфузорий: микронуклеарные вер сии некоторых генов гипотрих содер жат так называемые внутренние элими нируемые последовательности (internal eliminated segments, или internal eliminated sequences — IES), которые вырезаются
Молекулярная биология |
387 |
А В С D E F G
Рис. 332. Макронуклеарные и микронукле арные ДНК различных видов инфузорий ра зогнаны обычным электрофорезом на ага - розном геле. Гель окрашен б р о м и д о м э т и - дия . Дорожка А — маркер; д о р о ж к и В-Е со д е р ж а т м а к р о н у к л е а р н у ю ДНК г и п о т р и х ; д о р о ж к а F — макронуклеарную ДНК Para mecium и д о р о ж к а G — микронуклеарную ДНК г и п о т р и х . Д л и н а ф р а г м е н т о в макро - нуклеарной ДНК гипотрих варьирует от ме нее 0,5 т . п . н . д о б о л е е 1 0 т . п . н . Т о н к а я структура паттерна полос макронуклеарной ДНК г и п о т р и х ( д о р о ж к и В-Е) р а з л и ч н а у различных в и д о в . М а к р о н у к л е а р н а я ДНК других инфузорий и микронуклеарная ДНК имеет много больший молекулярный вес и потому не фракционируется этим методом .
п р и ф о р м и р о в а н и и м а к р о н у к л е а р н о й в е р с и и э т о г о г е н а . Е щ е более п о р а з и т е л е н т о т факт, ч т о ф р а г м е н т ы и с х о д н о г о к о д а , к о т о р ы е н е э л и м и н и р у ю т с я и с о с т а в л я ю т м а к р о н у к л е а р н у ю в е р с и ю г е н а — т а к н а з ы в а е м ы е п о с л е д о в а т е л ь н о с т и , п р е д н а з н а ч е н н ы е д л я м а к р о н у к л е у с а ( m a c r o n u c l e a r d e s t i n e d s e q u e n ces — MDS), — в и с х о д н о й в е р с и и г е н а р а с п о л о ж е н ы в и н о м п о р я д к е , а н е к о т о р ы е ф р а г м е н т ы д а ж е з а п и с а н ы с з а д и н а п е р е д . П е р в ы й р а с ш и ф р о в а н н ы й г е н
