
Кваснiцкий Спецiальнi способи зварювання
.pdfвипадку ковалентного зв'язку, а всіма атомами, тобто утворюють електронний "газ", що заповнює весь кристал. За теорією вільного електрона Друде, позитивні іони металу, які виникли внаслідок втрати валентних електронів, утворюють кристалічну гратку. Взаємодія між іонами та валентними електронами визначає стійкість усієї системи.
Утворення металічного зв'язку в кристалах обумовлено двома принципово важливими явищами [10]:
1.Кожний атом набуває структури попереднього інертного газу і виникають відповідні зменшенню енергії сили притягання.
2.Колишні валентні електрони атомів стають усуспільненими, тобто утворюється електронний газ, що належить усьому кристалу.
Наприклад, атом натрію має в ізольованому стані електронну конфігурацію 1s22s22p63s1 і, віддавши до складу електронного газу єдиний валентний 3s-електрон, набуває стабільної структури атому неону 1s22s22p6. Це призводить до енергетичного виграшу: кулонівська взаємодія колективізованих електронів з атомними залишками утримує перші в об'ємі кристала.
Електронний газ компенсує сили відштовхування між іонами і зв'язує їх у тверде тіло. Більшість металів мають щільно упаковані кристалічні ґратки: кубічну гранецентровану (г.ц.к. ґратку) і гексогональну щільно упаковану (г.щ.у. ґратку). Перехідні тугоплавкі метали (хром, молібден, вольфрам, ванадій, тантал) мають кубічну об'ємноцентровану ґратку (о.ц.к. ґратка). Таку ж ґратку має залізо до температури 910 °С. У кристалах цих елементів, крім металічного зв'язку, діє також ковалентний зв'язок, зумовлений електронами внутрішніх незайнятих оболонок.
Таким чином, метал складається з двох підсистем: легкої та важкої. Легка підсистема – це колишні валентні електрони атомів металу, що дуже рухливі і миттєво реагують на будь-яке електромагнітне поле. Важка підсистема – це атоми, які в процесі виникнення металічно-
21
го стану речовини втратили свої валентні електрони. У кристалічних металах вони знаходяться у вузлах кристалічної ґратки. В аморфних металах вони не утворюють у просторі правильних геометричних структур, але деякі ознаки порядку в їх розташуванні існують. В обох випадках атоми перебувають у постійному русі. Оскільки валентні електрони стають спільними для всієї важкої системи, то металічний зв'язок не носить направленого характеру, чим обумовлена пластичність та здатність металу до деформування.
У металах існує три види явищ, що пов'язані з їх будовою [10]: явища, в яких легка підсистема (електронний газ) проявляє свої властивості автономно (електропровідність при низьких температурах, парамагнетизм вільних електронів тощо); явища, в яких важка підсистема (атоми) проявляє свої властивості значною мірою незалежно від електронного газу (пластичні властивості, ґраткові теплоємність та теплопровідність, теплове розширення тощо); явища, суть яких полягає в сильній безпосередній взаємодії легкої і важкої підсистем (електропровідність, надпровідність, електрофізичні властивості у високочастотних полях).
Наведена вище класифікація фізичних явищ у металах є умовною, оскільки не можна відокремити одну підсистему від іншої. Наприклад, висока пластичність металів обумовлена самою природою металевого стану, а саме – неспрямованістю металічних зв'язків. Але така класифікація дозволяє виділити основні риси і характерні особливості явищ. Відповідно виділяють електронні властивості металів (термоелектронну емісію, надпровідність, електричний опір тощо), які обумовлені самою електронною системою та її взаємодією з ґраткою.
Валентна зона металів містить незайняті рівні безпосередньо над рівнем Фермі. При передачі електронам незначної енергії вони можуть переходити на незайняті рівні, тобто збуджуватися. Низька енергія збудження електронів обумовлює теплота електропровідність металів.
22
Усуспільнення валентних електронів у металах призводить до того, що в твердому стані металу вони займають більш низькі енергетичні рівні, ніж в ізольованому атомі, і забезпечують енергію зв'язку твердого тіла аналогічно до утворення хімічного зв'язку.
1.1.3 Кристалічна структура твердих тіл. Під кристалічною структурою розуміють таке розміщення атомів (іонів, молекул) у кристалі речовини, яке відповідає періодичному повторенню певного "узору" в трьох вимірах. Основна особливість кристалічного твердого тіла полягає в тому, що будь-який конкретний об'єм речовини можна отримати послідовною прибудовою до вже існуючої речовини елементарної комірки кристалічної ґратки. Отже, для геометричного опису певної ідеальної кристалічної структури досить знати її елементарну комірку.
Кристалічна структура описується за допомогою моделей кристалічної ґратки, яка має розміщення в певній закономірності точок, навколо яких коливаються атоми в кристалі. Кожна точка при цьому має однакове оточення та є вузлом ґратки.
Існують теорії досконалої (ідеальної) і недосконалої (реальної) структури. Теорія ідеальної структури певною мірою може бути описана електронною структурою речовини. Оскільки закономірне розміщення атомів відповідає більш рівноважному стану, то всі тверді тіла повинні були б мати кристалічну будову. Однак існують аморфні тіла (наприклад, скло), які мають розміщення атомів, характерне для рідкого стану. Ці тіла можна розглядати як сильно переохолоджені рідини, в яких спостерігається лише ближній порядок. При швидкості охолодження більше 106 К/с аморфний стан можна зафіксувати і в металів (металеве скло).
Математично доведено, що можна 14-ма різними способами розмістити точки в просторі, кожна з яких буде мати однакове оточення. Більшість металів мають порівняно прості кристалічні структури, такі,
23
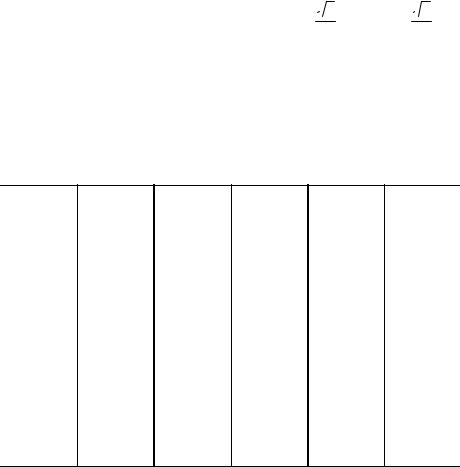
як кубічна об'ємноцентрована (о.ц.к.), кубічна гранецентрована (г.ц.к.), гексагональна щільно упакована (г.щ.у.).
Для різних типів ґраток важливі такі характеристики, як координаційне число, атомний радіус, щільність упаковки. Координаційне число показує кількість найближчих сусідніх атомів і дорівнює для о.ц.к. – 8, г.ц.к. – 12, г.щ.у. – 12.
Атомний радіус визначається як половина відстані між найближ-
чими сусідами в кристалі і дорівнює для о.ц.к. –  43 a , г.ц.к. –
43 a , г.ц.к. –  42 a ,
42 a ,
де а – ребро куба.
Відносна щільність упаковки показує долю об'єму, зайнятого сферичними атомами в об'ємі всієї структури, і складає для о.ц.к. – 68,1 %, г.ц.к. – 74,0 %.
Атомні радіуси деяких елементів наведено в табл.1.2.
Таблиця 1.2. Атомні радіуси деяких елементів
Елемент |
Атомний |
|
Елемент |
Атомний |
|
Елемент |
Атомний |
радіус, Å |
|
радіус, Å |
|
радіус, Å |
|||
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
Al |
1,43 |
Hf |
1,58 |
Rh |
1,34 |
||
|
|
|
|
|
|
|
|
Ag |
1,44 |
|
Ir |
1,36 |
|
Ru |
1,32 |
|
|
|
|
|
|
|
|
Au |
1,44 |
|
K |
2,31 |
|
Si |
1,18 |
|
|
|
|
|
|
|
|
Be |
1,11 |
|
Li |
1,52 |
|
Sn |
1,41 |
|
|
|
|
|
|
|
|
C |
0,72 |
|
Mg |
1,60 |
|
Ta |
1,43 |
|
|
|
|
|
|
|
|
Co |
1,43 |
|
Mo |
1,36 |
|
Ti |
1,45 |
|
|
|
|
|
|
|
|
Cd |
1,49 |
|
Na |
1,86 |
|
Th |
1,80 |
|
|
|
|
|
|
|
|
Cr |
1,25 |
|
Ni |
1,25 |
|
Tl |
1,70 |
|
|
|
|
|
|
|
|
Cs |
2,63 |
|
Os |
1,34 |
|
V |
1,32 |
|
|
|
|
|
|
|
|
Cu |
1,28 |
|
Pb |
1,75 |
|
W |
1,37 |
|
|
|
|
|
|
|
|
Fe |
1,24 |
|
Pd |
1,38 |
|
Zn |
1,33 |
|
|
|
|
|
|
|
|
Ge |
1,23 |
|
Pt |
1,38 |
|
Zr |
1,59 |
Примітка. 1Å = 1 10–10 м.
24
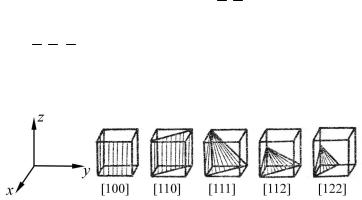
Для позначення розміщення площин використовують індекси Міллера. Для цього в одиницях довжини ребра куба а визначають відрізки, які відсікає площина на вісях x, y, z, і беруть числа, обернені довжині відрізків. Далі приводять отримані дробі до спільного знаменника. Чисельники цих дробів і є індексами Міллера, які записуються в квадратних дужках. Наприклад, площина відсікає на осях, відповідно,
відрізки 3, 2, 1. Обернені числа будуть: 13 , 12 ,1 , дробі зі спільним зна-
менником: 62 , 63 , 66 , а міллерівські індекси [2 3 6]. На рис.1.1 наведено індекси деяких площин кубічних кристалів.
Рис.1.1. Міллерівські індекси деяких площин кубічних кристалів
Тип кристалічної ґратки можна передбачити за числом валентних електронів, віднесених до числа атомів, які утворюють кристалічну структуру [31]. Емпірично встановлено, що для стабільності о.ц.к. ґратки потрібно мати 1,0…1,75 електрона на атом, г.ц.к. ґратки – 2,25… …3,0, г.щ.у. ґратки – 1,75…2,25.
Усі лужні метали мають один електрон на атом і утворюють о.ц.к. ґратку. Наприклад, вільні атоми K i Na мають зовнішню електронну конфігурацію s2p6s1, а в кристалі перетворюються в іон Ме1+ із зовнішньою оболонкою p6, здатною до збудження. При зближенні іонів р-орбіталі перекриваються та утворюється шість спрямованих обмінних зв'язків, орієнтованих уздовж вісей координат, як показано на рис.1.2.
25
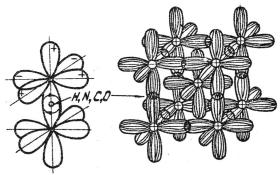
Рис.1.2. Обмінні зв'язки із зовнішніми р6-оболонками (а) та утворення о.ц.к. ґратки (б)
аб
Таким чином, в о.ц.к. металах на неспрямований металічний зв'я- зок (усуспільнення s-електронів і взаємодія електронного "газу" з іонами) накладаються спрямовані вздовж ребер куба ковалентні зв'язки, які можуть істотно знижувати пластичність і навіть викликати крихкість.
При переході від лужних до лужноземельних елементів ІІ групи електронна концентрація валентних електронів зростає до двох на атом. Якщо енергія р-електронів недостатня для перекриття р-орбіталей, то утворюються енергетично більш вигідні щільні упаковки. Так, Be і Mg мають г.щ.у. кристали, а Ca і Sr – г.ц.к. Підвищення енергії при нагріванні Ca і Sr достатньо для перекриття р-орбіталей та утворення о.ц.к ґратки.
Перехідні метали ІІІ групи Sc, Y, La мають три валентних електрони і зовнішню конфігурацію d 1s2, під якою знаходиться заповнена р6-оболонка. При низьких температурах унаслідок неповної іонізації і відсутності перекриття р-орбіталей вони мають г.щ.у. ґратку. При температурі, яка близька до температури плавлення, енергія електронів зростає, проходить повна іонізація і р-орбіталі перекриваються, що призводить до появи о.ц.к. ґратки.
Перехідні метали IV групи Ti, Zr, Hf мають зовнішню електронну конфігурацію d 2s2 з чотирма валентними електронами над заповненою р-оболонкою. При низьких температурах р-орбіталі не перекривають-
26
ся і ці метали мають г.щ.у. ґратку, а з підвищенням температури вони переходять в о.ц.к. структуру.
Метали V групи V, Nb, Ta мають зовнішню електронну конфігурацію d 3s2 або d 4s1 із п'ятьма валентними електронами, а метали VІ групи Cr, Mo, W мають конфігурацію d 5s1 або d 4s2 з шістьма валентними електронами. Всі ці метали мають стабільні s2p6-оболонки. Зближення таких іонів у результаті взаємодії з усуспільненими зовнішніми електронами призводять до перекриття р-орбіталей та утворення о.ц.к. структур.
Коли кількість електронів у незаповненій оболонці атомів d-перехідних металів більше шести, відділення їх усіх стає енергетично невигідним. Тому вищі групові валентності металів VII – VIII груп у неорганічних з'єднаннях не реалізуються. Перехідні метали VII групи Mn, Tс, Re мають зовнішню електронну конфігурацію d 5s2. У зв'язку зі стабільністю d 5-оболонки при утворенні металічної структури, відділення сім електронів неможливе. Тому марганець проявляє стабільну валентність 2+, а Тс і Re – 4+–6+. Марганець утворює ряд складних кристалічних структур, які при 1134 ºС переходять в о.ц.к. кристали, а Тс і Re мають г.щ.у. ґратки.
У перехідних металів VIII групи заповнюється друга половина d-оболонки при наявності одного або двох s-електронів. Атоми Fe мають зовнішню електронну конфігурацію d 6s2, Co – d 7s2, Ni – d 8s2, Ru – d 7s1, Os – d 6s2, Pd – d 10, Pt – d 9s1. Атом заліза в кристалі віддає s2-електрони та іони, що утворюються при цьому, мають конфігурацію d 6. Ці орбіталі можуть перекриватися і за аналогією з р6-орбіталями призвести до утворення о.ц.к. ґратки α- і δ-заліза. У проміжному інтервалі температур відсутність перекриття d-орбіталей забезпечує г.ц.к. ґратку γ-заліза.
У металічному стані іон кобальту, як заліза і нікелю, є двовалентним (Со2+), що свідчить про їх однакову концентрацію усуспільнених
27
електронів (два електрони на атом ). У цьому випадку іон кобальту має електронну конфігурацію d 6s1, а іон нікелю – d 6s2 із зовнішньою сферично симетричною s-оболонкою, що обумовлює утворення щільних упаковок. Кобальт утворює щільно упаковані гексагональну та кубічну α- і β-модифікації, а нікель – г.ц.к. структуру.
Цікаво впливає кобальт на структуру заліза. Розчиняючись у залізі, атоми кобальту можуть віддавати не два, а три електрони з утворенням іону Со3+ із зовнішньою d 6-оболонкою. Це сприяє утворенню о.ц.к. кристалу, тобто кобальт стабілізує структуру, якої він сам не має. Тому в системі Fe–Co кобальт підвищує температуру перетворення α→γ.
Наявність жорстких зв'язків в о.ц.к. ґратках обумовлює схильність тугоплавких металів V, VI груп до окрихчування, що залежить від домішок укорінення, величини зерна тощо. Домішки вкорінення, наприклад, іони H+, N3+, C4+, B3+, що мають малі сферичні оболонки з радіусами 0,15 Å (N3+, C4+) і 0,20 Å (B3+) можуть бути захоплені в область перекриття двох р-орбіталей (див. рис.1.2), де вони міцно утримуються внаслідок утворення стійкого зв'язку з парою електронів з антипаралельними спінами. Так утворюється ще більш жорсткий трицентровий двоелектронний зв'язок по ребру комірки. Такий зв'язок може давати і атом кисню з радіусом 0,3 Å та великою спорідненістю до електронів, що знижує пластичність металів.
Енергія міжатомного зв'язку визначає термодинамічні та механічні властивості металів. Температури і теплоти плавлення, теплоти випаровування, пружні модулі, твердість металів великих періодів зі збільшенням атомного номера при переході від лужних одновалентних металів до металів VI групи (хрому, молібдену та вольфраму) сильно зростають унаслідок збільшення концентрації усуспільнених електронів від 1 до 6 ел/атом та підвищення ефективного заряду іонів. При переході до металів VII–VIII груп указані показники знижуються вна-
28
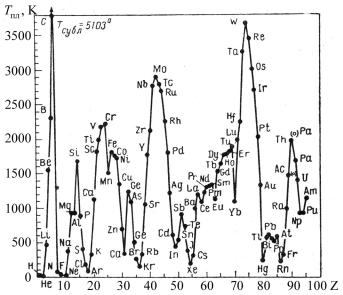
слідок зменшення концентрації усуспільнених електронів. Температури плавлення елементів різних груп показано на рис.1.3.
Рис.1.3. Температури плавлення елементів
Усуспільнені електрони чітко відрізняються від локалізованих у надпровідному стані нижче критичних температур. Внаслідок спінової взаємодії вони утворюють "газ" із двоелектронних "молекул" і рухаються в ґратках без розсіювання, чим і обумовлена їх надпровідність.
1.1.4. Дефекти кристалічної структури твердих тіл. Значні від-
мінності властивостей реальних кристалів від теоретичних властивостей ідеальних кристалів обумовлені дефектами кристалічної будови. Дефекти в кристалічній структурі поділяються за формою і розмірами на точкові, лінійні, поверхневі і об'ємні. Утворення, будову і властиво-
сті цих дефектів описано в роботах [137].
Точкові дефекти являють собою вакансії в кристалічних ґратках і дислоковані атоми, тобто атоми в міжвузіллях ґратки, а також чужорідні атоми заміщення і проникнення (вкорінення).
29

До лінійних дефектів належать ланцюжки вакансій, прониклих атомів, а також дислокації, тобто дефекти з макроскопічними розмірами в одному напрямку.
До поверхневих дефектів належать границі фаз, зерен, субзерен, тобто дефекти з макроскопічними розмірами в двох напрямках, а до об'ємних – дефекти з макроскопічними розмірами в трьох напрямках.
Точкові дефекти. Вакансії та атоми вкорінення є дефектами атомних розмірів. Вакансії можуть виникати в результаті переходу атома (іона) зі свого нормального положення в ґратках у міжвузілля чи на поверхню кристала. Комбінацію вакансії та іона в міжвузіллях називають парою Френкеля. Наявність такої пари відповідає вимогам електронейтральності, яких потрібно завжди дотримуватися. В іонному кристалі вимога електронейтральності задовольняється також при еквівалентній кількості аніонних і катіонних вакансій. Комбінацію аніонної та катіонної вакансій називають парою Шоткі. Якщо в металі утворюється вакансія, то відбувається одночасне видалення позитивного іона та електронів, що компенсують його заряд.
Вакансії можуть виникати в будь-якій структурі і містяться у всіх кристалах.
Утворення вакансії означає розрив зв'язків якогось атома, що вимагає витрати енергії. Якщо вакансія утворюється при переході атома на поверхню, то при цьому відбувається розрив z парних зв'язків із сусідніми атомами в об'ємі і відновлення половини таких зв'язків на
поверхні, тобто 12 z . У такій моделі енергія утворення вакансії дорів-
нює енергії сублімації Е= 12 zw , де z – число найближчих сусідів; w –
енергія парної взаємодії, що за розрахунком повинна складати приблизно 3 еВ. Однак із врахуванням природи металічного зв'язку, зміни електронної структури, а також незначного зближення атомів навколо
30
