
- •1.1 Введение, назначение курса, государственный стандарт
- •1.2 Определения и термины для научных методов
- •Логический метод – логически воспроизводится история развития объекта без случайных, несущественных деталей.
- •1.3 Краткая история развития мировоззрения и естествознания на Земле
- •Мировоззрение древних народов, зарождение научных методов, Вклад древнегреческих ученых в начало наук
- •2.1 Мировоззрение древних народов
- •2.2 Древнегреческая натурфилософия
- •Архимедова механика. Наука в эпоху с 1-го по 15-й век. Введение в математику, математика как язык естественных наук Приложения к лекциям м.Ф. Шабанова. Лекция № 3
- •3.1 Архимедова механика
- •Архимедова механика, которой пользовались древние греки и после них до наших дней.
- •3.Правило винта, домкрата.
- •3.3 Введение в математику, математика как язык и основа естественных наук.
- •Аксиомы
- •Введение в физику. Наука о движении кинематика и ее законы. Динамика, законы Ньютона, как основа механистической картины мира. Приложения к лекциям м.Ф. Шабанова. Лекция № 4
- •4.1 Введение в физику
- •4.2 Наука о движении - кинематика и ее законы Обозначения и единицы измерения.
- •Общие законы движения
- •1 Закон. Если на тело не действуют другие тела, оно сохраняет состояние покоя или равномерного прямолинейного движения. Это закон инерции, первый закон Ньютона.
- •Движение тела по окружности.
- •Динамика, обозначения и единицы измерения.
- •При расстоянии между ними - r
- •Приложения к лекциям м.Ф. Шабанова. Лекция № 5
- •5.1 Гидродинамика, стационарное и турбулентное течение, капилляры.
- •Применение уравнения Бернулли:
- •5.2 Колебания. Волны, звук
- •2. Если нечетное π то вычитание
- •3. Сложение колебаний с близкими частотами ω1, ω2
- •Затухающие колебания.
- •Волновой процесс.
- •Звук, звуковые волны
- •Приложения к лекциям м.Ф. Шабанова. Лекция № 6.
- •6.1 Теплофизика и термодинамика
- •Тепловое расширение твердых тел
- •Уравнение теплопроводности Фурье
- •Уравнение переноса или диффузии газа
- •6.2 Основные положения молекулярно-кинетической теории вещества, законы для идеальных и реальных газов
- •6.3 Газовые законы для идеального газа
- •Законы Гей-Люссака 1802 г.
- •Уравнения Клаперона-Менделеева
- •Связь между скорости движения молеку с температурой и давлением газа
- •6.3 Циклы Карно, тепловые машины Работа газа при расширении
- •6.4 Химия наука о веществе, химических реакциях и химических системах.
- •6.5 Органическая химия
- •Электричество, электродинамика. Электромагнитная картина мира Приложение к лекциям Шабанова м.Ф. Лекция № 7.
- •Особенности электромагнитной картины мира.
- •7.1 Электростатика
- •7.2 Электрический ток, электрические цепи
- •7.3 Электромагнитное излучение и его измерение.
- •Спектральные линии
- •7.4 Геометрическая оптика.
- •Световой поток, сила света и освещенность.
- •Основные составляющие мира. Приложение к лекциям Шабанова м.Ф. Лекция № 8. Структурные составляющие мира - микромир, макромир, мегамир.
- •8.1 Основные, фундаментальные составляющие мира
- •Формула (1) отражает рост массы – m от скорости V. Формула отражает зависимость энергии от массы тела. Обозначения в формулах:
- •Энергия
- •8.2 Свойства и значение информации
- •Особенности современной физики. Понятие о строении материи. Приложение к лекциям Шабанова м.Ф. Лекция № 9.
- •9.1 Ученые и развитие науки в хх-ом веке
- •9.2 Законы сохранения в замкнутых системах и законы симметрии
- •Законы симметрии.
- •9.3 Атомная физика ядра атомов и элементарные частицы
- •Астрономическая картина мира Приложение к лекциям Шабанова м.Ф. Лекция № 10.
- •10.1 Астрономические явления, связанные с вращением Земли и ее движением по орбите
- •10.2 Измерения времени, календарь
- •Календарь.
- •10.3 Солнечная система.
- •10.31 Наша звезда Солнце.
- •Основные типы ядерных реакций, их энерговыделение.
- •10. 32 Планеты солнечной системы
- •19.33 Планеты – гиганты – Юпитер, Сатурн, Уран, Нептун.
- •10.4 Образование солнечной системы, космогонические гипотезы.
- •10.5 Образование Вселенной, элементы космологии.
- •Горячая Вселенная.
- •Адронная эра
- •Биология. Основные понятия, классификации, законы биологии. Приложение к лекциям Шабанова м.Ф. Лекция №11
- •11.1 Основные понятия, уровни биосистеми их составляющие
- •11.2 Генетика, генетический код, одноклеточные организмы
- •11.3 Законы биологии и их возможные применения
- •Литература.
- •История Земли. Возникновение и развитие жизни на Земле Приложение к лекциям Шабанова м.Ф. Лекция №12
- •12.1 Образование Земли и ее строение
- •12.2 Происхождение и развитие жизни на Земле
- •12.3 Биологические эры в истории Земли
- •12.4 Происхождение и эволюция человека
- •Литература.
- •Приложение к лекциям Шабанова м.Ф. Лекция №13
- •13.1 Общесистемные законы, правила и свойства для природных, технических, биологических и социально-экономических систем.
- •4. Закон единства и взаимодействия противоположностей. Всякая система содержит взаимодействующие противоположности, и это взаимодействие служит двигателем эволюции.
- •Заключение по системным законам
- •13.2 Особенности системного анализа социально-экономических систем (сэс) и возможности использования компьютеров в подготовке и принятии решений
- •Управление сэс всегда происходит в условиях неопределённости по трем причинам:
- •13.3 Возможности компьютерных методов разработки и принятия решений
- •Литература.
- •14.1 Законы кибернетики в приложении к управлению социально экономическими системами
- •Cинергетика и информационное управление Приложение к лекциям Шабанова м.Ф. Лекция №15
- •15.1 Синергетика и традиционное научное мышление
- •15.2 Информационное управление человеком и общественной системой
- •15.3 Методы информационного управления и информационной войны
- •Литература.
- •16.2 Научные прогнозы будущего, учение в.И. Вернадского о ноосфере.
- •Литература
6.3 Газовые законы для идеального газа
Идеальным газом называется такой, молекулы которого ничтожно малы (материальные точки), упруги и не связаны межмолекулярными силами.
Закон Бойля - Мариотта 1662 – 1667 гг.
Для данной массы газа при постоянной температуре t = const давление газа изменяется обратно пропорционально объему . PV = сonst.
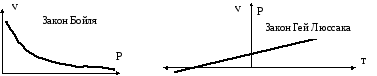
Рис. 18 Графики давления и объема газа для закона Бойля-Мариотта (слева) и Гей Люссака
Зависимость между объемом –V и давлением - Р в законе Бойля =Мариотта. Справа зависимость объема –V и давления -Р от температуры -Т
Законы Гей-Люссака 1802 г.
Для данной массы газа при постоянном давлении (P = const) объем увеличивается пропорционально росту температуры. То же самое при постоянном объеме давление увеличивается с ростом температуры.
V=V0 (1 + αT) P = P0 (1 + αT) Оказалось, что α =1/273,16 К = 1/ 277 К-1, где
Т – температура по шкале Кельвина Т = tc - 273.16, где tc – температура по шкале Цельсия.
Из закона Гей - Люссака следует V/V0 = T/T0 = P/P0
Уравнения Клаперона-Менделеева
В 1834 году Клайперон объединил закон Бойля – Мариотта и Гей-Люссака и получил уравнение PV/T = β = const
В 1875 г. Д.И. Менделеев, исходя из законов Клайперона и Авогадро получил общее выражение уравнения состояния газа, связывающее объем – V, давление Р, температуру Т, массу – м и молекулярную массу – М.
PV = m/M RT, где R – 8,32 дж/моль – газовая постоянная. Она равна работе по расширению газа при нагревании на 1˚К.
Связь между скорости движения молеку с температурой и давлением газа
Связь между скоростью движения и давлением газа. Следует из элементарных соображений. При упругом ударе о стенку импульс силы будет равен удвоенному произведению ∆f • Δt = mV - (-mV) = 2 mV. Сложим все эти удары.
f = m/a ∑Vi2 = m/a N′u2, где u2 – средне квадратичная скорость молекул, a – сторона куба
или P = 2/3 n0 mu2/2 = 1/3 n0Ek Это уравнение Клаузиса
Давление газа прямо пропорционально средней кинетической энергии поступательного движения молекул, содержащихся в единице объема.
Австрийский физик Л.Больцман исследовал зависимость кинетической энергии молекул от температуры и получил формулу на 3 степени свободы
Еk = 3/2 kT, k = 1,38 • 10-23 Дж/к Если i степеней, то Еk = ikT/2.
Если 1 степень свободы, то Ек = 3/2 kT/3 = kT/2 – постоянная Больцмана.
Средняя кинетическая энергия поступательного движения молекул идеального газа зависит от температуры. Соответственно подставим в уравнение Клаузиса кинетическую энергию Больцмана и получим зависимость давления от температуры.
Из уравнения Клайперона - Менделеева выводится формула Авогадро для одного моля газа
PVm = NAkT, откуда Vm = NAkT/P
Объем одного моля газа прямо пропорционален температуре и обратно пропорционален давлению.
Среднеквадратичная скорость молекул – u2. Найдем из формулы Больцмана.
Еk = mu2/2 = 3kT/2 или u2 = 3kT/m U = √3kT/m = √3RN/(NAm) = √3RT/m
Для данного газа средняя квадратичная скорость молекул пропорциональна корню квадратному из термодинамической температуры и зависит только от нее. Распределение молекул по скоростям движения исследовал Максвелл. Он получил формулу для наиболее вероятной скорости движения. Vb = √2RT/m
Уравнения Ван-дер-Ваальса для молекул реального газа, у которого часть объема молекул занято самими молекулами газа.
( Р+/V2
м) (Vм–в)=RТ
Р+/V2
м) (Vм–в)=RТ
Всякое вещество может быть газообразным, жидким и твердым.
|
Р
Vм
|
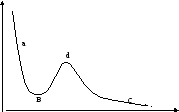
Если сжимать жидкость, то можно получить состояние растянутой жидкости – ав, насыщенного пара – вd и парообразное состояние – dc. Для каждого вещества существует такая температура, выше которой газ не может превращаться в жидкость ни под каким давлением. Эта температура называется критической. Рис.19 График зависимости давления и объема для реального газа.
|
Для земной атмосферы, находящейся в поле тяготения Земли, закономерно уменьшение температуры в среднем на –6,5 градуса при подъеме на 1км. В результате на высоте 10 км температура падает от +15 до –50 градусов. Далее падение температуры замедляется и на высоте несколько десятков км начинается повышение температуры с высотой. При том мизерном давлении это не ощутимо для человека и летательного аппарата. Просто молекулы воздуха носятся с большой скоростью, подгоняемые солнечным излучением и потоком частиц от Солнца (солнечный ветер), редко сталкиваясь и достигая скоростей нескольких км/сек. А повышение скорости дает повышение температуры, в соответствии с выше приведенной формулой Больцмана. При этом самые легкие атомы воздуха достигают второй космической скорости и убегают из атмосферы Земли, становясь микро планетами, заполняющими окрестности Солнца.
Давления с высотой уменьшается по барометрической формуле для Земли:
h = 8000*lg(Po/Ph) где h высота в метрах, Po, Ph – давление на уровне моря и заданной высоте. Таким образом, измерив, давление на возвышенности можно определить ее высоту, что на много проще чем пытаться измерить ее в метрах. В справочниках по Земной атмосфере приводятся более точные данные по изменению температуры и давления с высотой.
