
stennikova2
.pdfМинистерство образования и науки Российской Федерации
ГОУ ВПО «Алтайский государственный технический университет им. И. И. Ползунова»
М. Ф. Стенникова, Н. П. Мусько, О. С. Беушева, Н. Г. Комарова
Руководство по физической химии
Учебное пособие
Часть II
Барнаул 2010
УДК 541.1
Руководство по физической химии. Часть 2.: учебное пособие / М. Ф. Стенникова, Н. П. Мусько, О. С. Беушева, Н. Г. Комарова; Алт. гос. техн. ун- т им. И. И. Ползунова. – Барнаул : Изд-во АлтГТУ, 2010 – 107 с.
Рецензенты:
Т. Ф. Свит, профессор кафедры ТНВ АлтГТУ им. И. И. Ползунова А. С. Потапов, к.х.н., доцент АлтГТУ им. И.И. Ползунова Г. В. Оствальд, к.х.н., доцент кафедры химии АГАУ
Рекомендовано Алтайским государственным техническим университетом им. И. И. Ползунова в качестве учебного пособия для студентов АлтГТУ, обучающихся по специальностям: 280201
ООС; 240801 МАХП; 260201 ТПЗ; 260501 ТОП; 260204 ТБПВ; 260303 ТМП; 260202 ТХ. Протокол № 3 заседания НМС АлтГТУ от 17.11.2010 г.
2
|
Содержание |
|
1 РАСТВОРЫ................................................................................................................................. |
6 |
|
1.1 |
Основные понятия и определения..................................................................................... |
6 |
1.2 |
Способы выражения состава раствора ............................................................................... |
6 |
1.3 |
Закон Рауля. Идеальные растворы...................................................................................... |
7 |
1.4 |
Следствия из закона Рауля .................................................................................................. |
9 |
1.4.1 Повышение температуры кипения идеального раствора......................................... |
9 |
|
1.4.2 Понижение температуры замерзания раствора....................................................... |
10 |
|
1.5 |
Осмотическое давление.................................................................................................... |
10 |
1.6 |
Реальные растворы............................................................................................................. |
12 |
1.6.1 Отклонения от закона Рауля....................................................................................... |
12 |
|
1.6.2 Активность. Коэффициент активности……………………………………………15 |
||
1.7 |
Растворимость.................................................................................................................... |
15 |
1.7.1 Растворимость твердых веществ в жидкости............................................................ |
15 |
|
1.7.2 Растворимость газов в жидкости................................................................................ |
16 |
|
1.7.3 Взаимная растворимость жидкостей ......................................................................... |
18 |
|
1.8 |
Равновесие жидкий раствор – насыщенный пар в различных жидких смесях.............. |
20 |
1.8.1 Неограниченно смешивающиеся жидкости.............................................................. |
20 |
|
1.8.1.1Состав пара и жидкости. Законы Коновалова…………………………………..21
1.8.1.2Разделение бинарных смесей путем перегонки…………………………………23
1.8.2 Равновесие жидкость пар для практически несмешивающихся жидкостей…….27 1.8.3 Равновесие жидкость пар для ограниченно смешивающихся жидкостей……....29
1.9 Закон распределения Нернста........................................................................................... |
30 |
1.10 Примеры решения задач.................................................................................................. |
12 |
1.11 Вопросы для самоконтроля............................................................................................. |
36 |
2 ЭЛЕКТРОХИМИЯ................................................................................................................... |
36 |
2.1 Электрическая проводимость растворов электролитов .................................................. |
36 |
2.1.1 Сильные и слабые электролиты................................................................................ |
36 |
2.1.2 Удельная электрическая проводимость..................................................................... |
37 |
2.1.3 Молярная и эквивалентная электрические проводимости....................................... |
40 |
2.1.4 Числа переноса…………………… .......................................................................... |
392 |
2.2 Кондуктометрия................................................................................................................. |
42 |
2.2.1 Определение растворимости труднорастворимой соли........................................... |
42 |
2.2.2 Определение предельной эквивалентной электрической проводимости растворов |
|
сильных электролитов......................................................................................................... |
43 |
2.2.3 Кондуктометрическое титрование............................................................................ |
43 |
2.3 Электродные процессы...................................................................................................... |
44 |
2.3.1 Основные понятия и определения ............................................................................. |
44 |
2.3.2 Классификация электродов........................................................................................ |
47 |
2.3.3 Типы гальванических элементов................................................................................ |
50 |
2.3.4 Диффузионный потенциал ........................................................................................ |
51 |
2.3.5 Потенциометрическое титрование............................................................................. |
52 |
2.4 Скорость электрохимических реакций............................................................................. |
55 |
2.4.1Поляризационные кривые…………….…………………………………………….57
2.4.2Перенапряжение .......……………………………………..…………………………58
2.4.3 Электролиз................................................................................................................... |
59 |
2.4.3.1Электролиз водного раствора CuCl2………………………………………….….59
2.4.3.2Электролиз водного раствора К2SО4 с использованием инертных анодов….. 61
2.4.3.3 Законы Фарадея........................................................................................................ |
62 |
2.5 Примеры решения задач................................................................................................ |
63 |
2.6 Вопросы для самоконтроля............................................................................................... |
71 |
3
3 КИНЕТИКА ......................................................................................................................... |
72 |
|
3.1 |
Скорость химической реакции.......................................................................................... |
72 |
3.2 |
Кинетическая классификация химических реакций........................................................ |
74 |
3.2.1 Молекулярность реакции............................................................................................ |
75 |
|
3.2.2 Порядок реакции......................................................................................................... |
76 |
|
3.3 |
Влияние температуры на скорость реакции. Энергия активации................................... |
80 |
3.4 |
Методы определения порядка реакции............................................................................ |
84 |
3.5 Сложные реакции………………………………………………………………………..89 |
||
3.5.1 Параллельные реакции ............................................................................................... |
90 |
|
3.5.2 Обратимые реакции .................................................................................................... |
91 |
|
3.5.3 Последовательные реакции........................................................................................ |
92 |
|
3.5.4 Сопряженные реакции................................................................................................ |
95 |
|
3.5.5 Метод стационарных концентраций......................................................................... |
96 |
|
3.5 |
Примеры решения задач.................................................................................................. |
100 |
3.6 |
Вопросы для самоконтроля............................................................................................. |
106 |
Литература ................................................................................................................................. |
107 |
|
4
1 РАСТВОРЫ
1.1 Основные понятия и определения
Растворы – это гомогенные системы переменного состава, образованные не менее чем двумя независимыми компонентами. Растворы образуются за счет всех возможных сил взаимодействия между всеми составляющими ее частицами.
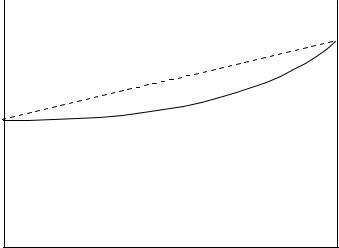
Раствор образуется из компонентов самопроизвольно. Поэтому, его образование при постоянных температуре и давлении, идет с уменьшением энергии Гиббса. Величина энергии Гиббса одного моля раствора зависит от состава (рисунок 1.1)
G |
|
|
GB |
GA |
|
A |
B |
Пунктирная линия - энергия Гиббса системы из несмешивающихся компонентов А и В. Кривая линия - энергия Гиббса гомогенной системы, все ее точки лежат ниже прямой линии.
Рисунок 1.1 - Энергия Гиббса бинарного раствора
1.2 Способы выражения состава раствора
Приведем те из способов выражения состава растворов, которые наиболее часто применяются при изучении физико-химических свойств растворов и описании физико-химических закономерностей:
а) в виде долей или процентов.
Массовая доля Wi и массовый процент Wi, (%)
W = |
mi |
, |
Wi (%) = |
mi |
.100 % , |
|
|
||||
i |
Σmi |
|
∑mi |
||
где mi ,∑mi - масса i-го компонента и масса всего раствора.
Объемная доля ϕi и объемный процент ϕi , (%)
ϕi = |
Vi |
, |
ϕi (%) = |
Vi |
100 % , |
|
V |
||||||
|
||||||
|
|
|
Vîáù |
|||
|
общ |
|
|
|
|
|
5

где Vi, Vобш – объем i-гo компонента и общий объем раствора.
Молярная доля Xi и молярный процент Xi, (%)
X |
i |
= |
ni |
, |
X |
(%) = |
ni |
100 % , |
|
∑n |
∑n |
||||||||
|
|
|
i |
|
|
||||
|
|
|
i |
|
|
|
i |
|
где ni , ∑ni - количество i-гo компонента и общее количество всех
компонентов раствора, моль; б) в виде концентраций.
Молярная концентрация, С, моль/м3; моль/л - это количество вещества в единице объема раствора:
C = ni . |
|
i |
Vобщ |
|
|
Примеры обозначения: С(Н2SO4) = 0,1 моль/л; C(NH4+) = 20 моль/л;
Молярная концентрация эквивалента (нормальность) - то же, что и молярная концентрация, но в качестве структурной единицы взят эквивалент.
В некоторых реакциях, в частности, нейтрализации, окислениявосстановления, ионного обмена, принимает участие не целая частица, а лишь ее часть, называемая эквивалентом. Эквивалент есть 1/Z часть молекулы. При Z = 1 эквивалент идентичен самой частице. Число Z называется числом эквивалентности (или фактором эквивалентности).
Пример обозначения: С( 12 Н2SO4) = 0,1 моль/л.
Молярная концентрация эквивалента больше или равна молярной концентрации. Так, С( 12 Н2SO4) = 2С(Н2SO4); С(НСl) = С(НСl). В первом случае
число эквивалентности равно двум, во втором случае - единице.
Массовая концентрация - масса данного вещества в единице объема раствора (не путать с плотностью):
|
mi |
|
|
Σm |
||
gi = |
, кг/м3; |
(ρ = |
i |
) . |
||
V |
||||||
|
||||||
|
Vобщ |
|
общ |
|||
Моляльность - количество вещества в 1 кг растворителя:
bi = |
ni |
. |
|
||
|
mр−ля |
|
Пример обозначения: b(H2S04 /H20) = 0,1 моль/кг. Часто в литературе моляльность обозначается "m". Однако, согласно ГОСТ 8.417-2002, моляльность (в отличие от массы) должна обозначаться b.
1.3 Закон Рауля. Идеальные растворы
Свойства растворов являются сложной функцией состава, температуры, давления и в значительной мере определяются характером межмолекулярных взаимодействий, главным образом, соотношением энергий взаимодействия между одно- и разнородными частицамиε1−1 , ε2−2 , ε1−2 . Предсказать свойства
6
растворов, зная их состав и свойства компонентов, удается лишь для простейших случаев - идеальных растворов. Они получаются из веществ с одинаковыми размерами молекул и энергиями межчастичных взаимодействий:
ε1−1 = ε2−2 = ε1−2 .
При этом смешение не сопровождается тепловым эффектом, ∆Нсмеш = 0, изменениемобъемаприсмешении ∆V ñìåø =V ð−ð − ∑Vio = 0; ∆Sсмеш = −R∑ni ln Xi .
При анализе результатов измерений давления насыщенного пара растворов нелетучих веществ Ф. Рауль обнаружил, что:
«Парциальное давление насыщенного пара растворителя над раствором пропорционально его молярнойдолев растворе»:
P1 = KX1ж,
где К - коэффициент пропорциональности, равный P1o - давлению пара чистого растворителя.
P = P0 X ж . |
(1.1) |
||
1 |
1 |
1 |
|
Эта закономерность получила название закона Рауля.
Примечание: в термодинамике принято цифрой 1 обозначать растворитель; цифрой 2 – растворенное вещество.
Растворы, в которых оба компонента летучи и каждый из них подчиняется закону Рауля, являются идеальными.
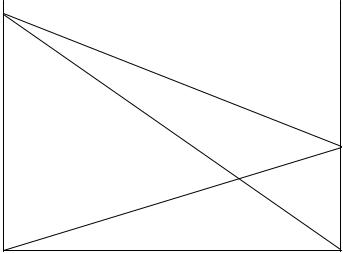
Линейная зависимость парциального давления от состава приводит к линейной зависимости и общего давления от состава (рисунок 1.2). Так, для системы А - В:
PA = PA0 X A ; PB = PB0 X B ; Pобщ = PA + PB = PA0 X A + PB0 X B . |
(1.2) |
ПосколькуХА + Хв = 1,
Pобщ = PA0 X A + PB0 (1− X A ) = PBo + (PA0 − PB0 )X A .
P0A
|
|
|
Р |
б |
= |
|
|
|
|
|
|
|
|
||
|
|
|
|
о |
щ |
Р |
+ |
|
|
|
|
|
А |
||
|
|
|
|
|
|
Р |
|
|
|
|
Р |
= |
|
В |
|
|
|
|
|
|
|||
|
|
|
|
|
|
||
|
|
|
А |
|
Р |
0 |
|
|
|
|
|
|
АХ |
|
|
|
|
|
|
|
|
А |
|
|
0 |
|
|
|
|
|
|
|
Р |
Х |
|
|
|
|
|
= В |
В |
|
|
|
|
||
Р |
|
|
|
|
|
|
|
В |
|
|
|
|
|
|
|
P0B
A B
Рисунок 1.2 - Зависимость парциальных и общего давления паров от состава идеального раствора
7

|
Часто закон Рауля используется в виде уравнения: |
|
|
||||||||||
|
|
|
|
∆P |
= |
(P0 − P ) |
= Х2, |
|
|
|
(1.3) |
||
|
|
|
|
1 |
|
1 |
1 |
|
|
|
|||
|
|
|
|
P0 |
|
|
P0 |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
1 |
|
|
|
|
|
|
что отвечает формулировке: |
|
|
|
|
|
|
|
|
|
||||
|
«Относительное понижение давления пара растворителя над |
||||||||||||
раствором равно молярной доле растворенного вещества». |
|
|
|||||||||||
|
1.4 Следствия из закона Рауля |
|
|
|
|
|
|||||||
|
По закону Рауля давление растворителя над раствором всегда ниже, чем |
||||||||||||
над |
чистым |
растворителем, |
P1 |
< |
P0 . |
Это |
приводит |
к |
повышению |
||||
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
температуры кипения раствора и понижению температуры замерзания |
|||||||||||||
растворителя из раствора нелетучего компонента по сравнению с |
|||||||||||||
соответствующими температурами для чистого растворителя. |
|
|
|||||||||||
|
1.4.1 Повышение температуры кипения идеального раствора |
||||||||||||
|
Кипение жидкости наступает тогда, когда давление насыщенного пара |
||||||||||||
над раствором равно внешнему давлению. Зависимость давления |
|||||||||||||
насыщенного пара от температуры определяется уравнением Клаузиуса- |
|||||||||||||
Клапейрона |
d ln P = |
∆H , рисунок 1.3. |
|
|
|
|
|||||||
|
|
dT |
|
RT 2 |
|
|
|
|
|
|
|
|
|
|
P |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
2 |
|
|
|
Pвнешн. |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
3 |
|
|
||
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
01 |
|
|
|
|
|
|
|
|
|
|
|
|
02 |
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Тз |
Тз |
Тз |
|
|
|
Тк |
|
Тк |
Тк Т |
|
|
|
|
2 |
1 |
0 |
|
|
|
0 |
|
1 |
2 |
|
|
|
Рисунок 1.3 - Давление пара в зависимости от температуры: 1 - для |
||||||||||||
чистого растворителя; 2, 3 - для растворов, Сз > С2; 4 - для твердого чистого |
|||||||||||||
растворителя |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 |
|
|
|
|

Давление насыщенного пара чистого растворителя равно внешнему при Τ0к , давление паров над растворами (2 и 3) при этой температуре меньше
давления пара чистого растворителя (по закону Рауля), следовательно, оно меньше внешнего, и потому кипения растворов не будет. Внешнее давление для них достигается при более высоких температурах T1ê , T2ê . Величина
повышения температуры кипения: T к −T0к = ∆T = Kэ · b,
где Кэ - эбулиоскопическая постоянная - величина, равная повышению температуры кипения одномоляльного раствора неэлектролита. Значение Кэ
определяется свойствами растворителя, Ký = M1 R(T10 )2 ,
∆Η1èñï
где М1- молярная масса растворителя, кг/моль; Τ10 - температура кипения чистого растворителя при Р = 1 атм, К; ∆H1èñï - молярная теплота испарения растворителя, Дж/моль.
Таким образом, величина ∆T не зависит от природы растворенного вещества, а лишь от его концентрации и природы растворителя. (Это относится к растворам неэлектролитов; в случае электролитных растворов за счет диссоциации число частиц растворенного вещества увеличивается, ∆Р и ∆T увеличиваются).
1.4.2 Понижение температуры замерзания раствора
При кристаллизации чистого растворителя в равновесии находятся три фазы:
Твердыйрастворитель  Жидкийрастворитель
Жидкийрастворитель
Пар
При кристаллизации растворителя из раствора:
Твердыйрастворитель |
|
|
|
Жидкийраствор |
|
|
|||
|
|
|
Пар
Условием равновесия фаз является равенство химических потенциалов вещества в различных фазах:
µ10 (тв) = µ10 (ж) = µ10 (газ) ;
µ10 (тв) = µ1р−р (ж) = µ10 (газ) .
При этом в первом случае давление пара над чистым твердым и чистым жидким растворителем будет одним и тем же, Р10 (ж) = Р10 (тв) (точка 0,
9
рисунок 1.3). Это равенство наступает при температуре Т0зам. Во втором же случае равенство давлений и равновесие двух фаз достигается при более низкой температуре, чем температура замерзания чистого растворителя ( Τ1зам и Т2зам рисунок 1.3). Это понижение зависит от концентрации раствора:
∆Ò = Òîçàì −Òçàì = Ê ê b,
где b - моляльность растворенного вещества; Кк - криоскопическая постоянная, равная понижению температуры замерзания растворителя при кристаллизации его из одномоляльного раствора неэлектролита:
Kê = |
M |
R(T |
0 )2 |
, |
1 |
1 |
|||
∆H1ïë |
|
|||
|
|
|
||
где М1, Т10 и ∆Н1пл соответственно молярная масса, кг/моль; температура, К;
молярная теплота плавления растворителя, Дж/моль. Значения Кэ и Кк - табличные данные.
В случае растворов электролитов число растворенных частиц увеличивается за счет диссоциации, давление пара понижается, понижается и
температура замерзания, то есть ∆Тнэзам < ∆Тэлзам .
1.5 Осмотическое давление
Поясним понятие осмоса в растворах (рисунок 1.4). Поместим в сосуд (А) чистый растворитель. Трубка (В) заканчивается расширением. Широкий конец этой трубки закрывается полупроницаемой перегородкой (С). В трубку (В) наливается раствор до уровня жидкости в сосуде (А). Через полупроницаемую перегородку растворитель из сосуда (А) переходит в раствор в сосуде (В).
Самопроизвольный переход растворителя через полупроницаемую перегородку в раствор называется осмосом.
Частицы растворенного вещества через полупроницаемую перегородку перейти при этом не могут. Объем раствора в трубке (В) увеличивается. Через некоторое время подъем уровня раствора прекратится. Этому состоянию отвечает равенство двух противоположных сил: силе осмотического давления, способствующей всасыванию растворителя в раствор, и гидростатического давления столба жидкости (h), препятствующего осмосу.
10
