
stennikova2
.pdf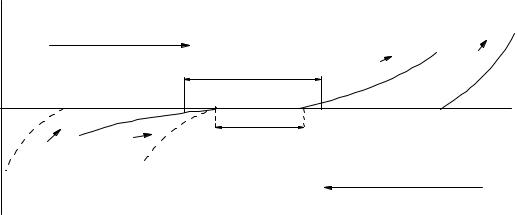
ia |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
поляризация анода |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
8 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S 2 |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
e |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
e |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
- |
- |
|
|
|
|
|
|
|
|
|
|
|
|
U |
|
4 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
H |
- |
|
|
|
|
2 |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
4 |
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
H+ |
|
|
|
|
|
S |
|
|
|
|
|||
|
|
K |
|
|
|
|
|
|
OH |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
К |
|
|
H |
|
H |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
+ϕ |
|
|
|
2e |
|
E =ϕ -ϕ |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
e |
H + |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
H2 |
O2 |
|
|
|
|
|
|
|
|
|
|
|
|||
+ |
+ |
2 |
|
|
|
e |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
К |
|
|
|
|
+ |
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
поляризация катода |
|
|
|
|
||||||
iк |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рисунок 2.10 - Схематические поляризационные кривые реакций |
|||||||||||||||||||||
электролиза водного раствора К2SО4 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Из рисунка 2.10 видно, что наименьшего отрицательного потенциала на катоде требует восстановление водорода: 2 Н+ + 2e → H2.
Восстановление ионов калия возможно при столь высоком отрицательном потенциале, что он практически недостижим в водном растворе.
Наименьшего положительного потенциала требует окисление ионов ОН- с образованием кислорода
4ОН- - 4e → O2 + 2H2O.
Окисление же аниона SО42-
2 SО42- - 2e → S2О82-,
при котором образуется анион надсерной кислоты, требует значительно большего сдвига потенциала и в обычных условиях электролиза не наблюдается.
Таким образом, при электролизе водного раствора К2SО4 на электродах выделяется водород и кислород, то есть происходит разложение воды.
Раствор в прикатодном пространстве называется католитом, в прианодном – анолитом.
Из прикатодного пространства исчезают ионы Н+ за счет восстановления и уходят к аноду ионы SО42-, таким образом в католите накапливаются ионы К+ и ОН-, то есть щелочь КОН.
Из прианодного пространства исчезают за счет окисления ионы ОН-, в анолите накапливаются Н+ и SО42-, то есть Н2SО4.
Если в электролизере установить пористые диафрагмы, отделяющие католит и анолит от средней части объема раствора, то можем получить эти вещества. При отсутствии диафрагмы они перемешиваются с образованием соли.
61
Обратимся к рисунку 2.10. Если внешняя ЭДС равна разности потенциалов равновесных электродов Е =ϕH 2 −ϕO2 , то на электродах не
смогут протекать реакции с образованием Н2 и О2. Для этого нужно чтобы ЭДС стала несколько больше разности ϕH 2 −ϕO2 , то есть U (рисунок 2.10).
Величина U называется напряжением разложения. На рисунке даны две кривые для восстановления Н+: сплошная – с большим перенапряжением реакции, пунктирная – с малым перенапряжением. Это зависит от выбора материала катода. Как уже было отмечено выше, на Pt реакция восстановления Н+ идет с малым перенапряжением, на других анодах – с большим.
2.4.3.3 Законы Фарадея
Фарадеем установлены количественные законы электролиза.
Первый закон: «количество прореагировавшего при электролизе
вещества пропорционально количеству прошедшего через раствор электричества»:
m = KQ ,
где m – масса вещества; Q - количество электричества; К – электрохимический эквивалент.
Q = J t = i S t , |
K = |
M |
. |
|
|||
|
|
nF |
|
где i- плотность тока; S – площадь; t – время, с; М – молярная масса; F – число Фарадея, 96485 Кл; n – число электронов участвующих в электродной реакции.
Тогда первый закон Фарадея примет вид:
m = |
M |
i S t . |
(2.17) |
|
nF |
||||
|
|
|
Следует иметь в виду, что масса вещества, рассчитанная по уравнению (2.17) является теоретической. На практике эта величина бывает больше или меньше рассчитанной, то есть mфакт. (масса фактическая). В связи с этим
вводится понятие – выход по току, анодный или катодный, Ва или |
Вк . |
||||
|
môàêò |
|
Ιòåîð |
Т |
Т |
ÂÒ = |
= |
. |
|
||
mòåîð |
|
|
|||
|
|
Ιôàêò |
|
||
При умножении на 100 выход по току будет представлен в процентах, %. Электрохимический эквивалент для сплавов рассчитывается по
формуле:
Ê ñï = Ê1W1 + K2W2 + K3W3 +.... ,
где К1, К2 - электрохимические эквиваленты компонентов сплава; W1, W2, …- массовые доли компонентов сплава.
62

Второй закон: «при определенном количестве прошедшего
электричества отношение масс прореагировавших веществ равно отношению их химических эквивалентов, Э»:
m1 |
= |
m2 |
= ........ = const èëè m1 : m2 ... = Ý1 : Ý 2 ... , |
|
Ý1 |
|
|||
Ý 2 |
|
М . |
||
|
|
|
Э = |
|
|
|
|
|
n |
2.5 Примеры решения задач
При решении задач мы используем справочные значения констант диссоциации, Кдисс; произведения растворимости солей, ПР; водородный показатель, рН; ионное произведение воды, Кw.
При расчете этих величин были взяты концентрации, единицей измерения которых является моль/л, а не моль/м3 (не в системе СИ). Поэтому концентрации, полученные из этих значений, следует, если это необходимо, перевести в систему СИ.
Задача 1
Константа диссоциации уксусной кислоты равна 1,8·10-5. Чему равен рН раствора, если к 1 л раствора кислоты (С = 1 моль/л) добавить 8,2·10-3 кг ацетата натрия? Считать, что объем раствора не изменится при добавлении соли.
Дано:
Кд = 1,8·10-5
Vраствора= 1 л Скислоты = 1 моль/л
mсоли =8,2·10-3 кг рН - ?
Решение
В системе имеется кислота, которая диссоциирует частично, и соль, которая диссоциирует нацело.
С |
|
|
|
|
СН3СООН |
|
|
|
СН3СОО- + Н+ |
||
|
|
|
|
||||||||
|
|
|
|
|
|||||||
до реакции |
1 |
0 |
0 |
||||||||
С |
при равновесии |
1-х |
|
|
|
х |
х |
||||
С |
|
|
|
|
СН3СООNa |
|
|
|
СН3СОО- + Na+ |
||
|
|
|
|
|
|||||||
|
|
|
|
|
|||||||
до реакции |
0,10 |
0 |
0 |
||||||||
С |
после диссоциации |
0 |
0,10 |
0,10 |
|||||||
nñîëè = |
m |
= |
8,2 |
= 0,10 моль |
|
|
|
|
|
|
|
M |
|
|
|
|
|
|
|
||||
|
|
82 |
|
|
|
|
|
|
|
||
63

В условии дана константа диссоциации термодинамическая, то есть Ка. Без большой погрешности можно считать а = с и Ка = Кс.
Кдисс = [СН3СОО− ][Н+ ]
С[СН3СООН]
Ацетат ион, СН3СОО-, образуется за счет диссоциации как кислоты так и соли, то есть [СН3СОО− ]= (х+0,10),
Кдисс. = (х+10−,10х ) х .
Поскольку электролит является слабым, то количество продиссоциированного электролита, х, мало, и в алгебраических суммах им с небольшой погрешностью можно пренебречь. Тогда:
Кдисс. = 0,101 х =1,8 10−5
х =1,8 10−4 мольл =[H +]
pH = −lg[H +] = −lg1,8 10−4 = 3,74
Задача 2
Предельная электрическая проводимость водного раствора NH4Cl равна
130·10-4 |
Ñì |
ì 2 |
. Подвижности ионов ОН- и Cl- соответственно равны 174·10-4 |
|
|
|
|||
|
ìîëü |
|
||
и 65,4·10-4 |
См м2 |
. Вычислить предельную электрическую проводимость |
||
|
|
моль |
|
|
NH4ОН и число переноса иона NH4+ в растворе NH4Cl при бесконечном разведении.
Дано:
∞ |
|
|
|
|
|
−4 Cм м2 |
|||
λNH 4 |
Сl =130 10 |
|
|
|
|
||||
|
|
моль |
|||||||
|
|
|
|
|
|
|
|
||
∞ |
|
|
|
|
−4 См м2 |
||||
λ |
|
− = |
174 10 |
|
|
|
|
|
|
|
|
|
моль |
||||||
ОН |
|
|
|
|
|
||||
∞ |
|
|
|
|
−4 См м2 |
||||
λ |
− |
= 65,4 10 |
|
|
|
|
|
||
|
|
моль |
|||||||
Cl |
|
|
|
|
|
|
|||
λ∞NH 4OH - ? |
|
|
|
|
|
||||
tNH4+ |
- ? |
|
|
|
|
|
|
||
Решение:
Согласно закону Кольрауша: λ∞NH4OH
= λ∞ + + λ∞ − .
NH4 OH
Для нахождения λ∞ + запишем закон Кольрауша для NH4Cl:
NH4
64
λ∞NH |
4 |
Cl |
= λ∞ + + λ∞ − . |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
NH4 |
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
||
Откуда λ∞ + |
|
= λ∞ |
|
− λ∞ |
− =130 10−4 − 65,4 10−4 = 65 10−4 |
Ñì ì 2 |
. |
|||||||||||||
|
|
|||||||||||||||||||
|
|
|
|
|
|
NH4 |
|
|
NH4Ñl |
|
|
Cl |
|
|
|
|
ìîëü |
|||
Таким образом, |
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
−4 Ñì ì 2 |
|||||||||||||||
λ |
∞ |
|
|
|
= 65 10 |
−4 |
+174 |
|
10 |
−4 |
= 239 10 |
|||||||||
NH4OH |
|
|
|
|
|
ìîëü |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
λ∞NH4+ |
|
|
|
|
|
|
|
|
|
|
||||
t |
|
+ = |
|
= |
|
65 10−4 |
|
= 0,50 . |
|
|
|
|
|
|||||||
|
|
|
130 10−4 |
|
|
|
|
|
||||||||||||
|
NH 4 |
|
|
|
λ∞NH 4Cl |
|
|
|
|
|
|
|
|
|||||||
Задача 3
Определить теплоту диссоциации уксусной кислоты, если удельное сопротивление раствора кислоты (С = 0,01 моль/л) при 298 К равно 61,0 Ом·м, а при 288 К равно 83,7 Ом·м.
Дано:
λ∞ + (298 Ê) = 350 10−4 |
Ñì |
ì 2 |
|||||
|
Í |
|
|
|
|
ìîëü |
|
|
|
|
|
|
|
||
λ∞ |
|
− (298 Ê) = 41 10−4 |
Ñì ì 2 |
||||
|
ÑÍ 3ÑÎÎ |
|
|
|
|
ìîëü |
|
|
|
|
|
|
|
|
|
λ∞ + (288 Ê) = 300 10−4 |
Ñì |
ì 2 |
|||||
|
Í |
|
|
|
|
ìîëü |
|
|
|
|
|
|
|
||
λ |
∞ |
|
− (288 Ê) = 31 10 |
−4 |
Ñì ì 2 |
||
ÑÍ 3ÑÎÎ |
|
ìîëü |
|||||
|
|
|
|
|
|||
ρ298 |
= 61,0 Îì |
ì |
|
|
|||
|
|
|
|||||
ρ288 |
= 83,7 Îì |
ì |
|
|
|
||
Ñ = 0,01ìîëü/ë |
= 0,01 103 ìîëü/ì 3 |
||||||
∆Í äèññ. - ?
Решение:
Теплота реакции диссоциации кислоты определяется из уравнения изобары Вант Гоффа в интегральном виде:
|
К2 |
|
|
|
1 |
|
1 |
|
|
|
|
Т1 −Т2 |
|
ln |
= − |
∆Ндисс. |
− |
|
= − |
∆Ндисс. |
|
||||||
К1 |
R |
|
Т2 |
|
|
R |
|
Т1 Т2 |
|
||||
|
|
|
|
Т1 |
|
|
|
||||||
Для решения надо рассчитать константы диссоциации при двух температурах, используя уравнения:
К = |
α2С |
; |
α = |
λ |
; |
|
|||
1 |
−α |
∞ |
|
||||||
|
|
|
|
λ |
|
|
|||
λ = |
χ |
; χ = |
1 |
λ = |
1 |
||||
С |
ρ |
ρ С |
|||||||
|
|
|
|
|
|
||||
65

λ |
298 |
= |
|
|
|
|
1 |
|
|
|
|
=16,4 10 |
−4 См м2 |
||||||
61,0 0,01 103 |
|
моль |
|||||||||||||||||
|
|
|
|
|
|
|
|||||||||||||
α298 |
= |
|
|
|
16,4 10−4 |
|
|
= 0,042 |
|
|
|||||||||
|
350 10−4 + 41 10−4 |
|
|
||||||||||||||||
К298 |
= |
|
|
(0,042)2 0,01 |
=1,83 10−5 |
|
|
||||||||||||
|
|
|
1−0,042 |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Аналогично рассчитываем для 288 К: |
|||||||||||||||||||
λ288 |
= |
|
|
|
|
1 |
|
|
|
|
|
=11,9 10−4 |
Ñì ì 2 |
|
|||||
|
83,7 0,01 103 |
|
ìîëü |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
α288 |
= |
|
|
|
|
11,9 10−4 |
|
|
= 0,036 |
|
|||||||||
|
|
300 10−4 |
+ 31 10−4 |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
Ê 288 |
= |
(0,036)2 0,01 |
|
=1,33 10−5 |
|
|
|||||||||||||
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
1− 0,036 |
|
|
|
|
|
|
|
|
|
|
||
ln |
1,83 10−5 |
= − |
∆Н |
|
|
|
|
288 −298 |
|
||||||||||
1,33 |
10−5 |
|
дисс. |
|
|
∆Ндисс. = 22,8 кДж/моль |
|||||||||||||
|
|
|
8,31 |
288 298 |
|
||||||||||||||
Задача 4
Вычислить ЭДС элемента, составленного из хлорсеребряного электрода в растворе НСl (С = 0,01 моль/л) и водородного электрода в растворе НСl (С = 0,50 моль/л), с учетом диффузионного потенциала при 25 0С.
Дано:
Ñ1 (ÍÑl ) = 0,01ìîëü/ë Ñ2 (ÍÑl ) = 0,50 моль/л Из справочник а :
γ±1 (ÍÑl ) = 0,904
γ±2 (ÍÑl ) = 0,758
λ∞ |
+ |
= 349,8 |
10−4 |
Ñì ì 2 |
||
Í |
|
|
|
ìîëü |
||
|
|
|
|
|||
λ∞ |
− |
= 76,4 |
10−4 |
Ñì ì 2 |
|
|
ìîëü |
||||||
Ñl |
|
|
|
|||
Ò = 298 Ê |
|
|||||
|
|
|
||||
F = 96485 Êë/ìîëü
ϕÍ0 + Í 2 = 0
ϕCl − AgCl, Ag = 0,222 Â
Å- ?
Решение:
Составляем гальваническую цепь из газового электрода, и электрода второго рода. Определяем знаки электродов из сравнения значений ϕ0 . Записываем реакции на электродах согласно их знакам:
66

(-) Pt, H2 | HCl 

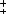 HCl | AgCl, AgCl (+)
HCl | AgCl, AgCl (+)
ϕ0 = 0 |
|
|
|
|
|
|
ϕ0 = 0,222 В |
||||
С2 =0,50 С1=0,01 |
|
|
|
|
|
||||||
Н2 – 2е → 2Н+ |
|
|
2AgCl + 2e → 2Ag+ + 2Cl- |
||||||||
ϕ− =ϕ0 + |
|
RT |
ln a |
2 |
+ =ϕ0 |
+ |
|
RT |
|
ln a± = 0,0257 ln 0,38 = −0,025 B |
|
|
|
|
|||||||||
|
|
2F |
H |
|
|
|
F |
||||
a± (HCl) = γ± C2 = 0,757 0,50 = 0,38 |
|||||||||||
ϕ+ =ϕ0 − |
|
RT |
|
ln a |
Cl |
− =ϕ0 |
− |
RT |
ln a± = 0,222 − 0,0257 ln 0,009 = 0,343 B |
||
|
|
|
|||||||||
|
|
F |
|
|
|
F |
|||||
a± (HCl) = γ± C1 = 0,904 0,01 = 0,009
E =ϕ+ −ϕ− = 0,343 − (−0,025) = 0.368 B
Это значение ЭДС без учета диффузионного потенциала.
В данном случае φдифф возникает на границе двух растворов электролитов одинаковых по химической природе, но с различными концентрациями.
|
ϕ |
дифф |
|
= |
|
t |
+ |
−t |
− |
|
|
RT |
ln |
a1 |
= |
|
0,821−0,179 |
|
0,0257ln |
0,38 |
= 0,054 B |
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
F a |
|
|
|
|
|
0,009 |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|||||
Полученная величина - значение φдифф по модулю.
Для определения знака φдифф рассмотрим направление электрического поля на границе растворов (см. гальваническую цепь). Поскольку С2 > С1, диффузия HCl будет идти слева направо, при этом ионы Н+, имеющие большую подвижность, λ∞Í + , будут опережать ионы Сl-, образуя двойной
электрический слой (ДЭС) на границе растворов с положительной правой обкладкой (см. цепь) и отрицательной левой. Таким образом, направление поля ДЭС и направление поля электродов совпадает и φдифф > 0.
Е =ϕ+ −ϕ− +ϕдифф. = 0,368 +0,054 = 0,422 В
Задача 5
Рассчитать диффузионный потенциал гальванической цепи и определить его знак.
(-) Hg, Hg2Cl2 | KCl 

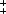 CuSO4 | Cu (+)
CuSO4 | Cu (+)
если СКСl = 0,01, CCuSO4 = 0,01 моль/л.
Справочные данные:
∞ |
|
|
= 73,5 10 |
−4 |
См м2 |
||||
λК+ |
|
|
моль |
||||||
|
|
|
|
|
|
|
|
||
∞ |
|
|
= 76,4 10 |
−4 |
Cм м2 |
||||
λ |
|
− |
|
|
моль |
||||
Сl |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
∞ |
|
|
|
= 56,6 10 |
−4 |
Cм м2 |
|||
λ1 |
Сu |
2+ |
|
моль |
|||||
|
2 |
|
|
|
|
|
|||
∞ |
|
|
|
= 80,0 10 |
−4 |
Cм м2 |
|||
λ1 |
|
|
2− |
|
моль |
||||
|
|
SO4 |
|
|
|
|
|||
|
2 |
|
|
|
|
||||
67

Решение:
Поскольку граничащие растворы различаются по химической природе, а их концентрации одинаковы, то расчет φдифф производится по формуле:
ϕдифф. = |
RT |
ln |
λ+I |
+ λ− |
= 0,0257 ln |
73,5 +80,0 |
= 0,004 B |
|
F |
λ−I |
+ λ+ |
76,4 + 56,6 |
|||||
|
|
|
|
Определим знак φдифф.
Так как концентрация обоих электролитов одинакова, то диффузия ионов будет происходить и слева направо и справа налево. Движение К+ и Сu2+ происходит в противоположных направлениях, но у К+ подвижность
больше на ∆λ+ =16,9 10−4 и с правой |
стороны границы накапливается |
|
положительный заряд. При движении Сl- |
и SO42- ∆λ− = 3,6 10−4 , то есть за счет |
|
большей подвижности SO42-, слева накапливается отрицательный заряд, но |
||
∆λ+ > ∆λ− , что дает в итоге положительный потенциал справа, |
. |
|
Направление полей ДЭС и электродов совпадает, ϕдифф. > 0.
Задача 6
При электролизе раствора, содержащего Pb2+, через 70 минут на поверхности 1,2 дм2 получено покрытие толщиной 108 мкм при плотности тока 3,0 А/дм2. При этом выделилось некоторое количество водорода. Рассчитать выход по току для свинца и объем выделившегося водорода при н.у., ρPb =11,34 дмкг3 .
Дано:
t = 70 мин = 4200 с S = 1,2 дм2
h= 108 мкм = 108·10-5 дм
i= 3,0 А/дм2
ρPb = 11,34 кг/дм3
ВТ (Pb)-? VH2 - ?
Решение
В= mфакт.
Тmтеор.
По первому закону Фарадея:
mòåîðPb |
. = |
M i S t |
= |
207 3,0 1,2 70 60 |
=16,2 ã |
|
|
|
|
n F |
|
2 96485 |
|
mфактPb |
. = ρ V = ρ S h =11,34 1,2 108 10−5 =14,7 10−3 кг =14,7 г |
|||||
Фактическая масса свинца меньше теоретической за счет того, что часть количества электричества расходуется на восстановление водорода. Недополученное количество свинца равно 16,2 – 14,7 = 1,5 г. Вместо него
68

выделился водород, масса которого может быть рассчитана по второму
закону Фарадея: mPb = mH2 ;
ЭPb ЭН2
m |
H2 |
= |
mPb ЭН2 |
= |
1,5 1 |
= 0,014 г |
|
ЭPb |
207 / 2 |
||||||
|
|
|
|
||||
|
|
|
|
|
Объем водорода при нормальных условиях (Р = 1 атм., Т = 273 К) определяется по уравнению идеального газового состояния:
РV = |
|
m |
RT V = mRT |
= |
0,014 8,314 273 |
=157 10−6 |
м3 |
=157 см3 |
||
|
|
2 1,013 105 |
||||||||
|
|
M |
|
MP |
|
|
|
|
||
B = |
mфакт. |
100% = |
14,7 |
100% = 90,7% |
|
|
|
|||
|
|
|
|
|
|
|
||||
Т |
mтеор. |
|
16,2 |
|
|
|
|
|
||
|
|
|
|
|
|
|
||||
Задача 7
В цианистую ванну исправления брака завешены бракованные омедненные стальные детали с общей поверхностью 522 дм2 и средней толщиной медного покрытия 17 мкм.
Сколько времени необходимо для полного снятия медного слоя с деталей, если плотность тока 0,96 А/дм2, выход по току 95 %? Плотность меди 8,9 г/см3.
Дано:
S = 522 дм2
h = 17 мкм = 17·10-5 дм i = 0,96 А/дм2
ρ(Cu) = 8,9 г/см3= 8,9·103 г/дм3 ВТа=0,95
t - ?
Решение
Медь в цианистом растворе одновалентна, Сu+, n = 1. Запишем развернутое уравнение Фарадея:
m = |
M |
i S t , откуда t = |
m n F |
, |
|
n F |
M i S |
||||
|
|
|
где m – теоретическая масса меди, которая может быть найдена через
выход по току: mфакт .
ВТ
Подсчитаем массу фактически осажденной меди.
m |
|
= ρ V ; V = h S =17 105 522 = 8,87 10−2 |
дм3 |
|
факт |
|
|
|
|
m |
|
= 8,9 103 8,87 10−2 = 997 г |
|
|
факт |
|
|
|
|
t = |
997 1 95487 |
= 2990 с = 50 мин |
|
|
63,5 0,96 522 |
|
|||
|
|
|
||
69
Задача 8
Определить выход по току для щелочи, если при работе хлорного электролизера нагрузкой 22 кА за 24 часа получено 5450 л электролитической щелочи, содержащей 138 г/л NaOH.
Дано:
I = 22 кА = 22·103 А t = 24 час = 86,4·103 с
Vр-ра = 5450 л СNaOH = 138 г/л
ВТNaOH −?
Решение
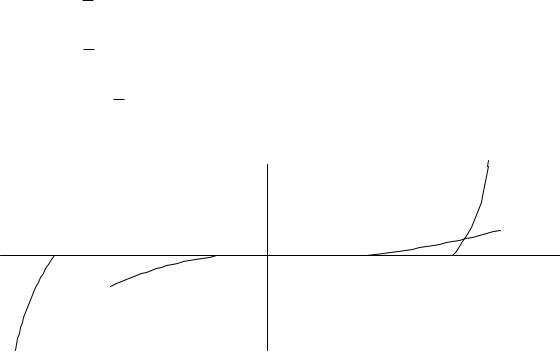
В хлорном электролизере электролизу подвергается водный раствор NaCl. Изобразим схематично поляризационные кривые всех возможных процессов окисления и восстановления в процессе электролиза:
Na+ + e → Na0 H + + e → 12 H2 Cl − − e → 12 Cl2
2OH − − 2e → 12 O2 + H2O
|
|
|
ia |
|
Cl- |
Na+ |
Na+ |
H+ |
0 |
OH- |
|
-2,71 B |
|
-0,41 B |
|
0,82 B |
1,36 B |
iк
Из рисунка видно, что повышение катодного потенциала приводит к единственно возможной катодной реакции – восстановлению водорода.
На аноде первым достигается потенциал разряда ОН-, но из-за малой скорости реакции (большого перенапряжения) кислород не образуется, и возможно дальнейшее увеличение потенциала анода и достижение потенциала разряда Cl- с образованием хлора.
Таким образом, продуктами электролиза будут Н2 и Cl2.
70
