
stennikova2
.pdf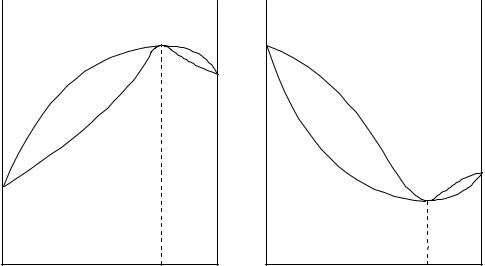
следовательно, до точек С (Сl) пар обогащен компонентом В, а после этих точек - компонентом А.
Для систем с экстремумами на кривых Р =f(Х1ж) установлен второй закон Д. П. Коновалова:
«Экстремумы на кривых общего давления пара или температуры отвечают такому равновесию раствора и насыщенного пара, при котором составы обеих фаз одинаковы».
По второму закону Коновалова кривая пара и кривая жидкости, имеющие экстремумы, должны касаться в точке экстремума (рисунок 1.10).
|
а) |
|
Т |
Р |
T=const |
C |
|
|
жидкость |
ТА0 |
|
|
|
|
Р0 |
|
|
|
В |
Р0 |
|
пар |
|
А |
|
|
|
|
А |
C' |
В |
|
б) |
|
|
P=const |
|
|
пар |
|
|
C |
Т0 |
|
В |
|
|
жидкость |
|
А |
C' |
В |
Рисунок 1.10 - Диаграммы «Общее давление – состав» и «Температура кипения – состав» для систем с экстремумом
На рисунке 1.10 изображены диаграммы в разных координатах: а) давление от состава и б) температура от состава для одной и той же системы. Следует обратить внимание на то, что давление насыщенного пара и температура кипения находятся в обратной зависимости, то есть, чем более летуч компонент (чем выше его давление насыщенного пара), тем ниже его температура кипения. И наоборот, чем менее летуч компонент (чем меньше его давление насыщенного пара), тем выше его температура кипения, что и отражено на рисунке 1.10. И, как следствие, диаграмма с максимумом на кривой Р = f (X ) (положительное отклонение от закона Рауля)
преображается в диаграмму с минимумом на кривой Tкип = f (X ).
Смеси, у которых составы жидкости и равновесного с ней пара совпадают, называются азеотропными. Они кипят при постоянной температуре. Соотношение между составом пара и составом жидкости часто
изображается в координатах X iïàð = f (Õiæ ) . Диагональ квадрата отвечает равному составу жидкости и пара. Но даже для идеальных систем составы
21
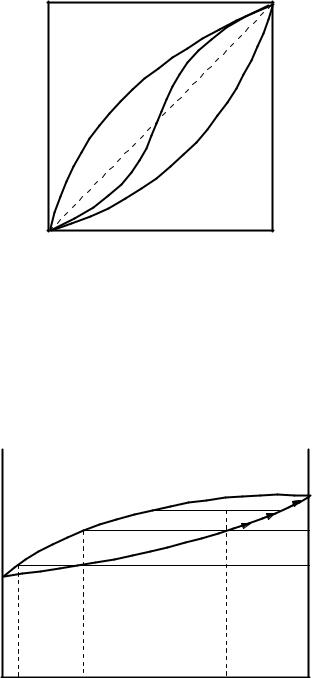
жидкости и пара различны. Если добавление В к раствору повышает общее давление, то В в паре будет больше, кривая 1 (рисунок 1.11) пойдет выше диагонали. Если же пар содержит меньше В, чем жидкость, то кривая 2 пойдет ниже. Системы с азеотропом изображаются S-образной кривой, пересекающей диагональ в точке, отвечающей азеотропу (кривая 3).
В |
|
1 |
хпар |
|
|
|
|
|
В |
|
|
|
3 |
|
|
|
2 |
А |
хВж |
В |
Рисунок 1.11 – Соотношение между составом жидкости и пара
1.8.1.2 Разделение бинарных смесей путем перегонки
Различие в составе жидкой смеси и ее насыщенного пара позволяет разделить эти смеси перегонкой. Рассмотрим принципиальную схему разделения смеси состава «а» (рисунок 1.12).
Т |
|
|
|
ТВ0 |
|
пар |
y |
n |
|
|
|
|
x |
Т |
|
|
|
m |
1 |
0 |
|
|
|
Т2 |
ТА |
|
|
|
|
|
|
жидкость |
|
|
А c |
b |
|
a |
В |
Рисунок 1.12 – Зависимость состава жидкости и пара от температуры
Смесь закипает при температуре Т1 и дает насыщенный пар состава b, обогащенный по сравнению с исходной жидкостью компонентом А. Если
22
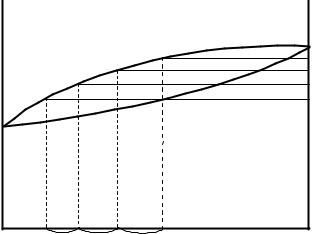
сконденсировать полученный насыщенный пар, то получим жидкость состава b. Эта жидкость кипит при температуре Т2 и дает насыщенный пар состава с, еще более обогащенный компонентом А. Повторяя эти операции, можно получить компоненты смеси в индивидуальном состоянии, из паровой фазы компонент А, а компонент В из исходной смеси, состав которой при кипении обогащается менее летучим компонентом, достигая в конце концов состава В (линия m ΤB0 ).
В технике различают несколько типов перегонки: перегонка в равновесии, простая перегонка, фракционная перегонка и ректификационная. Перегонка в равновесии характеризуется тем, что весь пар находится в равновесии с жидкостью. Если обратиться к рис. 1.12, то в точке т при Т1, (начало кипения), пара состава b очень мало. Поэтому нагревают систему до более высокой температуры, например, до точки п. Здесь в равновесии находятся пар у и жидкость х. Количество пара определяется отрезком пх, количество жидкости пу. Полученный пар отделяют от жидкости и конденсируют. Очевидно, что этот метод не дает полного разделения смесей, а лишь обогащает конденсат одним из компонентов.
При простой перегонке образующийся пар непрерывно удаляется и конденсируется. Состав исходной жидкости в перегонном кубе при этом непрерывно меняется. Если получаемый пар конденсировать в определенных интервалах температур, то получатся простая фракционная перегонка
(рисунок 1.13).
Т |
|
|
|
|
|
|
|
|
|
c' |
|
d' |
Т4 |
|
b' |
|
|
|
||
|
|
|
|
|
Т |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
Т2 |
|
|
a' |
|
|
|
|
|
|
|
|
|
|
Т1 |
|
|
|
|
|
|
|
|
А |
a 1 b |
2 |
c |
3 |
d |
В |
Рисунок1.13 – Схема фракционной перегонки
Так, если при перегонке раствора «d» отводить пар в интервале температур кипения от Т1 до Т2, то получим первую фракцию конденсата, состав которой является усредненным по отношению к предельным значениям а и b. При конденсации пара в других интервалах температур получают фракции другого состава: от Т2 до Т3 фракцию 2 (b - с), от Т3 до Т4 фракцию 3 (с - d).
23
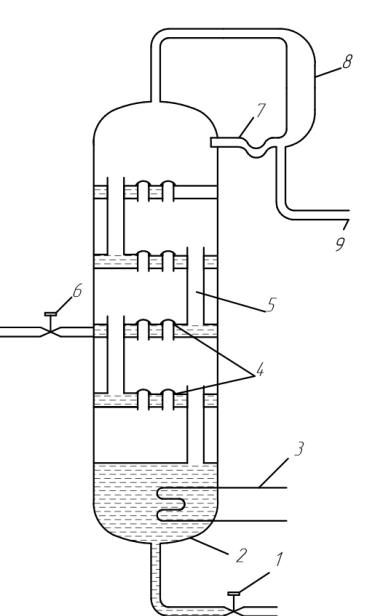
Наиболее совершенным процессом разделения является ректификация, объединяющая последовательный ряд перегонок в равновесии в один автоматизированный процесс. Аппарат состоит из куба с исходной смесью и колонки с рядом "тарелок" (рисунок 1.14).
1 – спускной кран; 2 – котел; 3 – нагреватель; 4 – трубки для поднимающегося пара; 5 – переливы для стекающей жидкости; 6 – кран питания колонны; 7 – подача флегмы; 8 – конденсатор; 9 – спуск конденсата.
Рисунок 1.14 – Cхема ректификационной установки
Жидкость состава «а» (рисунок 1.15) закипает при Т1 и образующийся пар 1 с бóльшим содержанием компонента А по сравнению с исходной жидкостью, поднимается на нижнюю тарелку, где находится конденсат, содержащий несколько больше летучего компонента, чем исходная смесь (так называемая флегма).
24
Т
|
|
пар |
Т0 |
|
|
|
|
|
|
|
B |
|
2 |
1 ∆Т |
Т1 |
4 |
3 |
|
2' |
|
|
|
|
5 |
|
|
|
0 |
|
|
|
ТA |
|
жидкость |
|
|
|
|
А |
a |
В |
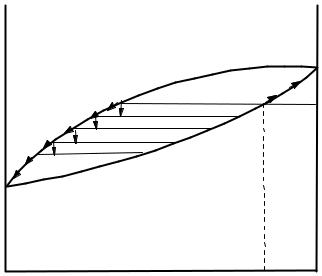
Рисунок 1.15 - Изменение состава пара и кубовой жидкости при ректификации
Пар, барботируя через флегму, заставляет ее кипеть, а сам частично охлаждается на ∆T. При этом он частично конденсируется в жидкость 2l, а новый пар 2 поднимается на следующую тарелку, где процесс повторяется. По мере поднятия пара в колонке он все более и более обогащается летучим компонентом А (пар 3, 4, 5 …), и на выходе из колонки получается чистый компонент А, если число тарелок достаточно велико. Жидкость на тарелках при их переполнении стекает вниз, и кубовая жидкость обогащается компонентом В (менее летучим), ее температура кипения постепенно повышается от Т1 до TB0 , а состав изменяется от а до В.
При ректификации растворов с азеотропами в чистом виде может быть получен только один из компонентов и азеотроп, который ведет себя как чистая жидкость, высокоили низкокипящая.
25
Т |
|
|
|
|
Т0 |
|
|
а) |
|
А |
|
пар |
|
|
|
|
|
|
|
|
|
1 2 |
|
|
|
|
34 |
|
|
|
|
|
2 1 |
ТВ0 |
|
|
жидкость |
С |
|
|
|
|
|
|
А |
а |
|
С' |
b В |
Т |
пар |
б) |
|
С |
|
2 |
1 |
|
3 |
|
|
Т0 |
|
1 |
А |
|
|
|
|
2 |
|
|
3 |
жидкость |
|
|
|
|
Т0 |
|
|
В |
А |
С' |
В |
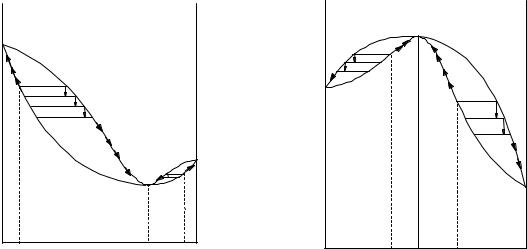
Рисунок1.16 – Разделениеазеотропных смесей
Так, при перегонке раствора «а», системы, образующей азеотроп с минимумом (рисунок 1.16 а), пар по составу постепенно приближается к азеотропу (1, 2, 3, 4 …С) и, пройдя по всем тарелкам, выходит из колонны (отгоняется) в виде жидкости состава Сl (азеотроп). Кубовая жидкость обогащается менее летучим компонентом (по сравнению с азеотропом – это компонент А). Температура кипения ее повышается и по окончании перегонки в кубебудетчистыйкомпонентА.
При перегонке раствора состава «b» на участке Сl - В более летучим будет азеотроп, менее летучим компонент В. При перегонке пар изменяет состав от точки 1 к С. Отгоняться будет азеотроп. Кубовая жидкость обогащается компонентом В, температура кипения ее повышается. По окончании дистилляциикубовыйостатокбудетсостоятьизчистогокомпонентаВ.
Аналогично можно рассмотреть перегонку систем с максимумом температуры кипения (рисунок 1.16 б). При перегонке растворов состава от А до Сl более летучим будет компонент А и он будет отгоняться, а азеотроп будет оставаться в кубе. На участке Сl – В будет отгоняться компонент В, а в кубовом остаткебудетазеотроп, какболеевысококипящая система.
1.8.2 Равновесие жидкость – пар для практически несмешивающихся жидкостей
В гетерогенных системах, состоящих из нерастворимых друг в друге жидкостей, компоненты испаряются независимо. Поэтому в образующемся насыщенном паре, который находится в равновесии с двухслойной жидкой системой, парциальные давления каждого из компонентов не зависят от соотношения этих компонентов, а будут равны давлению насыщенного пара этих компонентов в чистом виде.
26
P = P0 |
; |
P = P0 . |
Общеедавление Ρ |
= Ρ0 |
+ Ρ0 . |
(1.10) |
A A |
|
B B |
общ |
А |
В |
|
(Сравните с формулой для парциальных и общего давления неограниченно смешивающихся жидкостей (уравнение1.2).
Из уравнения (1.10) видно, что общее давление выше давления пара каждого из компонентов в отдельности.
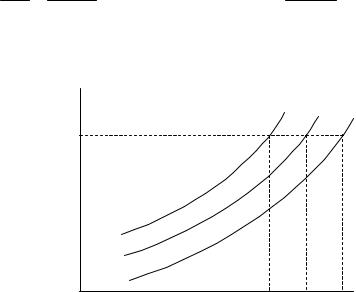
Жидкость закипает при той температуре, при которой давление ее насыщенного пара равно внешнему. Следовательно, давление над такой смесью достигает внешнего при более низкой температуре, чем каждый компонент в отдельности, а значит, температура кипения смеси будет ниже температуры кипения каждой жидкости в отдельности при том же внешнем давлении (рисунок 1.17).
Состав насыщенного пара не зависит от соотношения слоев и может быть рассчитан:
ΧпарА = |
Ρ |
|
= |
|
Ρ0 |
, |
|
ΧпарВ = |
|
Ρ0 |
|
. |
(1.11) |
Ρ |
А |
Ρ0 |
А |
|
Ρ0 |
В |
|
||||||
|
|
|
+Ρ 0 |
|
|
|
+ Ρ0 |
|
|
||||
|
общ |
|
А |
В |
|
|
|
А |
|
В |
|
|
|
|
|
|
|
|
Р |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рвнеш |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
щ |
|
|
|
|
|
|
|
|
|
|
|
|
Р б |
|
|
|
|
|
|
|
|
|
|
|
|
|
о |
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Р |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
А |
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Р |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Т |
Т0 |
Т0 |
Т |
||
|
|
|
|
|
|
|
|
СМ |
|
А |
|
В |
|
Рисунок 1.17 - Определение температуры кипения системы из |
|||||||||||||
несмешивающихся жидкостей |
|
|
|
|
|
|
|
||||||
Рассмотренные особенности гетерогенных жидких систем широко используются на практике. Так, для очистки и выделения многих органических веществ, нерастворимых в воде, их перегоняют с водяным паром. Для этого сосуд с очищаемым веществом нагревают на водяной бане и пропускают водяной пар. Образующаяся гетерогенная смесь кипит при температуре < 100 °С. В дистилляте образуется два слоя: вода и органическое вещество. Перегонку с водяным паром используют для перегонки при более низкой температуре высококипящих веществ и веществ, разлагающихся при температуре их кипения.
27
Используя уравнения (1.11) можно рассчитать, так называемый, |
||||||||||||||||||
расходный коэффициент пара (g), то есть расход водяного пара на единицу |
||||||||||||||||||
массы отгоняемого вещества: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
g = |
mH O |
, |
|
|
nH |
O |
= |
mH |
O / |
M H |
O |
= |
РН0 |
О |
, откуда |
|||
|
2 |
|
|
|
2 |
|
|
2 |
|
2 |
|
2 |
|
|||||
|
mв−ва |
|
|
|
nв−ва |
|
mв−ва / Мв−ва |
|
Рв0−ва |
|
||||||||
g = |
m |
H2O |
= |
M |
H2O |
P0 |
|
|
|
|
|
|
|
|
|
|
|
(1.12) |
|
M |
H2O . |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
mв−ва |
|
в−ва |
Р0 |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
в−ва |
|
|
|
|
|
|
|
|
|
|
|
|
|
Из уравнения (1.12) следует, что расход водяного пара тем меньше, чем |
||||||||||||||||||
больше молярная масса и давление отгоняемого вещества. |
|
|
|
|
|
|||||||||||||
1.8.3 Равновесие жидкость – пар для ограниченно смешивающихся |
||||||||||||||||||
жидкостей |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Для жидкостей, образующих при смешении как области гомогенные, так |
||||||||||||||||||
и гетерогенные (двухслойные), диаграммы равновесия жидкость – пар могут |
||||||||||||||||||
быть построены в разных координатах. |
|
|
|
|
|
|
|
|
|
= f (Х пар) для |
||||||||
Рассмотрим построение диаграммы |
Ðîáù |
= f (Õ æ ) |
и Р |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
общ |
|
|
|
|
случая, когда давления чистых компонентов РА0 и РВ0 , не очень сильно |
||||||||||||||||||
отличаются друг от друга (рисунок 1.18). |
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
Р |
=f(xж) |
|
|
|
|
|
|
|
|
|
|
|
|
|
Р |
|
|
|
общ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
d' |
|
|
С |
|
|
|
|
|
|
|
|
|
|
|
|
||
Р |
|
|
|
K |
|
|
|
|
|
область |
|
|
|
|
||||
1 |
|
|
|
|
|
|
|
|
|
з-на Рауля |
|
|
|
|
||||
область |
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
РВ |
|
|
|
|
|
РВ |
|
|
|
|
|
||
з-на Рауля |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Р0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
А |
|
|
|
|
РА |
|
|
|
|
|
|
|
|
|
|
|
|
|
Р' |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
А |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
область |
|
|
|
|
|
|
|
|
|
|
|
область |
|
|
|
|
||
з-на Генри |
d |
|
|
|
|
|
|
|
|
|
з-на Генри |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
А р-р a |
|
область |
b |
|
р-р |
В |
|
|
|
|
|
|
|||||
|
|
В в А |
|
расслаивания |
|
|
А в В |
|
|
|
|
|
|
|
|
|||
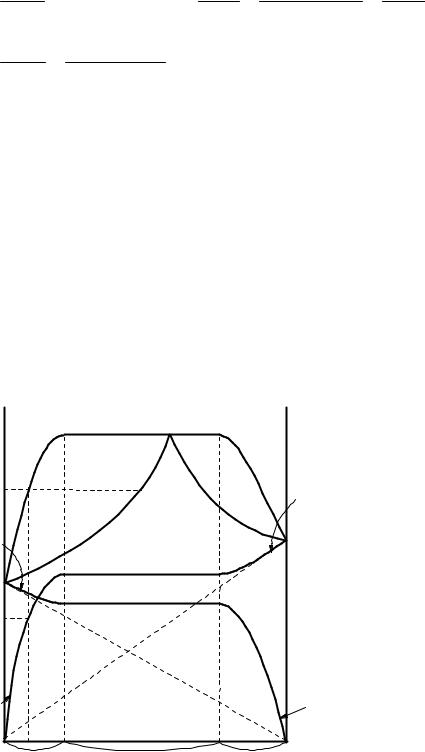
Рисунок 1.18 - Зависимость общего давления от состава жидкой фазы и пара для ограниченно смешивающихся жидкостей
28

Области А-а и В-b на оси состава – это области гомогенных растворов В в А и А в В, соответственно. Точки «а» и «b» - предел растворимости В в А и А в В, соответственно; а - b – область расслаивания, двухфазная область, равновесие двух жидких фаз состава «а» и «b».
Построение начинаем с проведения пунктирных линий, отвечающих идеальной зависимости парциальных давлений от состава. Реальные кривые будут отклоняться от этих кривых, имея положительное отклонение. Так, кривая РАреал в области действия закона Рауля (при ХА → 1) идет по
пунктирной линии, затем отклоняется до области расслаивания. В области расслаивания РА = const . При ХА → 0 область действия закона Генри, линия
идет по прямой, но не по пунктирной. Аналогично строим для РВ.
Далее строим линию общего давления, Робщ = РА + РВ, геометрически
складывая значения давлений при различных составах, начиная с области расслаивания.
Построение линии Робщ = f (Х пар) начинаем с определения состава пара
в области расслаивания. Если два раствора различного состава находятся в равновесии, то химические потенциалы каждого из компонентов в обоих растворах и в паре должны быть одинаковы. Из этого следует, что оба равновесных раствора дают пар одинакового состава:
Хпар = РА . А Робщ
Вданной системе состав пара отвечает точке С – это равновесный пар для любой жидкой системы из области расслаивания а – b.
Аналогично находятся составы пара над гомогенными системами В в А и
Ав В. Так, для раствора d при общем давлении над этим раствором Р1
парциальное давление компонента А отвечает значению РА/ . По уравнению
(1.11) определяется состав пара, равновесный с раствором d, и отмечается на диаграмме точкой «К». Таким образом, получается коннода, соединяющая
точки d´ и К, отвечающие равновесным фазам: жидкости и насыщенному пару. Через полученные точки проводим линии РА0С и РВ0С.
1.9 Закон распределения Нернста. Экстракция
Если взять две несмешивающиеся жидкости и добавить третий компонент, то он будет растворяться в разной степени в том и другом растворителе.
«При установлении равновесия отношение концентраций полученных растворов постоянно при данной температуре» - закон распределения Нернста (1.13).
CI |
= К, |
(1.13) |
|
3 |
|||
CII |
|||
|
|
||
3 |
|
|
|
|
|
29 |

где C3I ,C3II - концентрации третьего компонента в I и II фазах;
К - коэффициент распределения.
Если растворенное вещество диссоциирует или ассоциирует в одном из растворителей, то уравнение Нернста имеет вид:
(CI )n |
(1.14) |
|
CII |
= К. |
|
3 |
|
|
3 |
|
|
Для нахождения К и п логарифмируем уравнение (1.14) и получаем уравнение прямой:
n ln C3I − ln C3II = ln K, ln C3II = n ln C3I −ln K.
Построив прямую в координатах lnC3II = f (lnC3I ) , найдем «п» как тангенс угла наклона прямой (по любым двум точкам, лежащим на прямой)
tga = y2 − y1 .
InK можно найти из уравнения, подставив в него значения любой точки, находящейся на прямой.
Закон распределения Нернста лежит в основе процесса экстракции. Экстракция это извлечение компонента из одной фазы в другую. Экстракция бывает твердофазная - извлечение веществ из твердой фазы в жидкую (например, заваривание чая, кофе, приготовление настоек, экстрактов трав и так далее) и жидкофазная - извлечение растворенного вещества из жидкого раствора экстрагентом. Раствор извлеченного вещества в экстрагенте называется экстрактом, а исходный раствор после извлечения из него вещества называется рафинатом.
Для расчета эффективности жидкофазной экстракции используют уравнение (1.15):
|
V |
n |
|
|
х = |
|
|
, |
(1.15) |
|
||||
Kυ +V |
|
|
||
где х - доля неизвлеченного вещества в рафинате; V - объем исходного раствора;
υ - объем экстрагента; К - коэффициент распределения
C экстр K = Ñ33ðàô ,
п - число экстракций.
Как видно из уравнения (1.15), чем больше экстракций, тем меньше остается вещества в рафинате, то есть неизвлеченным, тем больше вещества извлекается экстрагентом. Эффективность экстракции в большой степени определяется величиной коэффициента распределения: чем больше коэффициент в пользу экстрагента, тем эффективнее экстракция.
Часто в справочнике дается коэффициент распределения как отношение концентраций в рафинате к экстракту, то есть величина, обратная той, что
30
