
stennikova2
.pdf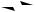
dx1 |
|
|
k1 |
|
|
|
1 |
|
|
|
x2 |
|
|
|
|
|
= |
, |
|
|
x∫k |
dx |
= ∫ k |
dx |
|
, |
|||||
|
|
|
|
|
|
||||||||||
dx2 |
|
k2 |
|
|
0 |
|
2 1 |
0 |
1 |
|
2 |
|
|||
k2 x1 |
=k1 x2 |
èëè |
k1 |
= |
x1 |
. |
|
|
|
|
(3.15) |
||||
k2 |
|
|
|
|
|||||||||||
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
x2 |
|
|
|
|
|
|||
Решая систему уравнений (3.12) и (3.15), находим k1 и k2.
Поскольку взята реакция мономолекулярная, следовательно, количество израсходованного вещества А равно сумме получившихся веществ В и D, то есть х = х1 + х2
3.5.2 Обратимые реакции
Обратимыми (двусторонними) в кинетике называют реакции, которые протекают одновременно, как в прямом, так и в обратном направлении.
В этом смысле почти все химические реакции являются двусторонними. В ходе их протекания исходные вещества образуют продукты, которые, вступая во взаимодействие между собой, образуют снова молекулы исходных веществ. Пока скорости этих процессов неодинаковы, происходят заметные изменения количества реагентов. Если скорости прямого и обратного процессов становятся равными, то наступает динамическое равновесие. В этом случае концентрации реагентов перестают изменяться и подчиняются термодинамическому закону действующих масс. Если же скорость обратной неизмеримо меньше скорости прямой реакции, то такая реакция считается кинетически необратимой. Это может произойти, если продукты быстро удаляются из зоны реакции и не успевают вступать во взаимодействие. Например, при выделении газа или выпадении осадка. Заметим, что обратимые (двусторонние) реакции в кинетике не соответствуют термодинамически обратимому процессу. В первом случае речь идет о направлении процесса, во втором – о способе его проведения.
Рассмотрим наиболее простой тип обратимых реакций с мономолекулярными стадиями. Задача состоит в определении констант прямой и обратной реакций.
|
А |
k1 |
В |
|||
|
|
|
|
|
||
|
|
|
||||
|
k2 |
|||||
t = 0 |
|
0 |
||||
a |
||||||
t |
a - x |
x |
||||
t = ∞ |
a - xравн. |
xравн. |
||||
Составим дифференциальное кинетическое уравнение для А.
dc A |
= - k C |
+ k |
C |
B |
= −k (a − x) + k |
2 |
x = −k a + (k + k |
2 |
)x . |
(3.16) |
|
|
|||||||||||
dt |
1 A |
2 |
|
1 |
1 |
1 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
В момент равновесия
91

dC
dtA = 0 = −k1a + (k1 + k2 )xравн.
(k |
+ k |
|
) = |
k1a |
. |
(3.17) |
2 |
|
|||||
1 |
|
|
xравн |
|
||
|
|
|
|
|
||
В любой момент времени t, заменив в уравнении (3.16) (k1+k2) из уравнения (3.17), и СА = (a – x)
d(a − x) |
= − |
dx |
= −k a + |
k1a |
|
|
|
||
dt |
|
dt |
1 |
xравн |
|
|
∫x |
|
|
dx |
|
|
= |
∫t |
k1a |
dt, |
|||||
xðàâí . − x |
|
|||||||||||||
0 |
|
|
|
t=0 |
xðàâí . |
|
|
|||||||
k1 |
= |
xðàâí |
|
ln |
xðàâí |
, |
||||||||
at |
|
xðàâí. − x |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
k1 +k2 |
|
|
1 |
|
|
|
xðàâí |
|
|
|||
|
|
= |
|
|
ln |
|
. |
|||||||
|
|
t |
xðàâí -x |
|||||||||||
x = − |
k1a |
(xравн − x) , |
||||||
|
||||||||
|
|
xравн. |
|
|
|
|
||
ln |
|
xðàâí |
= |
k |
a |
t, |
||
|
|
|
1 |
|
||||
xðàâí . − x |
xðàâí . |
|||||||
|
|
|
||||||
(3.18)
(3.19)
Таким образом, зная концентрации реагента в начальный момент времени и в момент времени t, а также в момент равновесия, можно определить k1 и k2 по уравнениям (3.18) и (3.19). хравн. может быть найдено по закону действующих масс, если известна константа равновесия.
При равновесии
dCA |
=- k1CA + k2CB = 0, |
|
|
|
||||
|
|
|
|
|||||
dt |
|
|
|
|
|
|
||
CB ( ðàâí .) |
= |
k1 |
откуда |
k1 |
= kC , |
(3.20) |
||
CÀ( ðàâí .) |
k2 |
k2 |
||||||
|
|
|
|
|||||
то есть, отношение констант скоростей прямой и обратной реакций равно константе равновесия обратимой реакции. k1 и k2 можно найти, решая систему уравнений (3.19) и (3.20).
Можно получить уравнение для количества прореагировавшего вещества А в любой момент времени t.
Из уравнения (3.19)
xравн |
= e(k1 +k2 )t |
или |
xравн. − x |
= e- (k1 +k2 )t , |
xравн. − x |
|
|
xравн |
|
1− |
x |
= e - (k1 +k2 )t , |
откуда получаем |
|||
|
||||||
|
xравн. |
|
|
]. |
(3.21) |
|
x = xðàâí [1− e |
- (k1 |
+k2 )t |
||||
|
|
|
|
|
||
3.5.3 Последовательные реакции
Последовательные реакции состоят из нескольких стадий, следующих друг за другом. Примером является реакция гидролиза трисахаридов в кислой среде:
92
С Н О + Н О → С Н О + С Н О +H O 3С Н О
18 32 16 2 6 12 6 12 22 11 2→ 6 12 6
Промежуточными продуктами могут быть обычные молекулы, свободные атомы или радикалы, обладающие повышенной химической активностью. Математическое решение уравнений для последовательных реакций является довольно сложным и целесообразно лишь для простейших случаев.
Рассмотрим реакцию, состоящую из двух простых мономолекулярных стадий:
|
A →B →D |
||
|
|
k1 |
k2 |
t = 0 |
C0A |
0 |
0 |
t |
C0A – x |
x – y |
y , |
где (х – у) и у – концентрации веществ В (CB) и D (CD) в момент времени t, соответственно.
Реакция превращения вещества А идет по первому порядку и текущая
концентрация вещества А рассчитывается по уравнению (3.3)
СА = С0А e-k1t.
Приведем уравнение текущей концентрации вещества В (без вывода)
СВ = |
k1CA0 |
( e-k1t - e-k2t). |
(3.22) |
||
k2 |
− k1 |
||||
|
|
|
|||
Ввиду |
того, что обе стадии мономолекулярны и |
расходование |
|||
некоторого количества молекул А приводит к образованию точно такого же количества молекул В, а затем из В образуется D, выполняется равенство
С0А = СА + СВ + СD, откуда
СD = С0А - С0А . e-k1t - |
k1CA0 |
( e-k1t - e-k2t). |
|
k2 − k1 |
|||
|
|
Полученные зависимости могут быть представлены графически в виде кинетических кривых (рисунок 3.11).
C |
|
|
|
|
С |
|
А |
|
|
|
В |
tинд |
tMAX |
t |
Рисунок 3.11 – Зависимость концентраций участников последовательной реакции от времени
93
Для вещества А кривая представляет собой экспоненту. Кривая вещества В проходит через максимум. Время tmax можно найти, если взять
первую производную |
dCB |
и приравнять ее к нулю (условие экстремума). |
||||||
dt |
||||||||
|
|
|
k2 |
|
|
|
||
|
ln |
|
|
|
|
|||
t max = |
k1 |
. |
|
(3.23) |
||||
|
|
|
||||||
k2 |
|
|
|
|||||
|
− k1 |
|
|
|||||
Из уравнения (3.23) видно, что время, необходимое для достижения максимального значения СВ зависит от соотношения констант. Чем
больше k2 при данном постоянном значении k1, тем скорее будет достигаться максимальная концентрация СВ.
Обратимся к конечному продукту D. Скорость его образования зависит
от концентрации вещества В: |
dCD |
= k 2CB . |
|
||
|
dt |
|
В начальный период, когда концентрация вещества В невелика, образование D идет с очень малой скоростью и аналитически не обнаруживается. Такой начальный период реакции называют периодом
индукции, tинд.
Далее кривая имеет S-образный вид, максимальная скорость роста приходится на максимальную концентрацию В, то есть при tmax (B), здесь линия имеет перегиб и дальнейший рост концентрации D замедляется.
Любой процесс, состоящий из ряда последовательных стадий, определяется самой медленной стадией, тормозящей весь процесс. Эта стадия называется лимитирующей.
Выясним условия, когда одна стадия становится лимитирующей,
определяющей |
выход продукта D. Запишем скорость образования D. |
|||||
υD = |
dCD |
= k2CB = |
k1k2CA0 |
( e-k1t - e-k2t). |
(3.24) |
|
dt |
k2 − k1 |
|||||
|
|
|
|
|||
Рассмотрим два крайних случая: |
|
|||||
1. Если k1 « k2, то в уравнении (3.24) величиной k1 в знаменателе |
||||||
можно пренебречь. Поскольку e-k2t « e-k1t , |
то в скобках останется e-k1t. |
|||||
Таким образом,
υD = k1CA0 e-k1t = k1CA ,
то есть скорость образования продукта определяется первой стадией, которая
ибудет в этих условиях лимитирующей.
2.Если k1 » k2, пренебрегаем в алгебраических суммах величинами k2
(в знаменателе) и e-k1t (в скобках).
υD = k2CA0 e-k2t,
вданном случае лимитирующей стадией будет вторая.
94
3.5.4 Сопряженные реакции
Химическая индукция – такое явление, когда одна химическая реакция вызывает (индуцирует) протекание в системе другой, неосуществимой в отсутствие первой.
Две реакции, из которых одна индуцирует протекание другой,
называются сопряженными.
Схема сопряженной реакции в простейшем случае: 1. А + С ≠ Р (реакция не идет самостоятельно); 2. А + J → В (реакция идет самостоятельно);
A + C → P реакции идут совместно в одной системе
A + J → B
Часто в обеих реакциях принимает участие одно и то же вещество, которое самопроизвольно реагирует во второй реакции. Это вещество называется актором (в нашем случае вещество А).
Компонент, который реагируя с актором, индуцирует превращение другого вещества в другой реакции, называется индуктором (вещество J).
Компонент, который вступает в реакцию с актором только в присутствии индуктора, называется акцептором (вещество С).
Например, реакция
2СО + О2→2СО2
Идет только при достаточно высоких температурах. Но если в системе протекает реакция окисления водорода
2Н2 + О2 → 2Н2О, то в этой системе окисляется и СО при невысоких температурах. В этих сопряженных реакциях кислород О2 является актором, Н2 – индуктором, а СО – акцептором.
Явление химической индукции было подробно исследовано Н.А.Шиловым. Им было дано объяснение этому явлению, согласно которому химическая индукция обусловлена тем, что сопряженные реакции протекают через общие активные промежуточные вещества. Такими активными промежуточными продуктами могут быть свободные радикалы, промежуточные окисленные формы ионов, лабильные комплексы и так далее.
Тогда схема простейших сопряженных реакций будет содержать активное промежуточное вещество R и примет вид:
A + J →k1 R R + J →k2 B R + C →k3 P
Таким образом, в сопряженных реакциях образующиеся активные промежуточные вещества взаимодействуют как с индуктором, так и с акцептором, вызывая расходование последнего.
В приведенном выше примере индукция обусловлена образованием радикала гидроксила НО· в цепной реакции окисления водорода, который окисляет и СО
95

НО· + СО → СО2 + Н·
Количественной мерой химической индукции служит фактор индукции Ф, который представляет собой отношение скорости расходования
акцептора, |
dCC |
, к скорости расходования индуктора, |
dcJ |
, то есть |
|
dt |
dt |
||||
|
|
|
Ô= dCC . dÑJ
dCC |
= - k3СR СC , |
dcJ = - k1СА СJ - k2СR СJ. |
|
|
dt |
|
|||
|
dt |
|
||
|
|
K3CR CC |
|
|
|
Ô = |
|
. |
(3.25) |
|
K1CACJ − K2CR CJ |
|||
Однако, полученное уравнение не может быть рассчитано практически, поскольку в формулу входит СR – концентрация неустойчивого промежуточного продукта, которая не может быть определена аналитически. Для такого типа реакций предложен приближенный метод стационарных концентраций, позволяющий избежать использования концентрации СR.
Рассмотрим этот метод подробнее.
3.5.5 Метод стационарных концентраций
Точное рассмотрение кинетики сложных реакций связано с решением дифференциальных уравнений. При увеличении числа стадий и для более высоких порядков стадий математические сложности сильно возрастают. Поэтому становятся целесообразными приближенные методы. К их числу относится метод стационарных концентраций М. Боденштейна. Он применим для рассмотрения стационарного течения процессов, в которых образуются промежуточные частицы со столь высокой реакционной способностью, что не могут накапливаться в системе в концентрациях, соизмеримых с концентрациями исходных веществ и продуктов реакции. Такими частицами являются промежуточные соединения в гомогенных каталитических реакциях, свободные радикалы, в ряде случаев – молекулы или ионы.
За малый промежуток времени после начала реакции скорость образования промежуточного продукта приблизительно равна скорости его расходования. При этом устанавливается стационарная концентрация неустойчивого промежуточного продукта, сохраняющаяся в течение значительной части всего времени хода реакции.
Это условие позволяет перейти к рассмотрению алгебраических уравнений вместо дифференциальных и заменить неопределимые концентрации неустойчивых промежуточных продуктов концентрациями устойчивых веществ, аналитически определимых.
Вернемся к сопряженным реакциям, где для определения фактора индукции (3.25) необходимо знать концентрацию промежуточного
96

неустойчивого продукта СR. При стационарном состоянии концентрация СR
не меняется, то есть dcdtR = 0.
Исходя из механизма течения реакции (с. 95 «Схема сопряженной реакции»)
dcdtR = k1СА СJ - k2СR СJ – k3СR СС = 0,
откуда CR = K1CACJ .
K2CJ + K3CC
Подставляя полученные значения СR в уравнение (3.25), можно получить величину Ф, в которую будут входить только концентрации устойчивых веществ.
Обратимся к рассмотренным выше последовательным реакциям, а
именно к случаю, когда k2»k1, то есть вещество В – неустойчивое, значит можно применить метод стационарных концентраций.
A →k1 В →k2 D,
dcB = k1СА |
- k2СB = 0, |
CB = |
k1CA |
. |
|||
|
|||||||
dt |
|
|
|
|
K2 |
||
Скорость образования продукта D равна |
|||||||
dcD = k2СB |
= k2 |
k1CA |
|
= k1СА = k1 c0A . e-k1t. |
|||
K2 |
|||||||
dt |
|
|
|
|
|||
Таким образом, результат получился тот же, но гораздо проще и без решения сложных дифференциальных уравнений для получения СВ ( вывод был опущен из-за его сложности).
Кинетические различия между простой и сложной реакциями
Одна из задач, которая возникает при кинетическом исследовании, заключается в выяснении, является реакция простой или сложной. Ниже перечислены кинетические признаки, по которым можно отличить простую реакцию от сложной. Следует иметь ввиду, что для признания реакции сложной достаточно проявления у нее хотя бы одного из нижеперечисленных признаков.
Таблица 3.1 - Кинетические признаки простых и сложных реакций
Простая реакция |
Сложная реакция |
|
|
|
|
Состав продуктов может изменяться |
|||
Состав продуктов сравнительно |
||||
прост и не зависит от условий ее |
в |
зависимости |
от |
исходных |
протекания (температуры, исходных |
концентраций, длительности опыта, |
|||
концентраций и так далее) |
температуры и так далее) |
|
||
|
|
|
|
|
97

|
Порядок реакции может быть только |
Порядок |
реакции |
может |
быть |
|||||||||
|
целочисленным (n = 1, 2, 3) |
целочисленным, дробным и даже |
||||||||||||
|
|
|
|
|
отрицательным. |
|
Зависимость |
|||||||
|
|
|
|
|
скорости |
реакции |
от |
концентрации |
||||||
|
|
|
|
|
может описываться более |
сложной |
||||||||
|
|
|
|
|
формулой. Формальный |
порядок |
||||||||
|
|
|
|
|
может |
|
оказаться |
переменным. |
||||||
|
|
|
|
|
Например, скорость реакции |
|
||||||||
|
|
|
|
|
Н2 + Br2 |
|
|
|
|
2HBr |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
описывается формулой |
|
|
|
||||||
|
|
|
|
|
υ = k[Н2][Вr2]1/2·(1 +k´[HBr]/[Br2]-1. |
|||||||||
|
|
Порядок |
и стехиометрический |
|||||||||||
|
Порядок по данному веществу |
|||||||||||||
|
и стехиометрический |
коэффициент |
коэффициент могут различаться |
|
||||||||||
|
всегда совпадают. Например, для |
|
|
|
|
|
|
|
|
|
|
|||
|
реакции Cl· + H2 →HCl + Н· |
|
|
|
|
|
|
|
|
|
|
|||
|
νCl = nCl = 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
νH2 = n H2 = 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Небольшие |
добавки |
соединений |
||||||||||
|
Добавки веществ, практически не |
|||||||||||||
|
меняющих |
свойств |
среды |
могут |
ускорить |
(катализаторы, |
||||||||
|
(диэлектрической |
|
постоянной, |
инициаторы) |
или |
|
замедлить |
|||||||
|
давления, ионной силы и так далее) |
(ингибиторы) протекание реакции |
||||||||||||
|
не влияют на скорость реакции |
Материал и размеры сосуда могут |
||||||||||||
|
Скорость реакции не зависит от |
|||||||||||||
|
материала и |
размеров |
реакционного |
влиять на скорость реакции (катализ, |
||||||||||
|
сосуда |
|
|
|
инициирование, обрыв цепей на |
|||||||||
|
|
|
|
|
стенке сосуда) |
|
|
|
|
|
||||
|
Энергия |
активации |
всегда |
Энергия |
|
активации |
может |
быть |
||||||
|
положительна (Еa ≥ 0) |
|
|
положительной, |
отрицательной и |
|||||||||
|
|
|
|
|
переменной (при измерении в |
|||||||||
|
|
|
|
|
широком интервале температур) |
|
||||||||
|
При изменении условий проведения |
В некоторых случаях (для цепных, |
||||||||||||
|
реакции, таких как давление, |
автокаталитических |
процессов) |
|||||||||||
|
концентрация, температура скорость |
наблюдаются |
критические |
явления, |
||||||||||
|
реакции |
изменяется |
плавно |
когда при незначительном изменении |
||||||||||
|
(пропорционально xn, где х – |
условий проведения опыта скорость |
||||||||||||
|
параметр, n – не очень большая |
изменяется |
очень |
сильно |
(на |
|||||||||
|
величина, то есть 0, 1, 2) |
|
несколько порядков) – процесс или |
|||||||||||
|
|
|
|
|
переходит во взрыв, или, наоборот, |
|||||||||
|
|
|
|
|
останавливается |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
98

3.6 Примеры решения задач
Задача 1
Время половинного разложения уксусно-этилового эфира (С0 = 0,025 моль/л) щелочью (С0 = 0,050 моль/л) равно 6,81 мин. Определить время разложения эфира на 80 %. Реакция второго порядка.
Дано:
СЭ0 = 0,025 моль/л Сщ0 = 0,050 моль/л
t1/2 = 6,81 мин β = 0,8
n = 2
Решение:
t = 0 |
СН3СООС2Н5 |
+ NaOH → СН3СООNa + С2Н5OH |
0,025 |
0,050 |
|
t1/2 = 6,81 |
0,025-0,025·1/2 |
0,050-0,025·1/2 |
t = ? |
0,025-0,025·0,8 |
0,050-0,025·0,8 |
При расчете текущей концентрации следует учесть, что по уравнению реакции исходные вещества реагируют в соотношении 1 : 1, поэтому в любой момент времени количество прореагировавших эфира и щелочи одинаково. Можно рассчитать константу равновесия из данных второй строчки, то есть через 6,81 минут от начала реакции.
|
|
1 |
|
|
|
C |
ý |
|
C 0 |
|
|
1 |
|
0,0125 |
|
0,025 |
|
|
k = |
|
|
|
|
ln |
|
− ln |
ý |
|
= |
|
ln |
|
− ln |
|
|
= |
|
0 |
0 |
) |
|
|
0 |
|
|
|
||||||||||
|
|
Ñù |
|
|
|
6,81(0,025 − 0,050) |
0,0375 |
|
0,050 |
|
|
|||||||
|
t(Cý |
−Ñù |
|
|
Ñù |
|
|
|
|
|||||||||
= 2,38 ìèí -1 (ìîëü/ë) -1
По рассчитанному значению константы, из этого же уравнения
находится время, в течение которого |
прореагирует 80 % эфира, то есть |
|||||||
∆Сэ = ∆Сщ = 0,025 0,8 (данные третьей строки). |
||||||||
t = |
1 |
|
0,050 |
−ln |
0,025 |
|
=18,5 мин. |
|
|
ln |
|
|
|
||||
2,38(0,025 −0,050) |
0,030 |
0,050 |
||||||
|
|
|
|
|
||||
Задача 2
При 310 0С AsH3 (газ) разлагается с образованием твердого мышьяка и водорода. Во время реакции давление в системе изменяется следующим образом:
|
t, час |
0 |
2,5 |
5,5 |
6,5 |
8,0 |
|
|
Р, |
733 |
767 |
806 |
818 |
835 |
|
|
мм.рт.ст. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
99

Показать, что реакция является реакцией первого порядка и вычислить константу скорости.
Решение:
Для подтверждения первого порядка используем графический метод, по которому зависимость lnP от t должна быть линейной. Под логарифмом стоит текущее давление исходного компонента AsH3. В то же время в таблице дано давление в системе, то есть общее давление, состоящее из исходного AsH3 и образующегося Н2, поэтому следует из общего давления выделить давление AsH3.
|
2AsH3 |
→ 2As + 3 Н2 |
|
|
газ |
тв |
газ |
t = 0 |
P0 |
|
0 |
t |
P0-x |
|
3/2x |
Робщ. = (Р0 − х) + 32 х = Р0 + 0,5х
х = Робщ. − Р0 = 2Робщ. − 2Р0
0,5
Отсюда текущее давление AsH3:
РAsH3 = Р0 − х = Р0 −(2Робщ. − 2Р0 ) = 3Р0 −2Робщ.
Р0 =733 мм.рт.ст. при t = 0.
Данные текущего давления заносим в таблицу, строим график lnP = f (t).
t, час |
0 |
2,5 |
5,5 |
6,5 |
8,0 |
PAsH3 , м.рт.ст. |
733 |
665 |
587 |
563 |
529 |
ln PAsH3 |
6,597 |
6,500 |
6,357 |
6,333 |
6,271 |
100
