
stennikova2
.pdf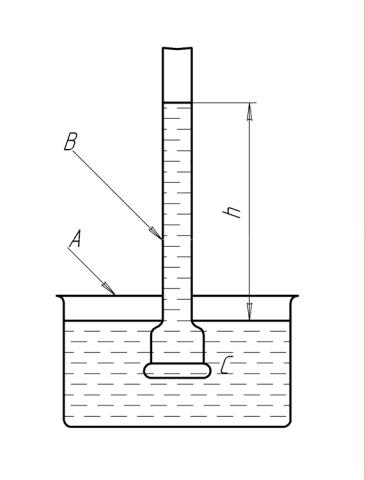
А – внешний сосуд, В – внутренний сосуд, С – полупроницаемая мембрана
Рисунок 1.4 – Простейший прибор для измерения осмотического давления
Если в сосуд (А) поместить раствор с концентрацией большей, чем в (В), то растворитель будет переходить из (В) в (А) (обратный осмос). Обратный осмос наблюдается и при создании давления в трубке В больше осмотического. При этом возникает миграция молекул растворителя из раствора в сосуд А. Этим методом опресняют морскую воду.
Осмотическое давление зависит от концентрации растворенного вещества и температуры по уравнению Вант-Гоффа:
π = CRT , |
(1.4) |
где π - осмотическое давление, Па; С - концентрация растворенного вещества в растворе, моль/м3; R - газовая постоянная, Дж/(моль К); Т - температура, К.
Уравнение (1.4) справедливо для разбавленных растворов неэлектролитов. В растворах электролитов из-за диссоциации на ионы, число частиц будет больше, чем в растворах неэлектролитов, при той же концентрации. Вследствие этого, осмотическое давление будет больше:
π = iCRT ,
где i - изотонический коэффициент, i >1.
11
Явление осмоса и осмотическое давление играют важную роль в жизнедеятельности живых и растительных организмов, в технологических процессах - везде, где есть полупроницаемые перегородки.
Нормальное осмотическое давление клеточного сока у человека 7,5 -7,9 атм (1 атм = 101,325кПа). Любое нарушение осмотического давления вызывает заболевание или свидетельствует о заболевании. В очаге воспаления осмотическое давление увеличивается до 15 -20 атм.
Клетка, например, дрожжевая, помещенная в дистиллированную воду, будет набухать и станет упругой и эластичной. В некоторых случаях избыточная вода может привести к разрыву оболочки и гибели клетки (например, красные кровяные тельца гибнут при поступлении воды внутрь, происходит, так называемый, гемолиз).
Если клетка помещена в концентрированный раствор, то происходит переход воды из сока клетки в раствор, обезвоживание клетки, сморщивание ее, так называемый, плазмолиз, который вызывает нарушение нормального течения физических и химических процессов.
В процессе консервирования и сахар, и соль вызывают плазмолиз клетки микроорганизмов и, тем самым, обеззараживают систему. Кроме того, плазмолиз растительных клеток в растворе соли нарушает полупроницаемые клеточные оболочки. При этом выделяется клеточный сок, содержащий сахара, служащие основой молочно-кислого брожения. Полученная молочная кислота является антисептиком и придает специфический вкус продукту.
1.6 Реальные растворы
1.6.1 Отклонения от закона Рауля
В реальных растворах закон Рауля применим для растворителя лишь в бесконечно разбавленных растворах. В более концентрированных растворах за счет сил межмолекулярного взаимодействия наблюдаются отклонения от закона Рауля.
а) Положительные отклонения
Если εA−A > εA−B ; ε B−B >εA−B , тоестьсилывзаимодействиямеждуоднородными молекулами больше, чем между разнородными, то ∆V смеш> 0 (объем
увеличивается), а ∆H смеш > 0 (тепло поглощается). При этом за счет ослабления сил взаимодействия выход молекул в паровую фазу облегчается и давление пара над реальным раствором становится больше, чем над идеальным:
P реал > Po X |
А |
, |
P реал > PBo X B . |
|
A |
A |
|
B |
|
Положительные отклонения наблюдаются в системах: этанол - диэтиловый эфир; бензол - ацетон; кислород - азот и других.
б) Отрицательные отклонения от идеального поведения характерны для растворов, компоненты которых взаимодействуют друг с другом сильнее,
чем однородные молекулы, то есть εА-В > εА-А; εА-В > εВ-В .
12
При этом возникают водородные связи, происходит сольватация, а иногда образуются химические соединения. Теплота при смешении
выделяется, ∆H cмеш < 0; объем при смешении уменьшается, ∆V смеш < 0;
выход молекул в пар затрудняется и |
Рреал < Ð0 |
Õ |
À |
, |
P реал< Po X |
B |
. |
||
|
А |
À |
|
|
B |
B |
|
||
Такие отклонения наблюдаются в системах |
хлороформ - бензол; |
||||||||
вода - серная кислота и других. |
|
|
|
|
|
|
|
|
|
PA0 |
а |
|
P0 |
|
B |
A |
B |
PA0 |
б |
|
P0 |
|
B |
A |
B |
Рисунок 1.5 - Зависимость давления пара от состава раствора в реальных системах: а) положительные отклонения; б) отрицательные отклонения от закона Рауля
Иногда при одних соотношениях компонентов в растворе наблюдаются положительные отклонения, при других - отрицательные. Пример - раствор пиридина в воде (рисунок 1.6).
Зависимость общего давления от состава жидкости в системах с отклонениями от закона Рауля будет также нелинейной (рисунки 1.5 и 1.6).
|
Р0 |
|
в |
Р0 |
|
п |
|
С6Н5N(п) |
Н2О(в) |
Рисунок 1.6 – Давление в системе пиридин – вода
В системах со значительными отклонениями от закона Рауля на диаграмме Робщ = f(Xж) возможно появление экстремума (минимума или максимума). Экстремум может появиться и при небольшом отклонении от идеального поведения, если давление пара над чистыми компонентами мало
отличаются друг от друга, то есть PA0 ≈ PB0 (рисунок 1.7).
13

|
Р0 |
|
В |
Р0 |
|
А |
|
|
Р0 |
Р0 |
В |
|
|
А |
|
А |
В |
Рисунок 1.7 – Кривые общего давления с максимумом
1.6.2 Активность. Коэффициент активности
Льюис предложил для реальных систем сохранить тот же вид термодинамических уравнений, что и для идеальных, заменив в них переменную, выражающую состав, на другую - активность.
Химический потенциал компонента идеального раствора выражается уравнением
µiид = µi0 (T , P) + RT ln Xi . |
(1.5) |
||
Для неидеальных систем |
|
|
|
µ реал = µo (T , P) + RT ln a , |
|
||
i |
i |
i |
|
где аi - активность компонента i; |
ai = γi Xi ; |
γi - коэффициент активности. |
|
µiреал = µi0 (P,T ) + RT ln X i + RT lnγi . |
(1.6) |
||
Введение активности и коэффициента активности позволяет наиболее просто сопоставлять между собой свойства реальной и идеальной систем.
Из уравнений (1.5) и (1.6) видно, что химический потенциал реальной системы отличается от идеальной на величину:
µiреал − µiид = RT lnγi .
Изменение химического потенциала есть работа при переходе одного моля компонента из идеального раствора в реальный при Р,Т = const. Значения γ отражают особенности межмолекулярных взаимодействий, различия в свойствах компонентов раствора. Чем ближе раствор по свойствам к идеальному, тем ближе значение γ к единице. В идеальном растворе по закону Рауля:
Xiж = Piид .
Pio
14
Вреальном, вместо Х ж - активность, a |
i |
, a |
= |
Pi реал |
отсюда γ |
i |
= |
Pi реал |
. |
|
|
||||||||||
Po |
||||||||||
i |
i |
|
|
|
Рид |
|||||
|
|
|
|
i |
|
|
|
i |
||
При положительном отклонении γi > 1, при отрицательном - γi < 1.
1.7 Растворимость
Растворимость – это способность веществ образовывать гомогенные системы. Количественно она выражается в виде концентрации насыщенного раствора. Раствор считается насыщенным, если он находится в равновесии с избытком растворяемого вещества.
Жидкие растворы могут быть образованы растворением в жидком растворителе твердого вещества, газа или жидкости.
1.7.1 Растворимость твердых веществ в жидкости
На растворимость любых веществ, прежде всего, влияет природа растворителя и растворенного вещества. Идеальные растворы образуются веществами, сходными по химическому составу и по физическим свойствам. Часто сходство и различие выражается в виде полярности молекул и отражается на растворимости: полярные вещества лучше растворяются в полярных растворителях, а неполярные вещества - в неполярных растворителях.
Из внешних факторов наиболее значимым является температура. При образовании идеальных растворов твердого вещества в жидкости влияние температуры определяется уравнением И. Ф. Шредера:
d ln Xi |
= |
∆Hiпл |
, |
(1.7 ) |
|
RT 2 |
|||
dT |
|
|
||
где Хi - растворимость i –го компонента (молярная доля i –го компонента в насыщенном растворе); ∆Hiпл - его молярная теплота плавления.
Поскольку ∆Hiпл > 0, то и |
d ln X i |
> 0, следовательно, идеальная |
|
dT |
|||
|
|
растворимость твердого вещества в жидкости при повышении температуры всегда увеличивается.
Интегрирование уравнения (1.7) в пределах от XiI |
до XiII и от Т1 до Т2 |
||||||||||||
приводит к уравнению: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
II |
|
пл |
|
1 |
|
|
пл |
(T1 |
−T2 ) |
|
||
ln |
Xi |
= − |
∆Hi |
1 |
− |
|
= − |
∆Hi |
. |
||||
I |
R |
|
|
|
|
R(T2 T1) |
|||||||
|
Xi |
|
T2 |
|
T1 |
|
|
||||||
Если взять X I =1 (чистый компонент), Т1 = T 0 пл |
, тогда: |
|
|||||||||||
i |
|
|
|
|
|
|
|
|
|
i |
|
|
|
15

ln Xi = − ∆Hiпл(Ti00−T ) .
RTTi
Для реальных растворов уравнение (1.7) имеет иной вид:
d ln a |
∆H |
раств |
|
|
|
i |
= |
i |
|
, |
(1.8) |
|
RT 2 |
||||
dT |
|
|
|||
где аi – растворимость, выраженная в виде активности растворенного вещества; ∆Hiраств - молярная теплота растворения вещества в насыщенном растворе.
Поскольку ∆Hiраств может иметь и положительные, и отрицательные значения, и даже равняться нулю, то и первая производная, d dTln ai , так же может иметь разные знаки:
d ln ai > 0, с ростом температуры растворимость увеличивается; dT
d ln ai < 0, с ростом температуры растворимость уменьшается; dT
d ln ai = 0, изменение температуры не влияет на растворимость. dT
1.7.2 Растворимость газов в жидкости
Влияние давления газа на растворимость выражается законом Генри:
«Парциальное давление пара растворенного вещества пропорционально его молярной доле в растворе»:
Р2 = КX 2 ,
где Р2 – парциальное давление растворенного газа; К – константа Генри; Х2 – молярная доля растворенного газа в растворе.
Закон Генри получен для газов, не вступающих в химическое взаимодействие с растворителем, применим при постоянной температуре и невысоких давлениях.
Он может быть применен и для растворов летучих жидкостей при образовании бесконечно разбавленного раствора.
Для бесконечно разбавленного реального раствора парциальное давление растворителя вычисляется по закону Рауля, а растворенного вещества – по закону Генри. Это иллюстрируется рисунком 1.5.
Рассмотрим линию парциального давления компонента А. В области растворов с большим содержанием компонента А он является растворителем, и зависимость РА = f (X A ) выражается прямой, совпадающей с прямой
PA = PA0 X A (по закону Рауля, пунктирная линия). В области больших содержаний компонента В, компонент А является растворенным веществом,
16

зависимость РА = f (X A ) на этом участке так же прямолинейна, но подчиняется закону Генри РА = K X A и идет по прямой, не совпадающей с пунктирной линией, поскольку в реальных растворах K ≠ PA0 .
С расширением интервала концентраций идеального состояния раствора прямолинейные отрезки кривых увеличиваются. Если же раствор будет идеальным при всех концентрациях, то уравнения законов Рауля и Генри
будут тождественными, а K = P20 . В этом случае кривые становятся прямыми
линиями (пунктирные линии на рисунке 1.5).
Закон Генри может быть записан в другой форме:
Х2 = РК2 = КI P2 .
«Растворимость газа, не вступающего в химическое взаимодействие с растворителем, прямо пропорциональна его парциальному давлению в газовой фазе»
Растворимость может быть выражена не только в виде молярной доли, Х, но и через концентрацию:
С = КII P2 ,
где С, |
ìîëü |
; |
ìîëü |
; |
ã |
; |
ã |
. |
|
ë |
ì 3 |
ë |
ì 3 |
||||||
|
|
|
|
|
Какую из форм уравнения Генри следует применять, можно определить по размерности константы Генри: К [Р]; КI [P−1 ]; КII [С Р−1 ].
Мерой растворимости газа служит также α – коэффициент поглощения (коэффициент абсорбции). Это объем газа, приведенный к нормальным условиям (Т = 273 К, Р = 101,325кПа), растворенный в одном объеме растворителя:
α = |
V0 |
. |
|
|
|
||
|
Vр−ль |
|
|
Тогда закон Генри можно записать в виде уравнения: |
|
||
V0 =α P2 |
(1.9) |
||
Величина α не зависит от давления. Если объем газа измеряется при температуре опыта, то уравнение (1.9) примет вид:
VT = β P2 ,
где β – коэффициент растворимости, также не зависит от давления.
αβ = 273T .
На растворимость газа влияет температура по уравнению:
17

d ln K |
= |
∆H раств |
, |
|
dT |
RT 2 |
|||
|
|
где К – константа Генри; ∆H раств - теплота растворения газа в насыщенном
растворе.
Для большинства газов ∆H раств< 0 (экзотермический эффект),
следовательно, при увеличении температуры растворимость газа уменьшается.
На растворимость газов влияет присутствие третьего компонента. Так, в водных солевых растворах растворимость газов меньше, чем в чистой воде. Это явление называется «высаливанием».
Зависимость растворимости газа в водном растворе от концентрации соли выражается уравнением Сеченова:
lg XX0 = KC ,
где Х0, Х – молярные доли газа в чистой воде и солевом растворе, соответственно; С – концентрация соли, моль/л; К – константа, характерная для данной соли.
При совместной растворимости нескольких газов каждый газ растворяется в жидкости независимо от других газов (в соответствии со своим парциальным давлением и коэффициентом растворимости).
Состав растворенной газовой смеси отличается от состава газовой смеси над раствором. Так, если в воздухе содержится 78 % азота и 21 % кислорода, то в растворенном в воде воздухе содержится 63 % азота и 35 % кислорода.
1.7.3 Взаимная растворимость жидкостей
На растворимость жидкостей друг в друге, кроме природы жидкостей, большое влияние оказывает температура.
Рассмотрим наиболее часто встречающийся случай возрастания растворимости с повышением температуры (рисунок 1.8):
Т
|
|
|
K |
|
|
|
|
|
|
a3 |
b3 |
|
|
|
|
a2 |
m2 |
b2 |
|
|
|
|
|
|
|
||
|
|
a1 |
m1 |
b |
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
A |
a |
m d c |
b |
B |
||
Рисунок 1.8 – Диаграмма взаимной растворимости двух жидкостей Линия аК – линия растворимости В в А в зависимости от температуры.
Линия bК – линия растворимости А в В. Область аКb – область равновесного
18
существования двух жидких фаз, состав которых находится на линиях аК и bК. Точка К – верхняя критическая точка растворения. Возьмем систему, изображенную точкой «m». Она приготовлена путем смешения компонента
Ав количестве mВ и компонента В в количестве mА. Компоненты А и В растворяются ограниченно друг в друге и при смешении образуют два слоя:
Ав В (состава b) и В в А (состава а). Коннода аb принимается за 100 %, а отрезки аm и mb показывают относительное количество этих слоев, соответственно слоя «b» и слоя «а».
При повышении температуры взаимная растворимость компонентов увеличивается и составы равновесных жидких фаз изменяются: от точки «а»
к «а1», «а2» и так далее до точки «а3» и от точки «b» к «b1», «b2», «b3». При этом количество фазы «b» (отрезок аm) постоянно уменьшается до а1m1, а2m2 и при температуре, отвечающей точке а3, исчезает совсем, система выходит из области расслаивания и становится гомогенной, то есть, компоненты А и В при более высоких температурах растворяются друг в друге неограниченно. Аналогично достигается гомогенность системы, взятой в интервале сb, здесь исчезает фаза «а». Иначе достигается гомогенность при нагревании системы «с», которая попадает в точку «К». Здесь слои не исчезают, а при нагревании их составы сближаются, в точке К оба слоя имеют одинаковый состав и поверхность раздела слоев исчезает.
Положение критической точки можно определить, применив правило В. Ф. Алексеева:
«Середины коннод ложатся на общую прямую, которая заканчивается в критической точке растворения» (прямая dk,
рисунок 1.8).
Кроме рассмотренной системы с верхней критической точкой существуют такие, в которых на кривой растворимости имеется нижняя критическая точка (растворимость увеличивается с понижением температуры), и такие, в которых есть как верхняя, так и нижняя критические точки.
На растворимость двух жидкостей влияет добавление третьей жидкости. Этот вопрос подробно рассмотрен в методическом указании М. Ф. Стенникова, Н. Г. Комарова, А. В. Протопопов «Трехкомпонентные системы». – Барнаул : Изд-во АлтГТУ, 2005.- с.21-25.
1.8 Равновесие жидкий раствор – насыщенный пар в различных жидких смесях
1.8.1 Неограниченно смешивающиеся жидкости
Равновесие жидкость – пар изображается в виде зависимости общего давления от состава жидкости и состава пара или температуры кипения от состава жидкости и пара.
1.8.1.1 Состав пара и жидкости. Законы Коновалова
19
Как уже рассматривалось, общее давление над идеальным раствором |
||||||||||||
изменяется линейно (рисунок 1.2) с изменением состава жидкости. Состав |
||||||||||||
пара отличается от состава равновесной с ним жидкости. Из закона Дальтона |
||||||||||||
следует, что парциальные давления компонентов газовой смеси равны |
||||||||||||
P = P |
Χпар, следовательно: |
X пар |
= |
|
Рi |
,втовремякак X ж = Pi . |
||||||
i |
общ |
i |
i |
|
|
Pобщ |
|
|
|
i |
Pio |
|
|
|
|
|
|
|
|
|
|
|
|||
|
Р |
Т= const |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ж |
|
|
|
|
|
0 |
|
|
|
жидкость |
|
|
|
|
|
|
|
РВ |
|
|
|
|
|
(x) |
|
|
|
|
|
||||
|
|
|
f |
i |
|
|
|
|
|
|
|
|
|
|
|
= |
|
|
|
|
|
|
|
|
|
|
|
Р щ |
|
|
|
|
|
|
|
|
|
|
|
|
|
б |
|
|
|
|
|
|
|
|
|
|
|
|
о |
|
|
|
|
|
|
ар |
|
|
|
Р |
|
|
|
|
|
|
|
п |
) |
|
|
|
|
|
|
|
|
|
f(x |
|
|
|||
|
1 |
|
|
|
Р |
= |
i |
|
|
|||
|
|
|
|
|
щ |
|
|
|
|
|
||
|
Р0 |
|
|
|
|
об |
|
|
|
|
|
|
|
пар |
|
|
|
|
|
|
|
|
|
|
|
|
А |
|
|
|
|
|
|
|
|
|
|
|
|
А |
x |
y |
|
|
|
|
|
|
|
В |
|
Рисунок 1.9 - Зависимость общего давления от состава жидкости и пара |
||||||||||||
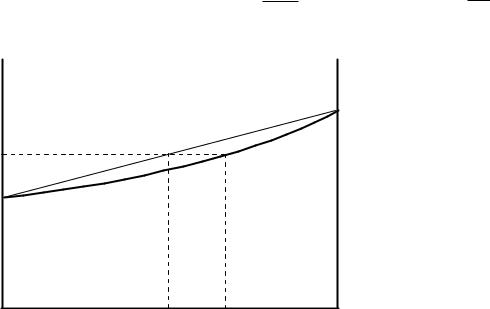
Эти две зависимости обычно изображают на одной диаграмме (рисунок 1.9). Линия жидкости и линия пара делят плоскость диаграммы на три фазовых поля. Верхнее поле - жидкая фаза, нижнее - пар, между этими полями - гетерогенная область находящихся в равновесии жидкости и пара. Например, при общем давлении Р1 находятся в равновесии две фазы: жидкость состава X и пар состава У.
Из рисунка 1.9 видно, что в идеальных системах пар, по сравнению с равновесной жидкостью, всегда обогащен более летучим компонентом, в данном случае компонентом В. В реальных же растворах не всегда паровая фаза обогащена более летучим компонентом.
Более общая зависимость состава пара от состава жидкости дается первым законом Д.П. Коновалова:
«В равновесной системе пар по сравнению с жидкостью обогащен тем компонентом, добавление которого повышает общее давление пара (или понижает температуру кипения раствора при постоянном давлении)».
Так в системе, изображенной на рисунке 1.9, добавление к раствору, например, компонента В, приводит к росту общего давления, следовательно, в паре будет содержаться компонента В больше, чем в жидкости. В системе же на рисунке 1.10 добавление В приводит к росту общего давления лишь до точки С (Сl), а дальнейшее добавление В снижает общее давление,
20
