
Дипломы-2 / ВЗД-172 / Документы / Производство / ВЫСОКИЕ ТЕХНОЛОГИИ
.pdf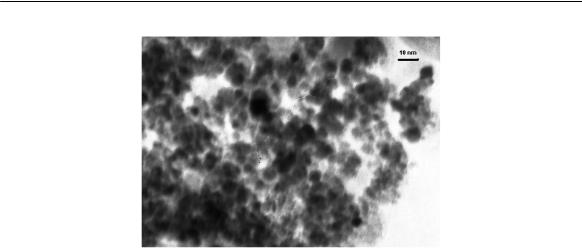
ВТСНТ – 2013
Рис. 2. Электронная микрофотографиячастиц магнетита (по данным ОСМ ТНЦ СО РАН).
Методы:
1. Приготовление суспензии немодифированных наноразмерных частиц магнетита для внутривенного введения.
Навеску сухого нанопорошка магнетита растворяли в водно-солевом стабилизирующем растворе, содержащем хлорид натрия, натрия цитрат и динатриевую соль 4-(2-гидроксиэтил)пиперазин-1-этансульфониевой кислоты. Полученную суспензию подвергали сонификации на ультразвуковом дезинтеграторе в течение 30 мин, для разрушения агрегатов наночастиц, которые образуются при их хранении. Раствор после дезинтеграции подвергали центрифугированию в гравитационном поле 500 g, в течение 5 мин, с целью осаждения агломератов наноразмерных частиц.
Супернатант отбирали автоматической пипеткой и фильтровали через поликарбонатные фильтры с диаметром пор – 100 нм под избыточным давлением аргона, после чего использовали для исследования.
2. Приготовление суспензии липосом и магнитолипосом на основе наноразмерных частиц магнетита для внутривенного введения методом экструзии.
Для получения мультиламеллярных везикул использовали метод обращения фаз. Липиды (1,2-дипальмитоил-sn-глицеро-3-фосфохолин (DPPC), 1,2-дистеароил- sn-глицеро-3-фосфохолин (DSPC), Lipoid GmbH, Германия), 1,2-дистеароил-sn- глицеро-3-фосфоэтаноламин-N-[метокси(поли-этиленгликоль)-2000] аммониевая соль (DSPE-PEG-2000) и холестерин (Avanti Polar Lipids, Inc., США) растворяли в
40 мл хлороформа и переносили в сухую круглодонную колбу, которую соединяли с роторным испарителем (ИР-1М2). C целью предотвращения окисления липидов добавляли α-токоферола ацетат. В течение 40 мин на водяной бане (при температуре 56 С) отгоняли хлороформ, в результате происходило образование липидной плёнки. Пленку ресуспендировали добавлением 10 мл хлороформа и вновь отгоняли на роторном испарителе. Процедуру повторяли трижды.
Дипальмитоилфосфатидилхолин (DPPC) - 103,98 мг. Дистеароилфосфатидилхолин (DSPC) - 12,44 мг. Дистеароилфосфатидилэтаноламин-ПЭГ-2000 (DSPE-PEG-2000) - 0,88 мг. Холестерин (Chol) - 1,22 мг.
139

Секция 4. Химические и биотехнологии.
α-токоферола ацетат (α-TA) - 1,48 мг. Всего липидов 120 мг.
Молярные соотношения компонентов липосомальной мембраны:
DPPC : DSPC : Chol : DSPE-PEG-2000 : α-TA = 9 : 1 : 0,2 : 0,02 : 0,2 [Тазина, 2010].
Для получения магнитолипосом образовавшуюся липидную пленку гидратировали 15 мл суспензии наноразмерных частиц магнетита (см. п.1).
Суспензию мультиламеллярных везикул и наночастиц перемешивали с помощью стеклянных шариков, на вращающемся роторе, затем вносили с помощью шприца в рабочую камеру экструдера Avanti Mini-Extruder (Avanti Polar Lipids, Inc.,
США).
При получении полых липосом липидную пленку гидратировали 15 мл стабилизирующего раствора (см. п.1).
Образовавшуюся после гидратации суспензии экструдировали через поликарбонатные фильтры Costar (Canada) с размером пор 200 нм при температуре 50 °C под избыточным давлением (15 атм.) аргона. Содержание липида в полученной эмульсии – 8 мг/мл.
Свежеприготовленную суспензию липосом и магнитолипосом подвергали стерилизующей фильтрации под давлением через нейлоновые мембранные фильтры
сразмером пор 0,22 мкм (Pall Corporation, США).
3.Концентрацию железа в суспензии определяли рентгенофлуоресцентным методом (Quant'X, Thermo Scientific, Швейцария) и методом атомно-эмиссионной спектрометрии (iCAP 6300 Duo, Thermo Scientific,
Великобритания), с последующим пересчетом на концентрацию магнетита.
4.Распределение частиц по размерам в суспензии проводили методом динамического светорассеяния на лазерном анализаторе размерности Zetasizer nano zs (Malvern Instruments, Великобритания).
5.Форму и структуру частиц в суспензии устанавливали с помощью просвечивающего электронного микроскопа JEM-100 CX II (JEOL, Япония).
Выводы
1.Методом экструзии получены магнитолипосомы на основе немодифицированных наноразмерных частиц магнетита.
2.Магнитолипосомы представлены мультиламеллярными липосомами, в полости которых распложены свободные частицы магнетита и их агломераты.
3.Экструзия через поликарбонатные фильтры (d=200 нм) обеспечивает относительную однородность полученных магнитолипосом, которые имеют относительно узкое распределение по размерам.
4.Концентрация магнетита в суспензии магнитолипосом составляет 5 мг/мл.
140

ВТСНТ – 2013
МОДИФИКАЦИЯ СТРУКТУРЫ ГУМИНОВЫХ КИСЛОТ В ПРОЦЕССЕ МЕХАНОХИМИЧЕСКОЙ ОБРАБОТКИ БУРОГО УГЛЯ
Т.С. Уразова1, студент, А.Л. Бычков2, к.х.н., О.И. Ломовский2, д.х.н., проф 1Новосибирский государственный университет,630090,Новосибирск,ул.Пирогова, 2, 2Институт химии твёрдого тела и механохимии СО РАН, 630128, Новосибирск,
ул. Кутателадзе, 18, тел 8(913)707-9505
E-mail: urazovatanya@mail.ru; bychkov_a@solid.nsc.ru
Гуминовые кислоты (ГК) являются сложными полифункциональными высокомолекулярными органическими соединениями почвы, торфа и бурого угля, не имеющими постоянного химического состава и играющими важную роль в процессах трансформации и транспорта неорганических соединений в природных системах [1]. Одновременно с этим гуминовые кислоты являются неотъемлемой частью важнейших обменных процессов в биосфере и круговорота органического углерода на Земле. Амфифильный характер ГК обеспечивает их химическое связывание с различными неорганическими и полярными органическими соединениями; менее полярные органические соединения вступают с ними в неспецифические физические взаимодействия [2]. В связи с этим для борьбы с различными загрязнениями или ремидиации повреждённых почв представляется эффективным использование продуктов на основе гуминовых кислот.
На сегодняшний день существуют механохимические подходы к переработке природного сырья, в частности бурого угля – наиболее богатого источника гуминовых кислот, позволяющие значительно увеличивать выход водорастворимых гуминовых кислот [3, 4]. Однако на существующем уровне техники не решены проблемы с масштабным производством гуминовых препаратов, что обуславливает необходимость в дальнейшем развитии твердофазных механохимических методов извлечения и модификации структуры гуминовых веществ, добавлении дополнительного количества функциональных групп, обуславливающих сорбционные свойства.
Целью данной работы являлась механохимическая модификация структуры гуминовых кислот бурого угля и получение образцов сорбентов, обогащённых необходимыми функциональными группами
Механохимическую обработку исследуемого бурого угля проводили в лабораторном активаторе АГО-2 при расчётном ускорении мелющих тел 200 м/с2 и времени обработки 2 минуты. В качестве реагентов использовали гидроксид натрия (щелочной реагент, классически используемый в работах с гуминовыми кислотами), и перкарбонат натрия Na2CO3∙1.5H2O2 (новый щелочно-окислительный реагент, модифицирующий структуру гуминовых кислот).
Механическая активация, как со щелочным, так и с окислительным реагентом, приводит к увеличению выхода гуминовых кислот (таб. 1). По содержанию функциональных групп, определённому потенциометрическим титрованием, можно судить о зависимости химической структуры ГК от условий механохимической обработки.
При обработке угля с гидроксидом натрия происходит классическое образование гумата натрия без образования новых функциональных групп [4, 5]. В результате обработки угля с перкарбонатом натрия увеличивается содержание
141

Секция 4. Химические и биотехнологии.
фенольных и карбоксильных функциональных групп, что придаёт полученному материалу повышенную сорбционную ёмкость по отношению к тяжёлым металлам.
Таблица 1
Содержание гуминовых кислот и функциональных групп в исходном угле и продуктах механохимической обработки
Образец |
Содержание ГК, % |
Содержание функциональных групп, ммоль/г |
||
фенольные |
карбоксильные |
|||
|
|
|||
Исходный |
23,6 ± 0,4 |
10,0 ± 0,9 |
3,1 ± 0,4 |
|
уголь |
||||
|
|
|
||
Гумат натрия |
59,6 ± 1,1 |
8,0 ± 0,9 |
4,8 ± 0,5 |
|
Окисленный |
72 ± 3 |
7,7 ± 0,8 |
6,3 ± 0,7 |
|
гумат натрия |
||||
|
|
|
||
Методом эксклюзионной гель-хроматографии показано, что механохимическая обработка при использованных условиях не приводит к значительному изменению молекулярно-массового распределения (ММР) гуминовых кислот (рис. 1), часто наблюдаемому в механохимии полимеров при более интенсивных режимах обработки.
Интенсивность |
500 |
|
|
|
|
|
Гумат натрия |
|
|
|
|
|
|
|
|
Окисленный гумат |
|
||
400 |
|
|
|
|
|
Исходный уголь |
|
||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
300 |
|
|
|
|
|
|
|
|
|
200 |
|
|
|
|
|
|
|
|
|
100 |
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
6 |
6,5 |
7 |
7,5 |
8 |
8,5 |
9 |
9,5 |
10 |
|
|
|
|
|
|
|
|
Время, мин |
|
|
Рис. 1. ММР гуминовых кислот исходного угля и продуктов |
|
|
||||||
|
|
|
механохимической обработки |
|
|
|
|
||
Полученные сорбенты показали высокую эффективность при связывании тяжёлых металлов (Cd, Cu, Cr, Zn, Pb) в условиях лабораторного и натурного экспериментов [6].
Список литературы
1.Орлов Д.С. Гумусовые кислоты почв и общая теория гумификации. / Изд-во МГУ, М., 1990, 325с.
2.Пройдаков А.Г. Гуминовые кислоты из механообработанных углей // Химия твердого топлива. – 2009. – №1. – С.13-19
142

ВТСНТ – 2013
3.Иванов А.А., Юдина Н.В., Ломовский О.И. Механохимическая обработка верхового торфа // Химия растительного сырья. – 2004. – № 2. – С.55-60.
4.Юдина Н.В., Тихова В.И. Структурные особенности гуминовых кислот торфов, выделенных разными способами // Химия растительного сырья. – 2003. – № 3. – С.29-34.
5.Ломовский О.И., Иванов А.А., Рожанская О.А., Юдина Н.В., Королев К.Г. Изменение состава и свойств водорастворимых компонентов торфа при механохимической обработке // Химия в интересах устойчивого развития. – 2004. – № 3. – С.355-361.
6.Urazova T.S, Bychkov A.L., Lomovsky O.I. Mechanochemical Modification of Humic Acids to Create Microreator Particles Absorbing Inorganic Pollution // Second International Conference of CIS IHSS on Humic Innovative Technologies “Natural and engineered nanoparticles in clean water and soil technologies” (Moscow, Russia, October 29 – November 2, 2012) : book abstr. – Moscow, 2012.
– P. 77
ЗАВИСИМОСТЬ СТРУКТУРЫ ПРОДУКТА НЕРАВНОВЕСНОГО ЭЛЕКТРОХИМИЧЕСКОГО ОКИСЛЕНИЯ МЕДИ И АЛЮМИНИЯ ОТ СТАРЕНИЯ И УСЛОВИЙ ТЕРМООБРАБОТКИ
В.В. Коробочкин, д.т.н., проф. Н.В. Усольцева, инженер Томский политехнический университет, 634050, Россия, г. Томск, пр. Ленина, 30
E-mail: usoltseva.nv@mail.ru
Известно, что состав и структура материала зависят не только от способа его получения, но и в значительной степени определяются физико-химическими процессами, протекающими при старении. В тоже время на стадии термообработки структура материала может изменяться как за счет термического воздействия, так и вследствие влияния условий проведения процесса термообработки (инертная среда, повышенное или пониженное давление).
В работе представлены результаты исследования продукта совместного неравновесного электрохимического окисления меди и алюминия [1]. Для оценки влияния старения под раствором и сушки при давлении ниже атмосферного на продукт электролиза использовался рентгенофазовый анализ.
На рис. 1 представлены результаты рентгенофазового анализа серии образцов, условия получения которых приведены ниже.
1.Старение под раствором до образования карбонатов (~ 20 суток), сушка на воздухе и в печи при 110 °С (I).
2.Старение под раствором в течение 50 суток:
а) сушка осадка на воздухе и в печи при 110 °С (II);
б) длительное осаждение из стабильной суспензии, сушка на воздухе и в печи при 110 °С (III).
3.Старение под раствором, сушка на воздухе и в печи при 150 °С (IV).
4.Старение под раствором, сушка под давлением 3-5 кПа (V).
Независимо от условий старения и термообработки образцы состоят из гидрата двойного карбоната меди-алюминия (Cu-Al/LDH), оксида меди (II) и бемита [2].
143

Секция 4. Химические и биотехнологии.
Рис. 1. Рентгенограммы продукта неравновесного электрохимического окисления меди и алюминия
Несмотря на постоянство фазового состава смещение рефлексов Cu-Al/LDH относительно значений, приведенных в базе данных, свидетельствует о влиянии условий как старения, так и термообработки на структуру материала.
Смещение характерно для всех рефлексов Cu-Al/LDH. Поскольку различие более выражено для рефлекса с максимальной интенсивностью, на рис. 2 представлены фрагменты рентгенограмм в том интервале удвоенных углов отражения (11…13°), где прописывается указанный рефлекс. Вертикальная пунктирная линия соответствует справочным данным.
Полагаем, что за смещение рефлексов, то есть увеличение или уменьшение межплоскостного расстояния, ответственно электростатическое взаимодействие между гидроксильными слоями и анионами, расположенными между слоями [3]. Интенсивность этого взаимодействия определяется, в том числе, количеством указанных ионов. Поскольку условия приготовления образцов слабо влияют на карбонат-ионы, отклонение межплоскостного расстояния обусловлено изменением толщины гидроксильного слоя.
Хранение продукта электролиза под раствором в течение времени, достаточного для полной его отмывки от ионов электролита и для протекания до конца процесса образования Cu-Al/LDH (I), позволяет получать продукт, в состав которого входит Cu-Al/LDH с параметрами, соответствующими справочным данным. Старение продукта электролиза в течение более длительного периода времени (II) приводит к частичной дегидратации, ослаблению взаимодействия гидроксильного слоя и карбонат-ионов, как следствие, к расщеплению рефлекса с появлением пика,
соответствующего большему значению межплоскостного расстояния. Элементы структуры с большим значением межплоскостного расстояния, относительно стандартного, обладают пониженной термостойкостью. При термообработке они разрушаются в первую очередь. В результате не наблюдается расщепление наиболее интенсивного пика и смещение остальных пиков (IV).
144

ВТСНТ – 2013
Стабилизация суспензии продукта электролиза (III) происходит из-за электростатического отталкивания частиц в растворе и большой толщины двойного электрического слоя. В таком случае значительное количество воды и гидроксильных ионов присутствует не только на поверхности частиц, но и входит в их структуру. Дополнительный гидроксильный покров усиливает взаимодействие слоев с карбонат ионами и уменьшает межплоскостное расстояние. На рентгенограмме это проявляется смещением рефлексов в сторону больших значений 2θ.
Если сушка при атмосферном давлении приводит к разрушению элементов структуры с увеличенным значением межплоскостного расстояния, то сушка при пониженном давлении, наоборот, способствует их образованию (V).
Список литературы
1.Коробочкин В.В., Усольцева Н.В., Балмашнов М.А. Электрохимический синтез медь-алюминиевой оксидной системы в неравновесных условиях // Фундаментальные исследования. – 2012. – № 11 (1). – С. 143–147.
2.Коробочкин В.В., Усольцева Н.В., Балмашнов М.А. Фазовый состав наноразмерных продуктов неравновесного электрохимического окисления меди и алюминия // Известия ТПУ. – 2012. – Т. 321. – № 3. – С. 59–63.
3. Developments in Clay Science. V. 1. Handbook of Clay Science. Edited by F. Bergaya, B.K.G. Theng, G. Lagaly. – Amsterdam: Elsevier Science, 2006. – 1224 p.
СИНТЕЗ РАЗЛИЧНЫХ АРИЛИОДОКСОЛОВ И ИЗУЧЕНИЕ ИХ ХИМИЧЕСКИХ СВОЙСТВ
А.Э. Чаусова, студент гр. 4ГМ11 Научный руководитель: М.С. Юсубов, д.х.н., проф., Р.Я. Юсубова, к.х.н., доц.
Национальный исследовательский Томский политехнический университет, 634050, г. Томск, пр. Ленина, 30,
E-mail: happybear.nastya@mail.ru
Исследования в области химии поливалентного иода начались еще 1983, а за последние два десятилетия резко возрос интерес к этим соединениям благодаря их экологически мягким и селективным окислительным способностям. Все чаще данные соединения стали использовать в органическом синтезе не только как субстраты и реагенты для различных реакций, но даже иногда и в качестве катализаторов. Соединения поливалентного иода катализируют различные реакции окисления, такие как окисление спиртов, α-окисление кетонов, окислительная спироциклизация фенолов и т.д.[1]
Внашей работе в качестве соединений поливалентного иода используются иодониевые соли. Как известно, стабильные иодониевые соли нашли многочисленное практическое применение в химии, например, как катионные фотоинициаторы в химии полимеров или как биологически активные соединения.
Вданной работе описывается метод пара-селективного получения замещенных арилиодоксолов с использованием иодониевых солей, а также дальнейшее использование полученных соединений.
145

Секция 4. Химические и биотехнологии.
Используемый нами метод позволяет, не выделяя иодониевую соль, вводить ее в реакцию получения замещенных арилиодоксолов, т.к. некоторые иодониевые соли бывают нестабильны на воздухе, что могло значительно затруднить выделение продуктов реакции.[2]
Схема и механизм реакции получения арилиодоксолов представлены на рисунке 1.
Рис. 1. Метод получения арилиодоксолов
Синтез включает в себя две важных стадии: на первой стадии происходит образование иодониевых солей, что достигается с помощью окисления субстрата OXONE-ном, а на второй стадии происходит образование соответствующих арилиодоксолов, чего мы добиваемся, экстрагируя продукт метиленом хлористым, а остальные реагенты остаются в водной среде. Таким образом данная методика также позволяет сократить к минимуму проблему выделения продукта.
Данный синтез проводится с использованием сильного окислителя OXONE (2KHSO5·KHSO4·K2SO4), который является стабилизированным, нетоксичным и безопасным в обращении окислителем.
Селективное пара-замещение возможно вследствие стерического эффекта, который приводит к возникновению псевдотреугольной бипирамидальной геометрии, в результате которой возникает Т-образный угол, что влечет за собой возможность замещения атома исключительно в пара-положении.[3]
Таким образом структуры полученных арилиодоксолов, а также их выходы
приведены в таблице 1. Структура данных соединений подтверждена методом ЯМР
1Н.
Таблица 1
Выходы и структура полученных арилиодоксолов
Продукт Выход, %
I |
86 |
O
O [a]
67

 I
I
O
O [b]
146

ВТСНТ – 2013
62

 I
I
O
O [c]
Br
44

 I
I
O
O [d]
I
57

 I
I
O
O [e]
Cl
43

 I
I
O
O [f]
Данные арилиодоксолы были получены для проведения реакций этерификации, но мы столкнулись с проблемой того, что в одну стадию этерификация не проходит. Именно поэтому сначала мы решили провести функционализацию полученных соединений поливалентного иода. Схема реакции приведена на рисунке 2.
I |
SOCl2 |
ICl |
|
+H2O+ SO2 |
|||
O |
|
||
|
reflux,6h |
Cl |
|
|
|
||
O |
|
O |
Рис. 2. Метод функционализации арилиодоксолов
На данный момент проведены реакции функционализации с продуктами [c] и [b]. Реакция с продуктом [b] не прошла, возможно из-за стерических эффектов, а с продуктом [c] реакция проведена успешно.
147

Секция 4. Химические и биотехнологии.
В дальнейшем планируется функционализация и этерификация всех полученных арилиодоксолов.
Список литературы
1.Ishihara K., Uyanik M. Chem.Commun., 2009, 2086-209
2.Zhdankin V.V. J. Org. Chem., 2010, 3170-3201
3.Zhdankin V.V., Stang P.J. Chem. Rev., 2008, (108), 5327-5335
4.Zhdankin V.V., Stang P.J. Chem. Rev., 2002, (102), 2523–2584
ТЕХНОЛОГИЧЕСКИЕ УСЛОВИЯ БИОЛОГИЧЕСКОГО ВЫЩЕЛАЧИВАНИЯ ЦИНКА ИЗ ОТХОДОВ СИБАЙСКОГО ФИЛИАЛА УЧАЛИНСКОГО ГОРНО-ОБОГАТИТЕЛЬНОГО КОМБИНАТА
Д.В. Четверикова, м.н.с., С.П. Четвериков, д.б.н., с.н.с., М.Д. Бакаева, к.б.н., с.н.с. Институт биологии УНЦ РАН, 450054, г. Уфа, пр.Октября,69,
тел. (347)235-57-83
E-mail:biolab316@yandex.ru
Истощение запасов богатых металлами руд Урала является серьезной проблемой, которую можно решить с использованием некондиционных руд и отходов флотационного обогащения, в огромных количествах накопленных в отвалах и карьерах на территории горно-обогатительных комбинатов (ГОК). В некоторых из них концентрация цинка достигает величин, характерных для бедных руд. Из отвалов с отходами обогащения медь, цинк, железо и другие металлы проникают в окружающие экосистемы вместе с пылью и высоко минерализованными водами [1, 2]. Большой подвижностью в почве отличаются соединения цинка. Поэтому разработка технологий вторичного использования отходов обогащения, позволяющих снизить в них концентрацию металлов, является актуальной проблемой экологической биотехнологии [3-5].
Целью работы был подбор оптимального режима биологического выщелачивания отходов флотационного обогащения сульфидных медно-цинковых руд в перколяционных колонках.
В качестве субстрата для выщелачивания служили образцы отработанных медно-цинковых руд из хвостов флотационного обогащения Сибайского филиала Учалинского ГОК имеющие в своем составе: 79% пирротина и пирита, 20% кварца, 1% халькопирита, сфалерита – следы. Средний размер частиц составлял 12 - 100 мм. Для биологического выщелачивания отходов использовали бинарную культуру ацидофильных литоавтотрофных микроорганизмов, включающую в себя представителей родов Acidithiobacillus и Ferroplasma и поддерживаемые в коллекции микроорганизмов Института биологии УНЦ РАН.
Лабораторная перколяционная установка представляла собой набор колонок, в которые помещалась отработанная руда (по 5 кг в каждую). Через них пассивно фильтровался выщелачивающий раствор, содержавший (мг/л): (NH4)2SO4 – 132, (MgCl2)×6H2O – 53, CaCl2×2H2O – 147, KH2PO4 – 27. Опыты на перколяционной установке были поставлены в двух режимах: «затопления», когда скорость подачи раствора обеспечивала постоянное нахождение руды под слоем жидкости, и
148
