
- •Введение
- •1 Коллекторские свойства горных пород
- •1.1 Типы пород–коллекторов
- •1.2 Залегание нефти, газа и воды
- •1.3 Гранулометрический состав горных пород
- •1.4 Пористость
- •1.4.1 Виды пористости
- •1.4.2 Структура порового пространства
- •1.5 Проницаемость
- •1.5.1 Линейная фильтрация нефти и газа в пористой среде
- •1.5.2 Радиальная фильтрация нефти и газа в пористой среде
- •1.5.3 Классификация проницаемых пород
- •1.5.4 Оценка проницаемости пласта, состоящего из нескольких продуктивных пропластков различной проницаемости
- •1.5.5 Зависимость проницаемости от пористости
- •1.5.6 Виды проницаемости
- •1.6 Насыщенность коллекторов
- •1.7 Зависимость проницаемости от насыщенности коллекторов
- •1.8 Удельная поверхность
- •1.9 Коллекторские свойства трещиноватых пород
- •1.10 Карбонатность горных пород
- •1.11 Набухаемость пластовых глин
- •1.12 Механические свойства горных пород
- •1.13 Тепловые свойства горных пород
- •2 Состав и физико-химические свойства природных газов и нефти
- •2.1 Состав и физико-химические свойства природных газов
- •2.1.1 Состав природных газов
- •2.1.2 Способы выражения состава
- •2.1.3 Аддитивный подход расчета физико-химических свойств
- •2.1.4 Уравнение состояния
- •2.1.5 Уравнение состояния реальных газов
- •2.1.6 Вязкость газов
- •2.1.7 Растворимость газов в нефти и воде
- •2.1.8 Упругость насыщенных паров
- •2.2 Состав и физико-химические свойства нефти
- •2.2.1 Состав нефти
- •2.2.2 Физико–химические свойства нефти
- •2.2.2.1 Плотность нефти
- •2.2.2.2 Вязкость нефти
- •2.2.2.3 Реологические свойства нефти
- •2.2.2.4 Газосодержание нефти
- •2.2.2.5 Давление насыщения нефти газом
- •2.2.2.6 Сжимаемость нефти
- •2.2.2.7 Объёмный коэффициент нефти
- •2.2.2.8 Тепловые свойства нефти
- •2.2.2.9 Электрические свойства нефти
- •2.3 Различие свойств нефти в пределах нефтеносной залежи
- •3 Фазовые состояния углеводородных систем
- •3.1 Схема фазовых превращений однокомпонентных систем
- •3.2 Схема фазовых превращений двух – и многокомпонентных
- •3.4 Краткая характеристика газогидратных залежей
- •3.6 Фазовые переходы в воде, нефти и газе
- •4 Состав и физико-химические свойства пластовых вод
- •4.1 Химические свойства пластовых вод
- •4.1.1 Минерализация пластовой воды
- •4.1.2 Тип пластовой воды
- •4.1.3 Жесткость пластовых вод
- •4.1.4 Показатель концентрации водородных ионов
- •4.2 Физические свойства пластовых вод
- •4.2.1 Плотность
- •4.2.2 Вязкость
- •4.2.3 Сжимаемость
- •4.2.4 Объёмный коэффициент
- •4.2.5 Тепловые свойства
- •4.2.6 Электропроводность
- •4.3 Характеристика переходных зон
- •5.1 Роль поверхностных явлений при фильтрации в пористой среде
- •5.2 Поверхностное натяжение
- •5.3 Смачивание и краевой угол
- •5.4 Работа адгезии и когезии, теплота смачивания
- •5.5 Кинетический гистерезис смачивания
- •5.6 Свойства поверхностных слоев пластовых жидкостей
- •6 Физические основы вытеснения нефти водой и газом из пористых сред
- •6.1 Источники пластовой энергии
- •6.2 Силы, действующие в залежи
- •6.3 Поверхностные явления при фильтрации пластовых жидкостей и причины нарушения закона Дарси
- •6.4 Общая схема вытеснения из пласта нефти водой и газом
- •6.5 Нефтеотдача пластов при различных условиях дренирования залежи
- •6.6 Роль капиллярных процессов при вытеснении нефти водой из пористых сред
- •6.7 Зависимость нефтеотдачи от скорости вытеснения нефти водой
- •7. 1 Методы увеличения извлекаемых запасов нефти
- •7.2 Моющие и нефтевытесняющие свойства вод
- •7.3 Обработка воды поверхностно-активными веществами
- •7.4 Применение углекислого газа для увеличения нефтеотдачи
- •7.5 Вытеснение нефти из пласта растворами полимеров
- •7.6 Щелочное и термощелочное заводнение
- •7.7 Мицеллярные растворы
- •7.8 Термические методы повышения нефтеотдачи пластов
- •7.9 Извлечение нефти газом высокого давления
- •Список литературы
- •Содержание
- •Физика пласта
3.2 Схема фазовых превращений двух – и многокомпонентных
систем
Значительно сложнее закономерности фазовых переходов двух- и многокомпонентных систем. С появлением в системе двух и более компонентов в закономерностях фазовых изменений возникают особенности, отличающие их от поведения однокомпонентного газа.
В смеси углеводородов каждый компонент имеет собственные значения упругости насыщенных паров, поэтому процессы конденсации и испарения не будут проходить при конкретных значениях давления и температуры, а в определённом диапазоне значений давления и температуры. Границы диапазона будут тем больше, чем больше разница между критическими значениями давления и температуры индивидуальных компонентов, входящих в систему.
Изотермическое сжатие системы будет приводить к конденсации сначала более тяжелого компонента, затем более легкого. В результате изотермы в двухфазной области имеют наклон (рис. 3.3, а). С появлением в системе второго компонента большие различия появляются и в диаграммах "давление – температура" (рис. 3.3, б).
а б
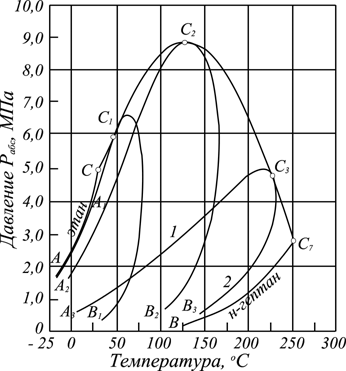
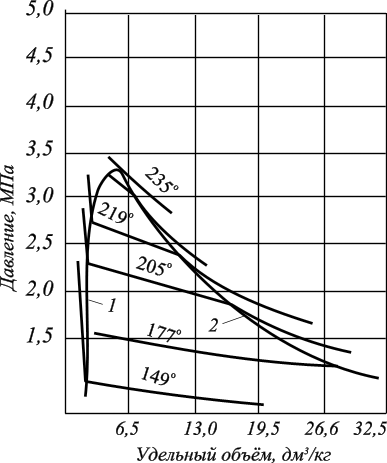
Рисунок 3.3 – Диаграммы фазового состояния бинарных систем: а – зависимость "давление – удельный объём" для смеси н-С5Н12 – н-С7Н16; б – диаграмма "давление-температура" для смеси C2Н6 – н-С7Н16
С появлением в системе двух и более компонентов в закономерностях фазовых изменений возникают особенности, отличающие их от поведения однокомпонентного газа. В качестве примера на рисунке 3.3 приведена зависимость «объем— давление» для смеси пентана и гептана с массовой концентрацией последнего 52,4%.
Аналогично диаграмме на рисунке 3.1 для однокомпонентного газа зона вправо от пунктирной линии (кривой точек конденсации) также является областью чистого газа. В этой области изотермы двух- и многокомпонентных систем аналогичны изотермам чистых компонентов. Влево от кривой точек парообразования изотермы жидкой фазы круто возрастают с уменьшением объема и они также аналогичны изотермам области жидкости чистых компонентов. В двухфазной же области двух- и многокомпонентных систем имеются значительные изменения. Было показано (рис 3.1), что в области двухфазного состояния чистых углеводородов изотермы характеризуются горизонтальными линиями, т. е. давление не изменялось до полной конденсации газа. Для двух -и многокомпонентных систем, как это следует из рисунка 3.3, а, давление в процессе сжатия в двухфазной области, не остается постоянным и для конденсации газа необходимо повышать давление для полного превращения газовой фазы в жидкость. Поэтому давление точки парообразования (кипения) для двух- и многокомпонентной смеси выше давления точек конденсации. В соответствии с этим не одинаков и состав жидкой и газовой фаз в точках парообразования и конденсации. Вскоре после начала конденсации газа состав последнего еще близок к составу всей системы. Точно так же вблизи точки парообразования состав жидкой фазы близок к составу исходной смеси. В двухфазной же области состав жидкой и газовой фаз отличен от состава исходной смеси и он непрерывно изменяется в соответствии с давлением и объемом системы.
Бинарные и многокомпонентные системы также имеют свои особенности и в области, лежащей вблизи критических давлений и температур. Критическая точка чистых веществ (или однокомпонентных систем) характеризуется самыми высокими давлениями и температурой, выше которых невозможно одновременное существование двух фаз — жидкой и газообразной. В бинарных и многокомпонентных системах критическая точка характеризуется лишь одинаковыми интенсивными свойствами газовых и жидких фаз. При этом в зоне пересечения кривых точек конденсации и парообразования образуется область, в которой могут существовать две фазы даже при температурах и давлениях, превышающих критические значения.
С появлением в системе второго компонента большие различия появляются также в диаграммах «давление — температура». Кривые точек начала кипения и точек росы не совпадают и образуют фазовую диаграмму, вид которой определяется, кроме температуры и давления, исходным составом смеси . Крайние левая и правая кривые на диаграмме (рис 3.3 , б) соответствуют давлениям насыщенного пара для чистых компонентов — этана и н-гептана с критическими точками С и С7. Между ними расположены фазовые диаграммы смесей этана с н-гептаном, с массовой концентрацией этана 90,22, 50,25 и 9,8% с соответствующими критическими точками С1, С2 и Сз. Пунктирная линия представляет собой огибающую критических точек системы этан - н-гептан. Линии А1С1, А2С2 и АзСз представляют собой линии точек начала кипения рассматриваемых смесей. Выше и слева от них смесь находится в жидком состоянии, В1С1, В2С2 и ВзСз — линии точек росы соответствующих смесей. Ниже и справа от них смесь находится в газообразном состоянии. Между линиями точек начала кипения и точек росы располагается двухфазная область. Из рисунка 3.3, б видно, что с ростом содержания н-гептана в системе критическая точка, располагающаяся слева от максимальных значений давления и температуры, при которых две фазы могут существовать в равновесии, сдвигается вправо от нее. А кривые точек росы и начала кипения при этом приближаются к кривой давлений насыщенного пара, преобладающего в смеси компонента — н~ гептана. Аналогично изменяются также критические температура и давление при изменении состава смеси.
Величина критических температур различных смесей находится между критическими температурами компонентов, а критическое давление смеси всегда выше, чем критическое давление любого компонента.
Как видно из рисунка 3.3, б размеры двухфазной области также зависят от состава смеси — они возрастают по мере того, как в составе смеси распределение между компонентами становится более равномерным.
Естественные углеводородные системы (нефтегазовые смеси в особенности) отличаются большим разнообразием состава. Поэтому фазовые диаграммы нефтегазовых смесей, сохраняя принципиальные черты фазовых переходов двухкомпонентных систем, обладают еще своими в основном количественными особенностями, определяющимися составом нефти и газов. Особо большой интерес для промысловой практики представляет поведение многокомпонентных систем в критической области.
Крайние левая и правая кривые соответствуют давлениям насыщенных паров для легкого (слева) и более тяжелого компонента (справа). Между ними расположены фазовые диаграммы смесей.
Для многокомпонентных систем, в силу их неидеальности, возможны существование двух фаз при температурах или давлениях выше критических величин. Явления существования двух фаз при изотермическом или изобарическом расширении (сжатии) смеси в области выше критических температур и давлений называются ретроградными явлениями или процессами обратного испарения и конденсации. Изотермические ретроградные явления происходят только при температурах выше критической и ниже максимальной двухфазной температуры. Изобарические процессы испарения и конденсации наблюдаются между критическим и максимальным двухфазным давлением. Такие явления характерны, в основном, для газоконденсатных месторождений, имеющих высокие пластовые температуры и давления.
Поведение бинарных и многокомпонентных систем
в критической области
Типовые изотермы многокомпонентных углеводородных смесей вблизи критической области показаны на рисунке 3.4. Сплошной линией нанесена кривая точек парообразования, пунктирной — точек конденсации. Как уже упоминалось, основной признак критической точки — одинаковые свойства газовой и жидкой фаз, т. е. она находится в точке пересечения кривых начала конденсации и парообразования — в точке С.
Из рисунка 3.4 следует, что в критической точке давление и температура не наибольшие, при которых еще возможно одновременное существование обеих фаз. Действительно, при давлении, несколько меньшем p/, но большем, чем критическое давление pc в системе появляется газовая фаза, находящаяся в равновесии с жидкой. Это относится ко всей области АВСА. Точно так же в области CNBC существуют одновременно две фазы, несмотря на то, что при этом температура в системе выше критической температуры Тс.
В области выше критической с изменением температуры и давления в многокомпонентной системе происходят необычные фазовые превращения. Чтобы убедиться в этом, рассмотрим изобарное расширение насыщенной газом жидкости по линии ЕF вследствие повышения температуры от Т1 до ТЗ. В точке Е при увеличении температуры жидкость закипает. По мере увеличения температуры вначале объем газовой фазы увеличивается, Однако при дальнейшем повышении температуры объем газовой фазы, достигнув максимума, очевидно, вновь начинает уменьшаться., так как в точке Р, так же как и в точке Е, лежащей на кривой начала парообразования, содержание паровой фазы в системе равно нулю. В однокомпонентной же системе, а также в многокомпонентных смесях с низкой температурой при изобарическом расширении с ростом температуры количество газовой фазы непрерывно растет, пока вся жидкость не превратится в пар.
Необычные процессы испарения и конденсации возможны также и при температурах выше критических – в области CNBC. Например ,при изотермическом расширении от точки Н до М, лежащих на линии точек конденсации, система проходит двухфазную область. Причем количество конденсата вначале увеличивается и, достигнув максимума, жидкая фаза в точке М вновь исчезает. Аналогичные явления в области выше критических Ркр и Ткр наблюдаются не только при изотермическом или изобарном расширении и сжатии смеси, но также и при осуществлении процесса по любой другой кривой
Рассмотренные необычные процессы фазовых превращений двух- и многокомпонентных систем в области выше критической называются процессами обратного или ретроградного испарения и конденсации.
Фазовая диаграмма, приведенная на рисунке 3.4, типична для многих систем, однако условия возникновения ретроградных явлений и вид рVT -диаграмм (V — удельный объем, р — давление и Т — абсолютная температура) в области критических точек могут быть в зависимости от состава углеводородных смесей другими. Так, например, на рисунке 3.5 показаны фазовые диаграммы в координатах Р — Т (давление — температура) с другими условиями возникновения ретроградных явлений, где нанесены лишь кривые точек конденсации 2 и кривые точек парообразования , ограничивающие двухфазную область. Диаграмма рисунка 3.5, а аналогична зависимости Р — V, приведенной на рисунке 3.4. Здесь в области ВСN возникают процессы обратной изотермической конденсации, а в области АСD — процессы обратного изобарического испарения.
Если критическая область характеризуется диаграммой (рис.3.5, б), где критическая точка С существует при давлении и температуре ниже максимальных р1 и T лежащих на кривой парообразования, то изотермическое обратное испарение происходит в области CBN ,а изобарное ретроградное испарение — в области ACND.
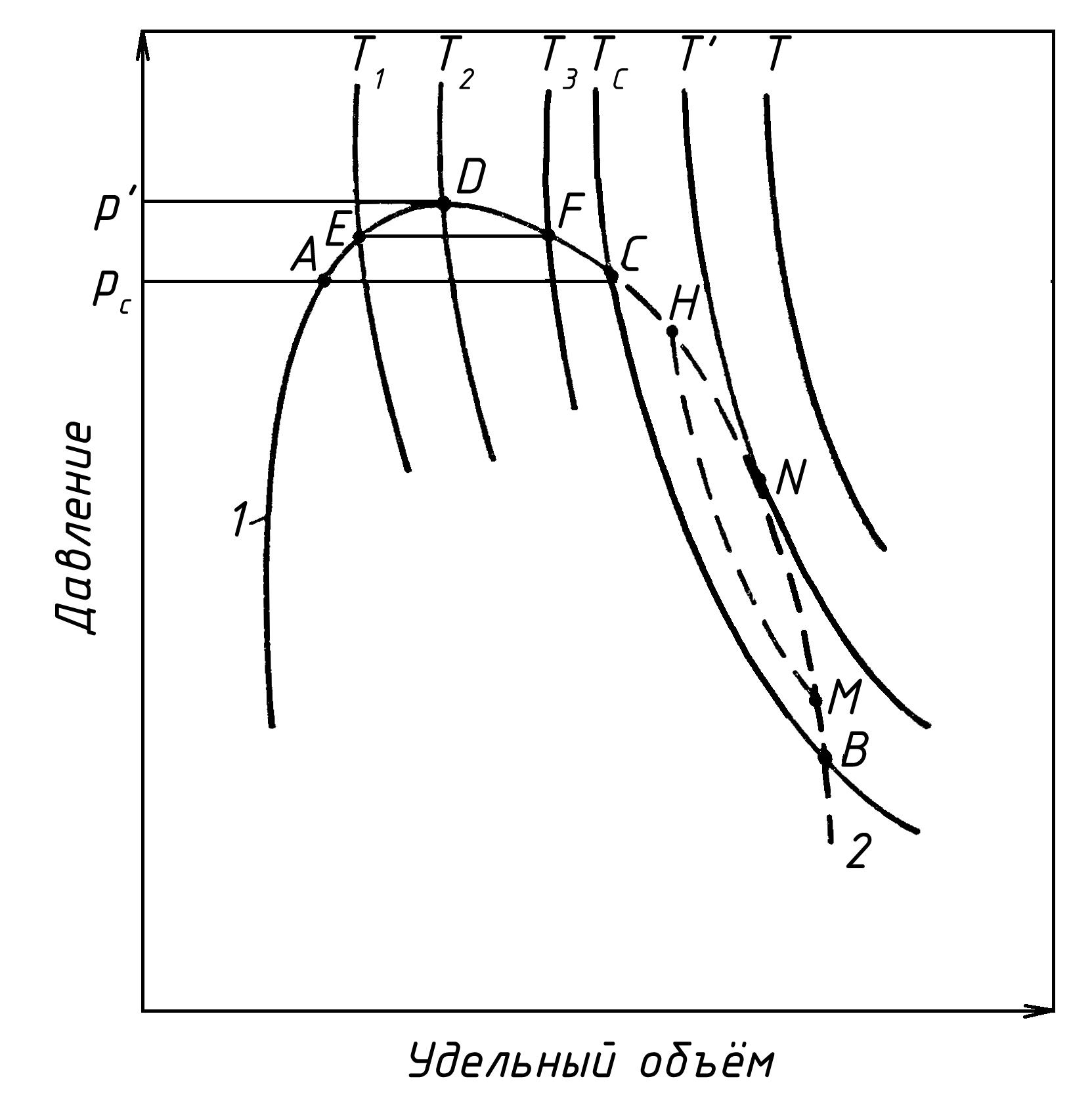
Рисунок 3.4 – Типовые изотермы многокомпонентных углеводородных смесей вблизи критической области: 1 – кривая точек парообразования; 2 – кривая точек конденсации.
Обычно критическая
точка находится справа от максимального
давления,
при
котором могут одновременно сосуществовать
жидкая и газовая фазы,
когда в углеводородной
смеси массовая концентрация гептана
и более
тяжелых
фракций
высокая, а метана низкая.
Ретроградные
явления характеризуются диаграммой
вида (рис.3.5, в),
когда
максимальное давление р' находится на
кривой точек конденсации, а критическое
давление — между р'
и
Т(
Изотермическая
ретроградная конденсация возникает
тогда по любой вертикальной линии в
области ВСОК
В
области САD
могут
происходить явления обратной изобарной
конденсации. Такие диаграммы
характерны для жирных и конденсатных
газов.
Из
рисунков 3.4 и 3.5 следует, что
изотермические ретроградные явления
происходят только при температурах
выше критической и ниже максимальной
двухфазной температуры.
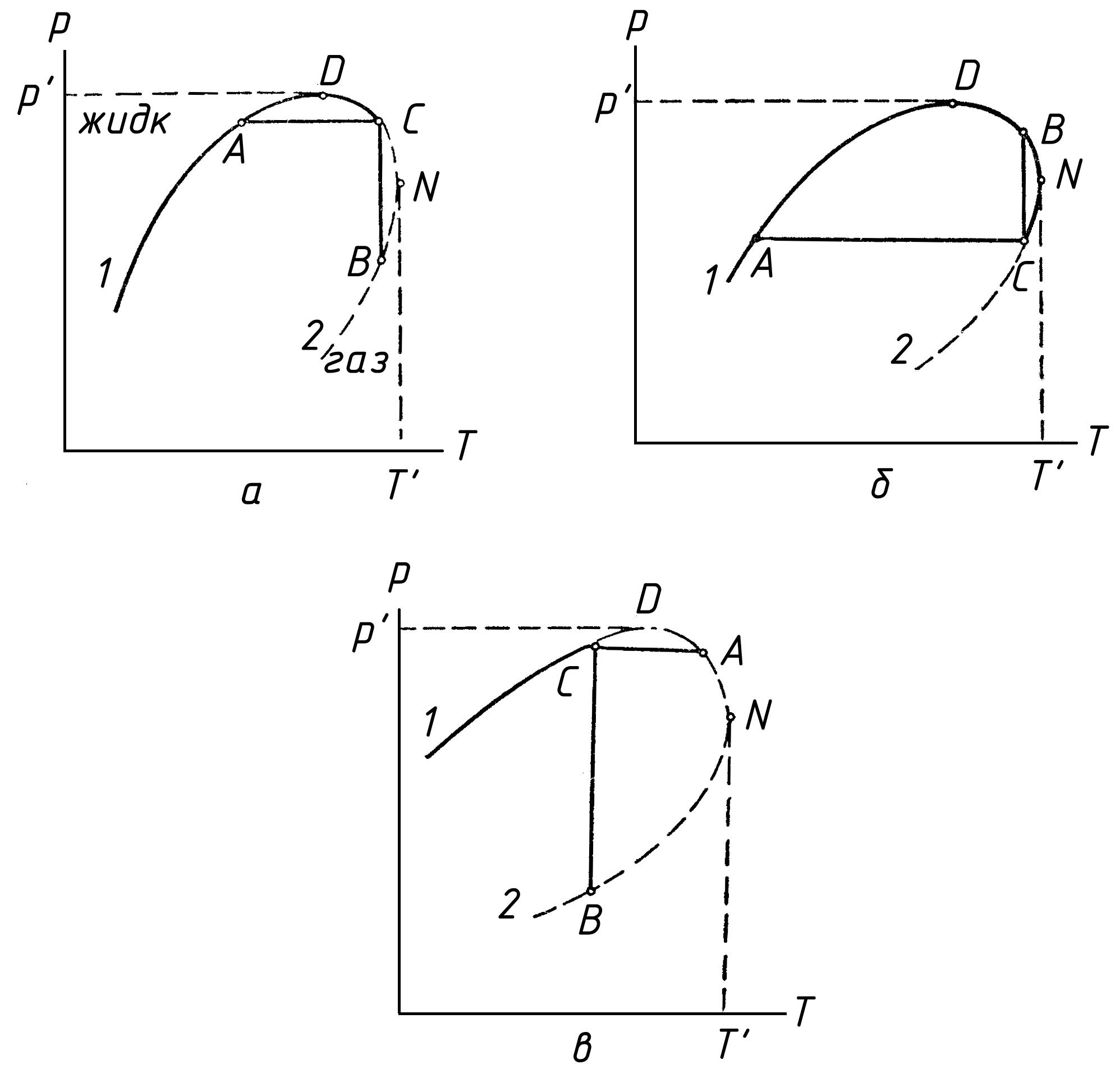
Рисунок 3.5 – Различные виды фазовых диаграмм, 1 — кривая точек парообразования; 2 — кривая точек конденсации.
Изобарные процессы испарения и конденсации наблюдаются между критическим и максимальным двухфазным давлением.
Степень насыщения газоконденсатной залежи высококипящими углеводородами (конденсатом) определяется величиной газоконденсатного фактора. По аналогии с газовым фактором (Го) для нефтяных месторождений понятие газоконденсатный фактор (Го) применяется для конденсатных залежей. Газоконденсатный фактор представляет собой отношение количества (дебита) газа в м3 к количеству стабильного конденсата в м3. Величина, обратная газоконденсатному фактору, называется выходом конденсата.
Нефть и конденсат полученные, непосредственно, на промысле при данных температурах и давлениях, называются сырыми. Нефть и конденсат, прошедшие процессы дегазации (сепарации), стабилизации при стандартных условиях называются стабильными.
