
Карцев В.Г. - Избранные методы синтеза и модификации гетероциклов. Том 2 (2003)(ru)
.pdf
S |
|
O |
24 |
|
|
||
N |
|
OEt |
|
H |
|
|
|
|
27 |
|
|
|
H |
O O |
|
|
N |
24 |
|
|
N |
|
OEt |
|
H |
|
|
|
29 |
|
|
R' |
S |
O |
24 |
|
|
||
R'' |
N |
|
OR |
R"' |
H |
|
|
|
|
|
|
31 |
|
|
|
Схема 8
O OEt
S
N OEt
O |
O |
|
28 |
|
|
H |
O O |
|
N |
|
|
N |
|
OEt |
O |
|
|
O |
OEt |
|
30 |
|
|
R' |
S |
O |
|
|
|
R'' |
N |
OR |
R"'O |
|
|
32 |
O |
OEt |
|
|
|
R = Me, Et; R' = H, Cl, Me, OMe; R" = H, Me; R"' = H, Cl |
|
|
|
|
|||||||
Для получения снотворных препаратов реакцией эфира 33 с АОЭ 34 полу- |
||||||||||||
чают конденсированный пиридин 35 [20] (схема 9). |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
Схема 9 |
|||
MeO |
|
|
O |
MeO |
|
|
|
|
||||
|
+ |
O |
|
|
|
|
||||||
|
|
|
|
|
|
|
||||||
|
NH |
|
|
|
|
|
N |
O |
||||
|
|
|
|
|
|
|||||||
MeO |
N Ph |
MeO |
||||||||||
|
EtO |
|
|
|
|
|||||||
|
O |
|
|
|
|
|
O |
|
NH |
|||
|
|
|
|
|
|
|
|
|
||||
|
OEt |
|
|
|
|
|
OEt |
|
|
|
Bz |
|
|
|
|
|
|
|
|
|
|||||
|
33 |
|
34 |
|
|
|
35 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Избранные методы синтеза и модификации гетероциклов, том 2 |
|
131 |
||||||||||
Представленные на схеме 10 реакции АОЭ 24, 36, 41 с цианотиоацетамидом 37, включающим фрагмент C-C-N [22–34], протекают в присутствии основания с образованием продуктов SNVin, которые иногда могут быть выделены, как, например, бутадиен 38. Однако чаще всего в условиях реакции они циклизуются в 4-незамещенные пиридины 39, 40, 42, являющиеся потенциальными кардиотониками.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Схема 10 |
OEt |
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
||||||
|
|
|
|
|
|
R |
|
|
CN |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
NC |
|
|
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CN |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
||||||||||
+ |
|
|
|
|
|
B |
|
+ |
|
|
|
CN |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
NH2 |
[22−25] |
|
|
|
|
|
|
|
|
|
|
|
|
|
N S− |
|||||||||||||
O R |
|
|
|
BH |
|
|
|
|
|
|
|
|
|
|
|
|
H2N |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
CN |
|
|
|
|
|
|
|
|
− |
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
H2N |
|
|
S |
|
|
|
|
|
|
|
|
|
|
|
+ |
|||||||||
36 |
|
37 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
39 |
BH |
||||||||
|
|
|
|
|
|
38 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
R = OEt, NHPh |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
24 + 37 |
|
B |
|
|
|
EtO |
|
|
|
|
|
|
|
|
|
CN |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
[26] |
|
|
|
|
|
|
O |
|
|
N |
|
|
− |
+ |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S |
BH |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
40 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
O |
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CN |
|
|
||||||
37 + |
|
F3C |
|
R |
|
|
|
B |
|
|
|
|
|
|
R |
|
|
|
|
|
+ |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
− |
|
|||||||||||||||
|
|
|
[27−30] |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
EtO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
F3C |
|
|
|
N S |
BH |
|
|||||
|
|
41 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
42 |
|
|
|
|
|||||||
R = тиен-2-ил, Ph; B = N-метилморфолин
Синтезы с участием фрагмента С-С-N, источником которого являются ароматические амины 43 (схема 11), протекают по реакции Гоулда–Джекобса [35–53]. Образующиеся в результате SNVin интермедиаты 45, 48, 50, 53 далее подвергаются циклизации в различных условиях (кипячение в Ph2CH, t-BuPh, Ph2O, смеси дифениловый эфир-бифенил; термическая циклизация в даутерме, обработка EtONa в спирте, ПФК) с образованием конденсированных пиридинов 46, 49, 51, 54. На основе алкоксиметиленмалонового эфира 44 получают конденсированные 3-алкоксикарбонил-4-оксо(окси)пиридины 46 [35–47], метоксиметиленпроизводноекислотыМельдрума47 дает конденсированные 4-пиридоны-4 49 [48], ЭММН – конденсированные 4-амино-3-цианопиридины 51 [49–51], а этиловый эфир этоксиметиленциануксусной кислоты (ЭМЦА) – конденсированные 4-гидрокси- 3-цианопиридины 54 [51]. Пиридины 46 обладают широким спектром биологической активности – антимикробной, антималярийной, анксиолитической, анти-
132 |
Серия научных монографий InterBioScreen |
конвульсивной, седативной, гипотонической, а фуропиридин 46a использован [42] в синтезе ключевого интермедиата ингибитора ВИЧ-протеазы, L-754394. Пиридины 51 проявили противомикробную активность.
|
|
|
|
|
|
|
|
|
|
|
Схема 11 |
|
|
|
|
|
AlkO |
|
|
|
|
O |
|
|
NH + |
AlkO |
OAlk |
|
|
N |
|
OAlk |
|||
|
|
O |
O |
|
|
H |
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
2 |
|
|
|
|
|
O OAlk |
|||
|
43 |
|
|
|
44 |
|
|
|
|
45 |
|
|
|
|
|
|
O |
O |
|
|
|
OH |
O |
|
|
|
|
|
|
OAlk |
O |
|
|
OEt |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
N |
|
|
MeO |
O |
N |
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
46 |
|
|
|
|
46a |
|
|
OMe O |
|
|
|
|
|
|
|
|||
|
|
|
|
|
O |
|
|
|
|
|
O |
|
O |
|
O |
|
|
|
|
|
|
||
N |
|
N |
|
|
O |
|
N |
|
|||
|
|
|
47 |
|
|
|
|
||||
R N NH2 |
|
|
R |
N N |
|
O |
|
R N N |
|||
|
|
|
|
|
|
H |
|
|
|
|
H |
|
43a |
|
R = Ar, Het |
48 |
O |
O |
|
|
49 |
||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
NH2 |
|
|
|
|
|
21 |
|
|
CN |
|
|
CN |
|
|
|
|
|
N |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
NH2 |
|
|
H |
|
CN |
|
|
N |
||
|
43 |
|
|
|
|
50 |
|
|
|
|
51 |
|
|
|
NC |
OEt |
|
|
O |
|
|
|
|
|
H2N |
|
|
O |
H |
|
|
OH |
|||
O |
|
|
O |
OEt |
|
OEt |
|
|
|||
Ph |
|
|
|
|
|
|
CN |
||||
|
N |
|
|
|
52 |
|
N |
CN |
|
N |
|
|
N |
|
|
|
|
N N |
|
|
|||
H |
|
|
|
|
H |
|
|
N |
N |
||
|
43b |
|
|
|
|
Ph |
53 |
|
|
Ph |
54 |
|
|
|
|
|
|
|
|
|
|||
Избранные методы синтеза и модификации гетероциклов, том 2 |
133 |
||||||||||
Подробно изучено получение на основе реакции Гоулда–Джекобса различных производных кумарина. Первый этап реакции – взаимодействие различных моноили диаминокумаринов с ЭММЭ, приводящее к соответствующим продуктам SNVin 55. Нагревание последних в даутерме А приводит к ожидаемым эфирам 56–60 и диэфиру 61 [52]. Эфир 60 показал высокую антимикробную активность
(схема 12).
Схема 12
R1
|
|
|
HN |
|
|
|
CO2Et |
O |
O |
|
O |
57 |
|
|
|
|
|
R1 |
|
|
|
NH |
R = A; |
|
|
|
|
||
|
O |
O |
R4 |
= F |
|
|
|
||
F |
56 |
|
|
|
CO2Et |
|
R = R2 = A |
|
|
|
O |
|
|
|
HN |
|
H |
|
|
|
N |
|
|
|
O |
O |
O |
CO2Et |
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
EtO2C |
O |
|
61 |
|
|
|
A = NHCH=C(CO2Et)2
CO2Et |
|
|
O |
|
O |
|
|
|
|
|
|
O |
EtO2C |
|
O |
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
H 58 |
|
|
= A |
|
|
R = H, OH; |
|
|
|
|
|
|
||
|
|
|
R2 = A |
|
|
R2 |
|
R1 |
|
|
|
|
|
R |
|
|
|
R3 |
R4 |
O |
O |
|
|
|
55 |
|
|
|
|
R = OH; |
|
R1 = Me, CF3; |
|
||
|
R3 = A |
|
|
||
R4 = A |
|
|
|
||
|
|
|
|
||
O |
|
|
HN |
CO2Et |
|
|
OH |
|
|
||
O |
|
|
O |
|
|
|
|
|
|
||
|
|
O |
|
|
|
|
|
O |
R2 |
|
|
60 |
|
|
59 |
|
|
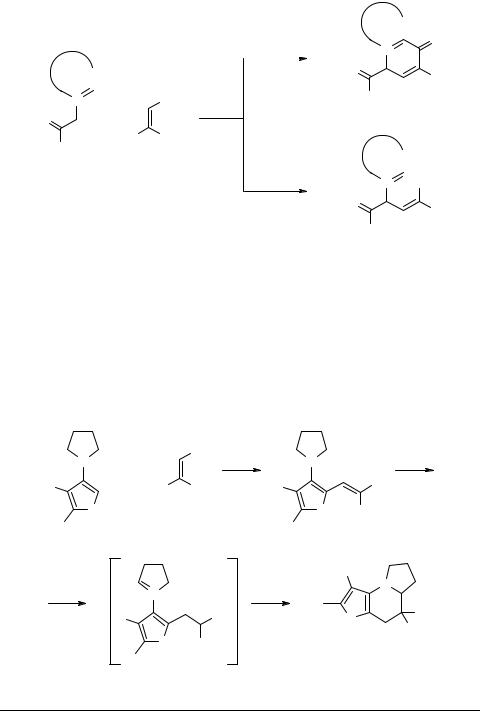
Синтезы, основанные на сочетании фрагментов С-N-С и С-С-С, представлены реакциями диазолий- и триазолийилидов или их предшественников (фрагмент С-N-C) с АОЭ (фрагмент С-С-С). Так, взаимодействие солей 62 с поляризованными олефинами 24, 63 в присутствии К2СО3 приводит к продуктам так называемой обращенной 1,6-циклизации – мезомерным бетаинам 64. Реакция же с ЭМЦА и ЭММН завершается на стадии продуктов SNVin 65, и попытки получить соответствующие бетаины были неудачными [54–57] (схема 13).
134 |
Серия научных монографий InterBioScreen |
|
|
|
|
|
|
|
|
|
Схема 13 |
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
+ |
|
O |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
N |
|
|
|
N |
|
24, 63 |
O |
− |
|
X |
||
|
|
|
|
||||||
|
+ |
|
OEt |
|
|
|
OEt |
|
|
|
|
|
|
|
|
|
|||
|
N |
K2CO3 |
|
64 |
|||||
O |
Br− |
+ |
|
|
|||||
|
|
|
|
||||||
CHCl3 |
|
|
|
|
|||||
|
|
|
Y X |
|
|
|
|
||
|
OEt |
EtOH |
|
|
N |
||||
|
21, 24, |
|
|
||||||
|
62 |
|
|
|
|
|
|||
|
|
|
|
|
+ |
|
|
||
|
|
|
52, 63 |
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
CN |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
21, 52 |
O |
− |
|
X |
|
|
24, 63 X = CO2Et, NO2; Y = CO2Et; |
|
|
|
|||||
|
|
|
|
|
|||||
21, 52 X = CO2Et, CN; Y = CN |
OEt |
|
65 |
||
|
Реакция на основе сочетания фрагментов С-N-С-С и С-С (схема 14) представляет собой удобный путь синтеза производных тиено[3,2-e]индолизина, тиено[2,3-c]хинолизина и их бензотиеноаналогов 70. Реакция SNVin аминотиофенов 66 с метоксиметиленмалононитрилом 67 дает тенилиденмалононитрилы 68, которые при кипячении в 1-бутаноле циклизуются в продукты 70. Циклизация происходит через 1,5-гидридную миграцию с последующим внутримолекулярным присоединением карбаниона к двойной связи имина в интермедиате 69 [58].
|
|
|
|
|
|
Схема 14 |
( |
)n |
|
OMe |
( )n |
|
|
N |
|
|
N |
|
|
|
+ |
|
|
|
|
||
R |
NC |
CN |
R |
CN |
|
|
|
|
|||||
S |
|
|
|
S |
CN |
|
R' 66 |
|
67 |
|
R' 68 |
|
|
|
|
( )n |
|
R |
|
( )n |
|
|
+ |
|
|
N |
|
|
|
N |
|
R' |
|
|
|
R |
|
− CN |
|
CN |
|
|
|
S |
|
|||
|
|
S |
CN |
|
|
CN |
|
R' |
|
|
|
||
|
69 |
|
|
70 |
|
|
|
|
|
|
|
||
|
R, R' = H, Me, Ph; R+R' = CH=CHCH=CH; n = 1, 2 |
|
|
|||
Избранные методы синтеза и модификации гетероциклов, том 2 |
135 |
|||||

В определенных условиях АОЭ могут выступать в роли источника одного атома углерода. Такая возможность реализуется при взаимодействии эфиров триптофана 71 с ЭММЭ в присутствии триэтиламина, дающем продукт SNVin 72, обработкой которого TsOH в MeCN с последующим действием Et3N и AcOH в MeOH получают потенциально биологически активный карболин 73 [59] (схема 15).
|
|
|
|
|
|
Схема 15 |
|
O OR |
O |
OR |
O |
|
|
|
|
|
|
|
|
|
|
NH2 |
|
N |
OEt |
|
O |
|
24 |
|
H |
|
|
OR |
|
|
O |
OEt |
|
||
|
|
|
|
N |
||
|
N |
N |
|
|
N |
|
|
|
|
|
|||
|
H |
H |
|
|
H |
|
71 |
R = Me, Et |
72 |
|
|
73 |
|
|
|
|
|
|
|
В синтезе пиридинов источником гетероатома может выступать цианогруппа. Так, взаимодействием малононитрила 74 с триэтилортоформиатом получают соединение 75, содержащее цепочку из пяти атомов углерода, которое при обработке хлористым водородом в изопропиловом спирте или уксусной кислоте, по-видимому, дает имин, далее циклизующийся в 2-амино-6-хлор-3,5-дициано- пиридин 76 [60] (схема 16).
Схема 16
CN |
|
|
|
NC |
|
NC |
CN |
+ |
Py |
NC |
CN |
HCl |
|||
CN |
HC(OEt)3 |
NC |
|
|
H2N |
N Cl |
|
|
|
|
|
||||
74 |
|
|
|
|
|||
|
|
|
75 |
|
|
76 |
Реакция енамина 77 с ЭММН 21 приводит к соединению 78, которое при действии HCl превращается в соединения 79, в которых пиридиновый цикл аннелирован с дигидропирановым или тетрагидропиридиновым [61] (схема 17).
Схема 17
O |
|
O |
|
|
|
N |
21 |
N |
HCl |
X |
CN |
|
|||||
|
|
|
CN |
|
N Cl |
|
|
|
|
|
|
X |
|
X |
CN |
|
|
|
|
|
|
||
77 |
X = O, NMe |
78 |
|
|
79 |
|
|
|
|
|
136 |
Серия научных монографий InterBioScreen |

Таким образом, при всем разнообразии синтетических подходов к построению пиридинового кольца с использованием АОЭ среди них можно выделить общие черты. Начальная стадия реакции – винильное замещение алкоксигруппы на азотсодержащий (с образованием связи Сvin−N) либо метиленактивный фрагмент. В первом случае всегда образуются 2-незамещенные пиридины, во втором – в зависимости от положения метиленактивного фрагмента – 3- или 4-незамещен- ные пиридины. При использовании в качестве АОЭ алкоксиалкилиденили арилметилензамещенных СН-кислот положения 3 и 4 пиридинового ядра будут нести соответствующий (алкильный или арильный) заместитель.
2. Хинолины1
Большинство опубликованных в последнее время работ, посвященных синтезу хинолинов с помощью АОЭ, объединяет одна цель – получение биологически активных веществ. Поэтому значительное количество рассматриваемых ниже синтезов хинолинов запатентовано. Синтез многих из них поставлен на промышленную основу. Замещенные хинолины, а именно, производные эфиров 4-оксохино- лин-3-карбоновых кислот, полученные таким способом, являются полупродуктами в синтезе биологически активных веществ либо сами проявляют широчайший спектр биологической активности. Наиболее важными представляются анти-ВИЧ- RTA активность, активность против грамположительных, грамотрицательных, анаэробных и микобактерий, против патогенной микрофлоры ряда ветеринарных инфекций. Они также показали противомалярийную и противоопухолевую активность, проявили себя как ингибиторы желудочной (Н+/К+)-АТФ-азы, тирокиназы р 56lck протеина и топоизомеразы млекопитающих, в качестве радиосенсибилизаторов гипоксических клеток. Применяются рассматриваемые хинолины и для фармакокинетических и фармакодинамических исследований, как препараты антиконвульсивного и седативного действия, гипоксиселективные противораковые препараты, противобактериальные средства с пониженной фототоксичностью, бактерициды путей мочевого тракта. Их физиологически приемлемые производные применяют в виде лекарственных препаратов (таблетки, драже, капсулы, пилюли, грануляты, суппозитории, растворы, суспензии, эмульсии, пасты, мази, гели, кремы, лосьоны, пудры) в медицине и ветеринарии, а также в качестве добавок к кормам животных.
Основными методами синтеза хинолинов, использующими АОЭ, являются реакция Гоулда–Джекобса [63–130] и взаимодействие этоксиметиленпроизводных галогензамещенных ароматических кислот, содержащих метиленактивный фрагмент, с аминами [131–184].
Реакция Гоулда–Джекобса (схема 17) представляет собой взаимодействие ароматических аминов 80, 84 с АОЭ 44, 52, 85, 88 с образованием продуктов SNVin 81, 86, 89, которые, как правило, после выделения подвергают дальнейшей циклизации в замещенные хинолины 82, 83, 87, 87a. Условия циклизации различны:
1Способы получения хинолинов, описанные ниже, справедливы также для получения их азааналогов – нафтиридинов. Синтез этих соединений, включая реакции с участием АОЭ, подробно описан в обзорной работе [62].
Избранные методы синтеза и модификации гетероциклов, том 2 |
137 |
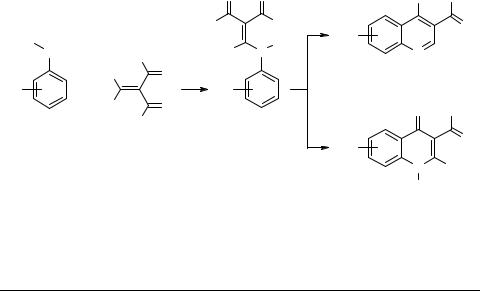
термическая – в даутерме A, в Ph2O, хлороформе, додекане, в Ac2O + H2SO4, под действием ПФК при различной температуре, а также при микроволновом облучении. Наиболее популярный в промышленности метод конденсации полупродукта – в дифенилоксиде – имеет ряд недостатков, основными из которых являются относительно невысокие чистота и выходы (как правило, не более 70%) целевого продукта, образование побочных продуктов типа арилкетонов, токсичность Ph2O, необходимость постоянной регенерации Ph2O. Обнаружено, что синтез хинолинов можно осуществлять в одну стадию, если проводить реакцию в среде парафиновых углеводородов С12–С18 при температуре конденсации 210–250°C. В результате их выход повышается до 84%, а чистота – до 96%. Таким образом, вместо дорогостоящего Ph2O можно использовать более дешевые парафиновые углеводороды, которые после отделения целевого продукта могут применяться многократно без дополнительной очистки [72].
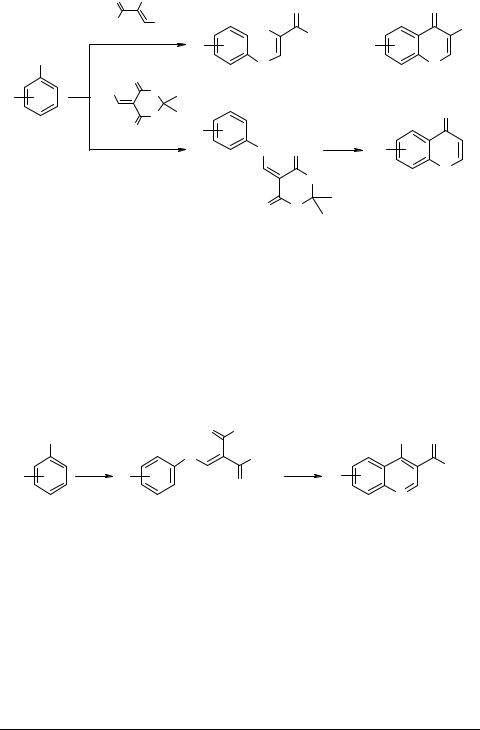
Замыкание цикла обусловлено электрофильной атакой карбонильной группы в незамещенное орто-положение к аминогруппе и при использовании алкоксиметиленпроизводных эфиров малоновой кислоты 44 приводит к 4-гидрокси(оксо)- 3-алкоксикарбонилхинолинам 82, 83 [63–110, 118, 120], а в случае алкоксиметиленпроизводных других СН-кислот 52, 85 и 88 – к соответствующим 4-оксо- 3-R-хинолинам 87 [103, 104, 111–117] и 87a [113, 118, 119] (схема 18).
Судя по литературным источникам, в данной реакции в процессе циклизации всегда принимает участие именно этоксикарбонильная группа, и образуются 4-окси(оксо)хинолины. Даже если используется АОЭ, не содержащее этоксикарбонильной группы (ЭММН и др.), то реакция останавливается на стадии продукта SNVin, и о дальнейшей циклизации не сообщалось.
Схема 18
|
|
O |
O |
OH |
OAlk |
|
|
OAlk |
OAlk |
R"n |
O |
R' NH |
|
R |
N R' |
|
|
AlkO |
N |
|
|||
|
AlkO |
O |
|
82 |
|
R"n |
+ |
R"n |
|
или |
|
|
R |
O |
|
O |
OAlk |
|
AlkO |
|
|
||
|
|
|
|
O |
|
80 |
44 |
|
81 |
R"n |
|
|
|
|
|
|
|
|
|
|
|
N |
R |
R'
83
R = H, Alk (C1−C4), Ar, ArAlk; R' = Alk (C1−C6), циклоалкил, CH=CH2, Bn, Ac, ArCH2, алкенил; R2 = H, Alk, Ar, Hal, OAlk, NHAlk; n = 1−4
138 |
Серия научных монографий InterBioScreen |
O |
X |
|
O |
O |
AlkO |
OEt |
|
||
X |
OEt |
X |
||
52, 85 |
Rn |
+ Rn |
||
NH2 |
|
N |
|
N |
EtO |
O |
H |
|
H |
O |
86 |
|
87 |
|
Rn |
O |
|
|
O |
84 |
|
|
||
O |
Rn |
|
|
|
|
88 |
NH |
O |
Rn |
|
|
|||
|
|
|
O |
N |
|
|
|
H |
|
|
|
O |
O |
87a |
|
|
89 |
|
|
X = CN, COAlk; R = H, Alk, Ar, Hal, OAlk, NHAlk; n = 1−4
Если в рассматриваемой реакции в качестве циклизующего агента используют POCl3, то образуется этиловый эфир 4-хлорхинолин-3-карбоновой кислоты 90, который далее был превращен в препараты с антиконвульсивным и седативным действием [121] (схема 19).
|
|
|
|
|
Схема 19 |
NH2 |
|
O |
OEt |
|
Cl O |
|
H |
OEt |
|
||
|
24 |
N |
POCl3 |
OEt |
|
|
|
|
|||
Rn |
|
Rn |
O |
|
Rn |
|
|
|
|
|
N |
84 |
|
81a |
|
|
90 |
R = H, Alk, Ar, Hal; n = 1−4
Полученный интермедиат перед циклизацией также может подвергаться модификации. Так, кипячением 2-гидрокси-3,4-дифторанилина 84a с ЭММЭ 24 в этаноле получают продукт SNVin 81b, взаимодействием которого с рацемическим пропиленоксидом 91 в присутствии LiClO4 и NaH и обработкой продукта реакции PPh3 и диэтилазодикарбоксилатом в этилацетате получают 1,4-бензоксазин 81c. Последний далее циклизуют в соединение 83a, а затем превращают в антибиотик широкого спектра – офлоксацин. Аналогично при использовании (R)-пропилен- оксида получают его (S)-энантиомер – левофлоксацин [122] (схема 20).
Избранные методы синтеза и модификации гетероциклов, том 2 |
139 |
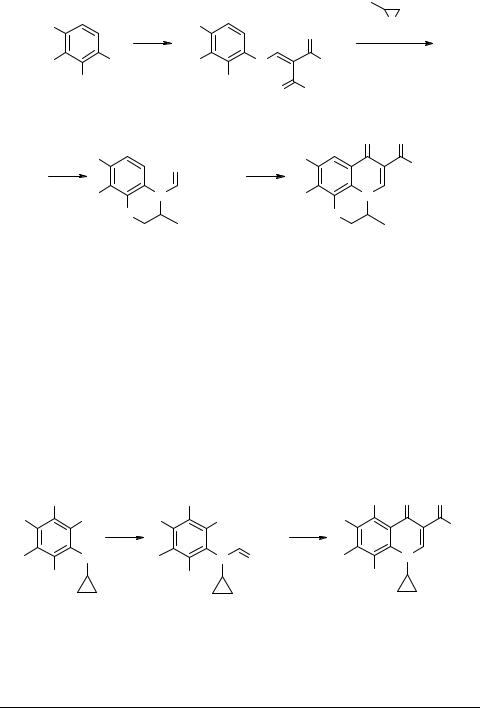
Схема 20
F |
24 |
F |
|
|
|
O |
O |
|
|
|
|
|
91 |
||
F |
NH2 |
F |
|
N |
|
OEt |
LiClO4, NaH; |
|
|
PPh3 |
|||||
OH |
|
|
OH |
H |
|
|
|
|
|
|
O |
OEt |
|
||
84a |
|
|
81b |
|
|||
|
|
|
|
|
|||
|
|
|
|
|
|
|
O O |
F |
|
C(CO2Et)2 |
|
|
F |
OEt |
|
|
|
|
|
|
|||
F |
N |
|
|
|
|
F |
N |
|
O |
|
|
|
|
O |
|
|
81c |
|
|
|
|
83a |
|
Циклизации диэфиров типа 81 в большинстве случаев региоселективны и направляются только по одному из двух орто-положений, которое не содержит заместителя, а при отсутствии заместителей в обоих орто-положениях циклизация идет преимущественно или исключительно по наименее стерически затрудненному из них.
Однако, при изменении условий циклизации может происходить замещение группы, находящейся в одном из орто-положений, причем второе, занятое или незанятое, в реакции не участвует. Так, при взаимодействии замещенного нитроанилина 80a с ЭММЭ 24 образуется полупродукт 81d, циклизацией которого в Ас2О в присутствии H2SO4 получают в качестве продукта замещения нитрогруппы хинолин 83b, обладающий значительной антимикробной активностью [124, 125] (схема 21).
|
|
|
|
|
Схема 21 |
|
R |
|
|
R |
F |
R O O |
|
F |
NO2 24 |
F |
NO2 |
OEt |
||
|
||||||
Het |
NH |
Het |
N C(COOEt)2 Het |
N |
||
R' |
|
|
R' |
|
R' |
|
80a |
|
|
81d |
|
83b |
|
R = H, Me; R' = H, Me
Модифицированный вариант данного метода предложен авторами работы [129]. Хинолины и их различные азапроизводные 95, являющиеся анксиолитиками и иммуномодуляторами, получают трехкомпонентной реакцией ароматического
140 |
Серия научных монографий InterBioScreen |
