
Карцев В.Г. - Избранные методы синтеза и модификации гетероциклов. Том 2 (2003)(ru)
.pdf
5.Караев С.Ф., Гараева Ш.В., Мамедов Ф.В., Химия гетероатомных пропар-
гильных соединений, М.: Химия, 1993.
6.Темкин О.Н., Шестаков Т.К., Трегер Ю.А., Ацетилен. Химия. Механизмы реакций. Технология, М.: Химия, 1991, с. 224.
7.Gilmour D.W., Roberts J.S., UK Patent 1 468 046.
8.Chiusoli G.P., J. Org. Chem. 1986 300 (1–2) 57.
9.Chiusoli G.P., Transition Met. Chem. 1983 8 (3) 189.
10.Burns B., Grigg R., Sridharan V., Tetrahedron Lett. 1988 29 (34) 4325.
11.Grigg R., Dorrity M.J., Malone J.F., Tetrahedron Lett. 1990 31 (9) 1343.
12.Lu X., Xie X., Jiang H., Abstr. pre-OMCOS Symposium "Organometallic and Catalysis", University of Rennes, Rennes (France), 1999, p. 2.
13.Piquet M., Bruneau C., Dixneuf P.H., Chem. Commun. 1998 (20) 2249.
14.Semeril D., Piquet M., Bruneau C., Dixneuf P.H., Abstr. pre-OMCOS Symposium "Organometallic and Catalysis", Rennes (France), 1999, p. 68.
15.Barrett A.G.M., Baugh S.P.D., Braddock D.C., et al., Chem. Commun. 1997 1375.
16.Trost B.M., Krisch M.J., Synlett 1988 1.
17.Utimoto K., Pure & Appl. Chem. 1983 55 (11) 1845.
18.Saito T., Morimoto M., Akiyama C., et al., J. Am. Chem. Soc. 1995 117 (43) 10757.
19.Riediker M., Schwartz J., J. Am. Chem. Soc. 1982 104 (21) 5842.
20.Luo F.T., Wang R.T., Schreuder I., Youji Huaxue 1993 13 (3) 297.
21.Wolf L.B., Tijen K.C.M.F., Rutjes F.P.J.T., et al., Tetrahedron Lett. 1998 39 5081.
22.Arcadi A., Synlett 1997 941.
23.Bouyssi D., Cavicchioli M., Balme G., Synlett 1997 944.
24.Luo F.T., Wang R.T., Tetrahedron Lett. 1992 33 (45) 6835.
25.Fukuda Y., Utimoto K., Nozaki M., Heterocycles 1987 25 297.
26.Utimoto K., Miwa H., Nozaki M., Tetrahedron Lett. 1981 22 (43) 4277.
27.Визер С.А., в сб. Химия природных и синтетических биологически активных соед.: труды Ин-та хим. наук им. А.Б. Бектурова, Алматы, 2001, т. 76, с. 101.
28.Визер С.А., Ержанов К.Б., Дедешко Е.Х., Еспенбетов А.А., в кн. Азотистые гетероциклы и алкалоиды, под ред. Карцева В.Г., Толстикова Г.А., М.: Иридиум-Пресс, 2001, т. 2, с. 65.
29.Arcadi A., Cacchi S., Larock R.C., Marinelli F., Tetrahedron Lett. 1993 34 (17) 2813.
30.Iritani K., Yanagihara N., Utimoto K., J. Org. Chem. 1986 51 (26) 5499.
31.Yamamoto M., Tanaba S., Naruchi K., Yamada K., Synthesis 1982 (10) 850.
32.Fujiwara J., Fukutani Y., Sano H., et al., J. Am. Chem. Soc. 1983 105 (24) 7177.
33.Taylor E.G., Katz A.H., Salgado-Zamora H., Mc Killop A., Tetrahedron Lett. 1985 26 (48) 5963.
34.Iritani K., Matsubara S., Utimoto K., Tetrahedron Lett. 1988 29 (15) 1799.
35.Rudisill D.E., Stille J.K., J. Org. Chem. 1989 54 5856.
36.Arcadi A., Cacchi S., Marinelli F., Tetrahedron Lett. 1989 30 (19) 2581.
37.Cacchi S., Carnicelli V., Marinelli F., J. Org. Chem. 1994 475 (1–2) 289.
38.Saulnier M.G., Frennesson D.B., Deshpande M.S., Vyas D.M., Tetrahedron Lett. 1995 36 (43) 7841.
39.Mizutani M., Sanemitsu Y., Tamaru Y., Yoshida Z.-I., Tetrahedron Lett. 1985 26
(9)1237.
40.Mizutani M., Sanemitsu Y., Tamaru Y., Yoshida Z.-I., Tetrahedron 1986 42
(1)305.
Избранные методы синтеза и модификации гетероциклов, том 2 |
101 |

41.Wu M.-J., Wei L.-M., Lin C.-F., Abstr. pre-OMCOS Symposium "Organometallic and Catalysis", University of Rennes, Rennes (France), 1999, p. 76.
42.Castro C.E., Gaughan E.J., Owsley D.C., J. Org. Chem. 1966 31 4071.
43.Haglund O., Nillson M., Synlett 1981 (10) 671.
44.Sakamoto T., Kondo Y., Iwashita S., et al., Chem. Pharm. Bull. 1988 36 (4) 1305.
45.Larock R.C., Yum E.K., J. Am. Chem. Soc. 1991 113 (17) 6689.
46.Wensbo D., Eriksson A., Jeschke T., et al., Tetrahedron Lett. 1993 34 (17) 2823.
47.Arcadi A., Cacchi S., Marinelli F., Tetrahedron Lett. 1992 33 3815.
48.Heck R.F., Palladium Reagents in Organic Synthesis, London: Academic Press, 1985.
49.Amatore C., Blart E., Genet J.P., et al., J. Org. Chem. 1995 60 (21) 6829.
50.Genet J.P., Blart E., Savignac M., Synlett 1992 715.
51.Candiani I., De Berandinis S., Carbi W., et al., Synlett 1993 (4) 269.
52.Zhang Y., Negishi E.-I., J. Am. Chem. Soc. 1989 111 (9) 3455.
53.Arcadi A., Cacchi S., Del Rosario M., et al., J. Org. Chem. 1996 61 (26) 9280.
54.Iino Y., Tanaka A., Yamashita K., Agric. and Biol. Chem. (Jpn.) 1972 36 2505.
55.Kupchan S.M., Britto R.W., Ziegler M.F., et al., J. Am. Chem. Soc. 1973 95 1335.
56.Dickens F., Jones H.E.H., Brit. J. Cancer 1961 15 85.
57.Dickens F., Jones H.E.H., Waynforth H.B., Brit. J. Cancer 1966 20 134.
58.Yamamoto M., J. Chem. Soc. Chem. Commun. 1978 15 649.
59.Lambert C., Utimoto K., Nosaki H., Tetrahedron Lett. 1984 25 5323.
60.Yanagihara N., Lambert C., Iritani K., et al., J. Am. Chem. Soc. 1986 108 (10) 2753.
61.Wang Z., Lu X., J. Org. Chem. 1996 61 (7) 2254.
62.Cavicchioli M., Bouyssi D., Gore J., Balme G., Tetrahedron Lett. 1996 37 (9) 1429.
63.Bouyssi D., Gore J., Balme G., et al., Tetrahedron Lett. 1993 34 (19) 3129.
64.Batu G., Stevenson R., J. Org. Chem. 1980 45 (8) 1532.
65.Castro C.E., Gaughan E.J., Owsley D.C., J. Org. Chem. 1966 31 4071.
66.Liao H.-Y., Cheng C.-H., J. Org. Chem. 1995 60 3711.
102 |
Серия научных монографий InterBioScreen |

Способы функционализации производных антра- и нафтохинона
Горностаев Л.М., Лаврикова Т.И., Арнольд Е.В., Подвязный О.В.
Красноярский государственный педагогический университет 660049, Красноярск, ул. Лебедевой, 89
Известно, что некоторые природные и синтетические антрахиноны и их гетероциклические производные обладают противоопухолевой активностью [1]. Во многих случаях биологическая активность подобных соединений обусловлена наличием не только хиноидного фрагмента, но и остатка "биогенного" амина. Антра[1,9-cd]пиразол-6(1H)-оны (пиразолантроны) 1 и их азааналоги 2, содержащие алкиламиногруппы в положениях 2 и 5, также проявляют противоопухолевую активность [2].
R'
N N
X
O HN R''
1 X = CH;
2 X = N
Региоселективный синтез пиразолантронов затруднен тем, что в реакциях соответствующих 1-хлор-9,10-антрахинонов с несимметричными гидразинами первичная нуклеофильная атака хлорантрахинона может осуществляться как первичной, так и вторичной аминогруппой гидразина, что далее приводит к изомерным пиразолантронам.
Таким образом, введение остатков биогенных аминов, гидразинов сопряжено с различными синтетическими трудностями, обусловленными, например, наличием нескольких реакционных центров в молекуле модифицируемого хинона, структурными особенностями аминирующего агента, образованием побочных трудноотделяемых продуктов и т.д. Для преодоления этих и подобных трудностей используются различные приемы. Например, в качестве модифицируемого хиноидного субстрата применяют производные 1-фтор-9,10-антрахинона [3], вводят в
реакции с антрахинонами готовые блоки, содержащие фрагмент биогенного амина [3], предварительно защищают одну из аминогрупп в несимметричном гидразине [4]. Такой подход позволяет проводить реакции региоселективно, но в целом осложняет путь к функционализированным хинонам.
В настоящем обзоре рассматриваются разработанные нами пути функционализации некоторых азотсодержащих производных антра- и нафтохинонов.
Избранные методы синтеза и модификации гетероциклов, том 2 |
103 |

1. Реакции 3,5-диарилокси-6H-6-оксоантра[1,9-cd]изоксазолов с азиридином
Нами установлено [5], что аминирование 3,5-диарилокси-6H-6-оксоантра[1,9-cd]- изоксазолов 3 азиридином в толуоле при 10–20°С приводит к смеси 5-азиридино- 3-арилокси-6(6H)-оксоантра[1,9-cd]изоксазола 4 и 3,5-диазиридино-6(6H)-оксо- антра[1,9-cd]изоксазола 5.
O N
O
|
R |
O O |
|
3a−e |
|
H |
|
N |
|
O N |
O N |
O |
N |
R |
+ |
O N |
O N |
4a−e |
5 |
R = H (a), o-Me (b), m-Me (c), p-Me (d), p-t-Bu (e)
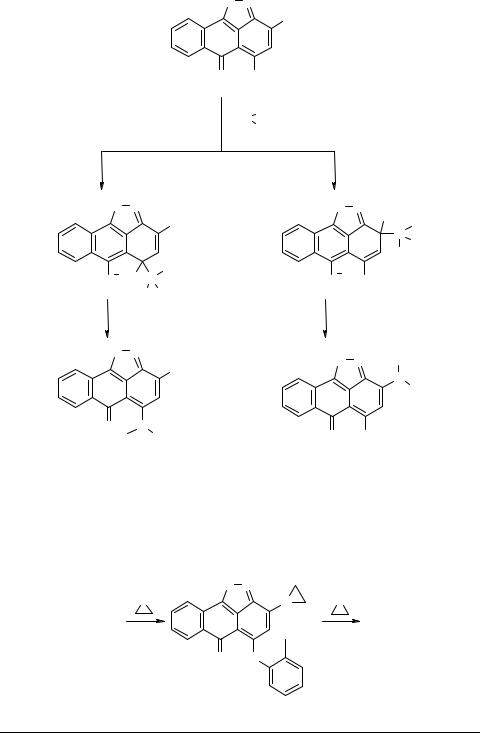
Например, 6-оксо-3,5-ди(о-толилокси)-6H-антра[1,9-cd]изоксазол 3b в условиях реакции дает смесь продуктов 4b и 5, причем использование большего избытка азиридина или повышение температуры до 40–50°C при проведении реакции в толуоле не изменяет соотношения продуктов 4b и 5. В то же время проведение аминирования в диметилформамиде приводит к преимущественному при 5–15°C и исключительному при 40–50°C образованию вещества 5.
Высокая активность положений 5 и 3 в соединениях типа 3b ранее объяснялась [6] ароматизацией центрального антронового ядра σ-комплексов 6–7 и дополнительной стабилизацией комплекса 6 из-за образования внутримолекулярной водородной связи.
104 |
Серия научных монографий InterBioScreen |
O N
X
O X
HN R'R''
O N |
O N |
X + |
R' |
||
|
X |
|
|
||
|
|
|
|
N |
R'' |
|
+ R' |
|
|
H |
|
|
|
|
|
|
|
O |
X N |
O |
X |
7 |
|
6 |
H R" |
|
|
|
|
O N |
O |
N |
R' |
|
|
|
X |
|
|||
|
|
|
N R" |
||
|
|
|
|
||
OR' |
N R" |
O |
X |
|
|
|
|
X = Cl, Br |
|
|
|
Квантово-химические расчеты, проведенные для 6-оксоантраизоксазолов [7], свидетельствовали о сопоставимой электрофильности положений 5 и 3. Учитывая изложенное, можно предполагать, что при аминировании изоксазола 3b в толуоле нуклеофильной атаке подвергается преимущественно положение 5 и образующийся при этом продукт 4b далее не аминируется. Образование же диазиридинопроизводного 5 в толуоле, по-видимому, происходит по следующей схеме.
H |
O N |
N |
H |
N |
|
N |
|
3b |
|
|
5 |
O O
8b
Избранные методы синтеза и модификации гетероциклов, том 2 |
105 |

Очевидно, неполярный растворитель (толуол) способствует в данном случае повышению активности положения 5 как в исходном веществе 3b, так и в промежуточном соединении 8b благодаря дополнительной стабилизации σ-комплекса 9a–b за счет внутримолекулярной водородной связи.
H |
O N |
H |
|
R |
|||
N |
N |
||
3b, 8b |
|
5 |
|
|
O− N+ H |
|
|
|
9 |
|
|
R = O |
(a); N (b) |
|
В ДМФА вклад этой составляющей уменьшается, и продукт 5, очевидно, образуется по следующим маршрутам.
H H
N N
3b  4b + 8b
4b + 8b  5
5
Путем дробной кристаллизации после проведения азиридинирования субстрата 3b в толуоле продукты 3b–5 разделяются, а аминирование в ДМФА приводит почти количественно к диазиридинопроизводному 5.
Полученные азиридинопроизводные 4b и 5 были использованы для дальнейших модификаций. Изоксазол 4b был переведен в продукт 10b путем следующих превращений [5].
O N |
O |
HN |
O |
∆ , PhBr |
O |
|
|
|
O N |
O |
N |
4b |
|
|
O HN
O
HBr
O HN
10b Br
106 |
Серия научных монографий InterBioScreen |
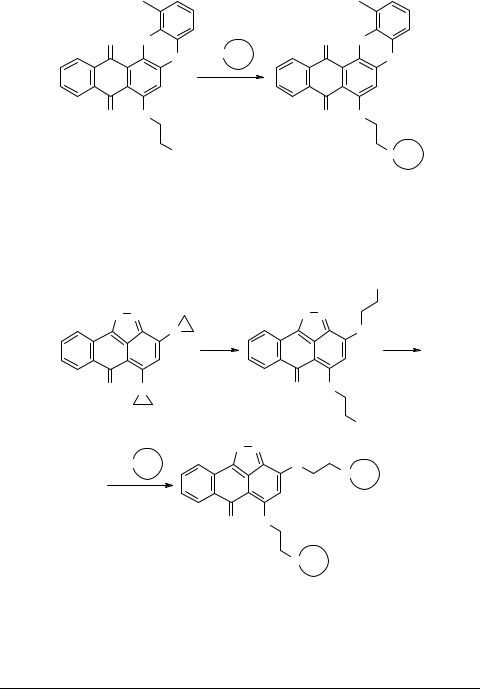
Феноксазины 10b достаточно легко реагируют с различными "биогенными" аминами, что позволяет синтезировать обширную группу веществ 11.
O |
HN |
O |
HN |
|
O HN |
|
O |
O |
HN |
O |
HN |
|
Br(I) |
|
N |
10b |
|
11 |
|
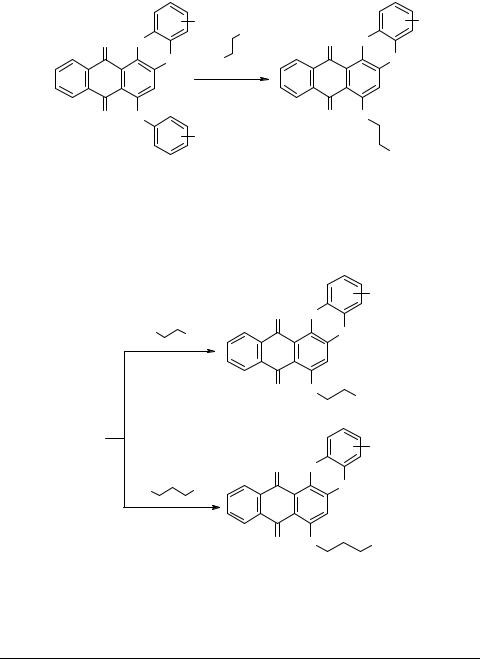
3,5-Диазиридино-6-оксо-6H-антра[1,9-cd]изоксазол 5 легко раскрывает азиридиновые циклы под действием хлороводородной, бромоводородной или иодоводородной кислот. Полученные соединения 12 также могут быть модифицированы аминами [5].
X
O N |
|
O N |
|
N |
HX |
|
NH |
|
|
|
|
O N |
|
O |
HN |
5 |
|
12 |
X |
HN |
O N |
H |
|
|
|
||
|
N |
N |
|
|
|
|
|
O HN
N
X = Cl, Br, I
Отметим, что ранее в ядро антрахинонов азиридиновый остаток вводили путем нуклеофильного замещения атома фтора в 1-фтор-9,10-антрахиноне [8], а также при замещении атомов хлора, брома в 5-галоген-6-оксо-6H-антра[1,9-cd]- изоксазолах [9].
Избранные методы синтеза и модификации гетероциклов, том 2 |
107 |
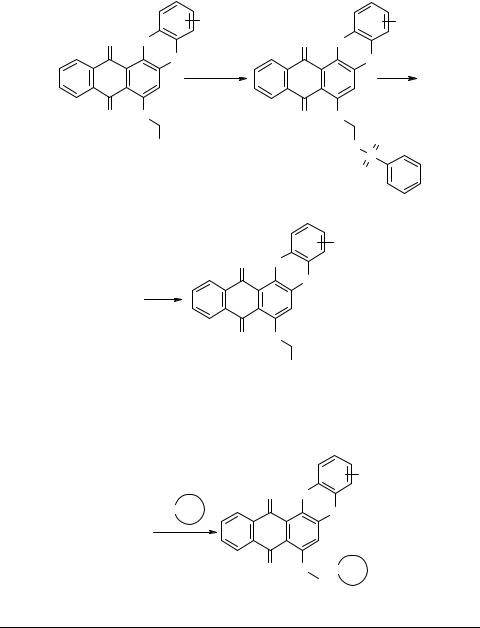
2. Реакции 7-арилоксинафто[2,3-b]феноксазин-8,13-дионов с аминами
Нами найдено [5], что 7-арилоксинафто[2,3-b]феноксазин-8,13-дионы 13 достаточно избирательно реагируют с различными, в том числе биогенными аминами.
|
R |
OH |
|
R |
|
O |
HN |
O |
HN |
||
|
|||||
|
O H2N |
|
|
O |
|
O |
O |
|
O |
HN |
|
|
R |
|
|
|
|
13 |
|
|
|
OH |
|
|
|
|
14 |
R = H (a), o-Me (b), m-Me (c), p-Me (d), p-t-Bu (e)
Аналогичным образом субстраты 13 реагировали с этилендиамином, 1-амино- 3-пропанолом. Эти реакции протекают при кипячении в диоксане, ДМФА, бромбензоле.
|
|
|
R |
H2N |
O |
HN |
|
NH2 |
|
O |
|
|
|
15 |
|
|
|
|
|
|
O |
HN |
NH2 |
|
|
|
|
13 |
|
|
R |
|
|
|
|
|
O |
HN |
|
H2N |
OH |
|
O |
|
|
|
16 |
|
O |
HN |
OH |
Особый интерес представляют продукты 14, 16, поскольку их модификация путем замещения гидроксильной группы биогенным амином может приводить к аналогам известных противоопухолевых препаратов, содержащих фрагмент -NH-(CH2)n-NR'R'', 11, 17. Мы нашли, что эту модификацию можно проводить
108 |
Серия научных монографий InterBioScreen |
путем предварительного замещения гидроксильной группы в феноксазинах 14, 16 атомом хлора [5].
Удобным реагентом для замены гидроксильной группы атомом хлора оказался бензолсульфохлорид. В результате реакций последнего с феноксазинами 14 и 16 в пиридине в некоторых случаях удается выделить эфиры бензолсульфокислоты 18, которые далее превращаются в хлорэтиламиноантрахиноны 19.
|
|
R |
|
|
R |
O |
HN |
|
O HN |
|
|
|
O |
PhSO2Cl |
|
O |
|
|
|
|
|
|
|
O |
HN ( )n |
|
O HN ( )n |
O |
|
|
OH |
|
O |
S |
|
|
|
|
|||
|
|
|
O |
|
|
14, 16 |
|
|
18 |
|
|
|
|
|
R |
|
|
|
|
O |
HN |
|
|
|
|
|
O |
|
|
O HN ( )n
Cl
19
R = H, Alk; n = 2 (14), 3 (16)
Феноксазины 18, 19 можно далее модифицировать различными аминами.
R
O HN
HN |
O |
18, 19
O HN ( )nN
n = 2 (11), 3 (17)
Избранные методы синтеза и модификации гетероциклов, том 2 |
109 |
На основе 1-нитро-9,10-антрахинон-2-карбоновой кислоты 20 нами разработан также [10] способ получения амидов 1-(2-гидроксиэтил)амино-9,10-антра- хинон-2-карбоновой кислоты 21, включающий следующие превращения.
|
|
|
|
OH |
O NO2 |
O |
|
O HN |
O |
|
OH H2N |
OH |
OH ∆ |
|
|
|
|||
O |
|
|
O |
|
20 |
|
|
|
|
|
|
|
|
OH |
O |
HN |
O |
O HN |
O |
|
|
|
HN |
N |
|
|
O |
|
|
|
|
|
|
|
O |
|
|
O |
|
|
|
|
21 |
|
1-(3-Гидроксипропил)амино-9,10-антрахинон-2-карбоновая кислота 22 ведет себя иначе. При ее кипячении в уксусной кислоте получено ацетоксипроизводное 23, а в кипящем о-дихлорбензоле образуется продукт декарбоксилирования – 1-(3-гидроксипропил)амино-9,10-антрахинон 24.
|
|
|
|
O |
|
|
|
|
O |
|
OH |
O |
HN |
O |
|
|
|
|
|
NH2 |
AcOH |
|
|
OH |
∆ |
|
|
|
|
|
|
|
|
|
O HN |
O |
O |
|
|
|
|
|
|
|
OH |
OH |
23 |
|
|
20 |
|
|
|
|
Cl |
O |
HN |
OH |
|
|
Cl |
O
22
∆
O
24
110 |
Серия научных монографий InterBioScreen |
