
Карцев В.Г. - Избранные методы синтеза и модификации гетероциклов. Том 2 (2003)(ru)
.pdf
OEt |
|
|
|
|
|
O |
|
|
O |
NH |
O |
BF3 |
|
|
O |
N |
OEt |
|
|
|
||||||
R |
N |
OEt |
H+ |
H2N |
OEt |
+ R |
|
|
|
H |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
( )n |
O |
( ) |
+ |
1 |
+ |
( ) |
n |
+ |
N |
OEt |
|
n |
|
|
|
−H |
|
|
|
|
|
|
R |
NH |
|
R |
|
|
|
|
|
|
|
|
|||
|
|
|
O |
|
OEt |
20 |
|
|
|
|
|
|
|
|
|||
Аналогичные результаты были получены [17] при изучении взаимодействия норборнадиена с метиленбискарбаматами в присутствии эфирата трехфтористого бора.
Интересно отметить [18], что N,N-бензилиденбисамиды взаимодействуют с сопряженными диенами в присутствии кислотных катализаторов, образуя наряду с 1,2,5,6-тетрагидропиридинами также изомерные им 5,6-дигидро-4Н-1,3-оксазины. Образование последних в качестве побочных продуктов аналогичных реакций N,N-дибензилиденбисалкилкарбаматов не отмечалось [10].
Реакция замещенных метиленбискарбаматов с замещенными 1,3-диенами нашла применение для синтеза ряда труднодоступных соединений, например, изохинуклидина из метиленуретана и циклогексадиена [3], алкалоидов d,l-аната- бина и d,l-N-метиланатабина [13].
Замещенные метиленбискарбаматы были использованы Хьюсманом [19] для синтеза азастероидов. Им было показано, что взаимодействие диена 21 с метиленбискарбаматом 22 приводит к образованию трициклического аддукта 23, который после гидролиза сложноэфирной группы и декарбоксилирования циклизуется с образованием 1,3-азастероида 24.
|
O |
OEt |
O |
|
|
|
|
|
|
+ |
HN |
|
BF3·Et2O |
|
O |
NH |
OEt |
|
|
MeO |
|
|
||
|
OEt |
|
|
|
21 |
22 |
|
|
|
O |
|
|
|
O |
|
|
|
|
|
N |
OEt |
|
|
N |
|
|
OEt |
|
|
MeO |
O |
|
MeO |
|
|
|
|
||
23 |
|
|
24 |
|
Избранные методы синтеза и модификации гетероциклов, том 2 |
41 |
|||
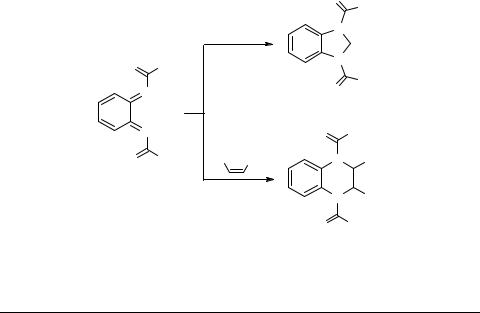
Замена этоксикарбонильной группы в молекуле метиленбискарбамата на бензилоксикарбонильную приводит к увеличению выхода конечного продукта реакции. Этот метод успешно использован также для синтеза 11-оксо-14-азастероидов.
Таким образом, синтез замещенных 1,2,5,6-тетрагидропиридинов, основанный на конденсации сопряженных диенов с активированными иминами или их устойчивыми производными, способными каталитически или термически превращаться в активированный иминосодержащий диенофил, из-за его одностадийности, простоты, доступности исходных веществ получил широкое применение.
N-Карбометокси-1,2-дигидропиридины, полученныепореакциисолей N-мето- ксикарбонилпиридиния с боргидридом натрия [20], либо с реактивом Гриньяра [21], являются ценными полупродуктами в синтезе других азагетероциклов [20, 22].
Хорошо известны также реакции циклоприсоединения карбаматов, происходящие с участием других активных функций.
Взаимодействиемметил-N-(n-нитрозофенил)карбаматас 1,3-диенами в СН2Сl2 при 25°С получены карбаматные производные 1,2-оксазина с достаточно высокими выходами [23]. Регионаправленность присоединения этилсорбата к упомянутому гетеродиенофилу установлена посредством превращения соответствующего аддукта под действием метанольного раствора гидроксида калия при 0°С в 3-гидрокси-6-метил-1-(п-метоксикарбониламино)фенилпиридон-2 [23, 24].
Взаимодействие диазометана, диазоэтана, этилдиазоацетата с N,N'-диметокси- карбонил-п-бензохинондиимином протекает в мягких условиях как реакция 1,3-диполярного циклоприсоединения с последующей изомеризацией и приводит к образованию соответствующих карбаматных производных индазола [25]. В то же время дифенилдиазометан реагирует с хинондиимидом только при нагревании с образованием производного бицикло[4,1,0]гепт-3-ена.
|
|
|
O |
OMe |
|
|
|
|
|
|
|
CH2N2 |
N |
|
O |
OMe |
−N2 |
N |
|
|
|
OMe |
||
N |
|
|
O |
|
|
|
|
||
|
|
25 |
|
|
N |
|
O |
|
OMe |
O |
OMe R' R" |
N |
R' |
|
|
|
20°C, 24 ч |
N |
R" |
|
|
|
||
|
|
O |
|
OMe |
|
|
26a−c |
||
R'+R'' = CH=CH-CH2 (a), (CH2)4 (b); R' = Ph, R'' = H (c)
42 |
Серия научных монографий InterBioScreen |
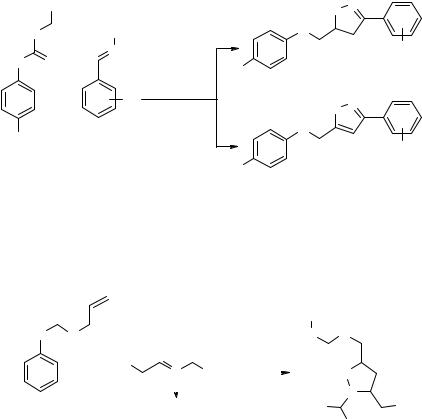
Диазометан реагирует с о-бензохинондиимидом in situ в СНСl3–Et2O при 0°С с образованием дигидробензимидазола 25 [27]. Взаимодействие циклопентадиена, циклогексена, стирола c N,N'-диметоксикарбонил-о-бензохинондиимином протекает как реакция диенового синтеза с обратными электронными требованиями и приводит к получению соответствующих тетрагидрохиноксалиновых производных
26 [27, 28].
В присутствии N-натрийбензолсульфонилхлорамида взаимодействие аллил- N-фенилкарбамата и метил-N-(п-аллилоксифенил)карбамата (п-YC6H4XCH2R, R = CH=CH2) с оксимами ароматических альдегидов (последние превращаются при этом в нитрилоксиды) протекает с высокой региоселективностью по схеме 1,3-диполярного циклоприсоединения и приводит к соответствующим 3,5-ди- замещенным изоксазолинам 27, 28a–h, аналогично из пропаргил-N-фенилкарба-
мата (п-YC6H4XCH2R, R = C≡CH) получены изоксазолы 29a–h [29–32].
R |
|
O N |
|
O |
OH |
X |
|
HN O |
N |
R' |
|
Y |
27, 28 |
||
|
|||
|
PhSO2NNaCl |
||
+ |
|
||
R' |
O N |
||
EtOH, ∆ |
|||
Y |
|
X |
|
|
R' |
||
|
|
||
|
Y |
29a−h |
27 X = NHCO2, Y = H; 28 X = O, Y = NHCO2Me; 29 X = NHCO2, Y = H;
R' = H (a), 4-OMe (b), 3,4-OCH2O (c), 4-Cl (d), 4-Br (e), 3-NO2 (f), 4-NO2 (g), 2-OMe (h)
Взаимодействие аллил-N-фенилкарбамата с нитронами (азометин-N-окси- дами) протекает практически региоспецифично и приводит к соответствующим 3,5-дизамещенным 2-изоксазолидинам 30 с высокими выходами [33].
|
O |
|
|
|
|
|
Ph |
|
||||
|
|
|
|
|
|
|
|
|
|
|||
HN |
|
|
O |
|
R |
|
HN O |
|
||||
|
|
|
|
|
|
|
|
|
|
|||
|
|
Ph ( )n N |
|
|
|
|
|
|
|
|||
|
+ |
|
R' |
толуол |
O O |
|
||||||
|
|
|
||||||||||
|
|
∆, 5ч |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
R |
n( ) Ph |
|||||
|
|
|
|
|
|
|
|
|
|
|
R' |
|
|
|
|
|
|
|
|
|
|
|
|
30a−d |
|
a n = 0, R = R' = i-Pr; b n = 0, R = CH2=CHCH2, R' = 4-MeOC6H4; |
|
|||||||||||
c n = 0, R = CH2=CHCH2, R' = α-фурил; |
|
|
|
|
|
|||||||
d n = 1, R = CH2=CHCH2, R' = цикло-С6Н11 |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
||||
Избранные методы синтеза и модификации гетероциклов, том 2 |
43 |
|||||||||||

[3+2]-Циклоприсоединение аллил-N-фенилкарбамата к N-оксиду 4,5-дигидро- 5-метил-3Н-спиро(2-бензазепин-3,1'-циклогексана) протекает региоселективно с образованием двух диастереоизомеров 2-(N-фениламинокарбоксиметил)-7-метил- 4,6,7,11а-тетрагидро-5Н-спиро(изоксазолидино[3,2-a][2]бензазепин-5,1'-циклогек-
сана) 31, 32 [33].
|
|
O |
|
|
HN |
O |
|
|
+ |
толуол |
|
+ |
105°C, 5ч |
||
|
|||
N O− |
|
|
|
N |
|
+ |
N |
|
H |
|
H |
|
||
O |
|
O |
|
||
|
|
|
|
||
|
O |
|
|
O |
|
|
O |
NH |
|
O |
NH |
|
Ph |
|
Ph |
||
|
31 |
|
32 |
||
|
|
|
|
Циклоприсоединением диазометана к пропаргил-N-(1-нафтил)карбаматам в эфире получены 3-Х-4-[(1-нафтил)карбамоилоксиметил]пиразолы [34].
Реакции замыкания цикла с участием карбаматной и других групп
Среди превращений этого типа следует отметить гетероциклизации, протекающие за счет реакционноспособных заместителей в алкоксильной группе или с участием активного центра, расположенного по соседству с карбаматной функцией.
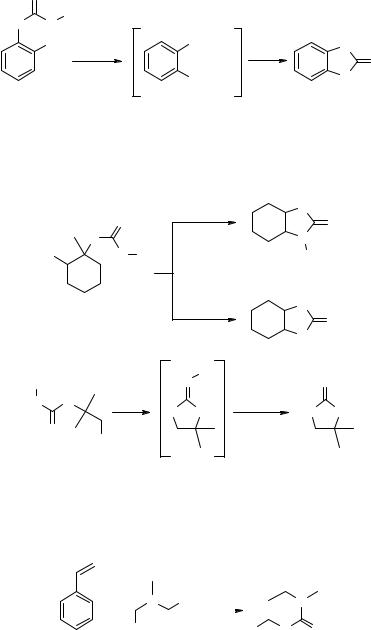
N-Монозамещенные карбаматы являются потенциальными нуклеофилами. Однако они (по аналогии с амидами) являются слабыми нуклеофилами и взаимодействуют в качестве таковых только в форме аниона или если активный центр и карбаматная функция расположены рядом (участие соседней группы). Если рядом с карбаматной группой находится сильный нуклеофил, например, аминогруппа, то при нагревании возможны циклизации, протекающие через отщепление–при- соединение [35].
44 |
Серия научных монографий InterBioScreen |
O |
|
|
|
HN O Ph |
|
H |
|
NH2 |
N=C=O |
||
N |
|||
−PhOH |
|
O |
|
NH2 |
N |
||
|
|||
|
H |
В то же время, если в качестве нуклеофила выступает оксид-анион, то протекает прямое замещение алкоксильной группы в карбаматной группировке [36].
Карбаматная связь сама может выступать как внутренний амбидентный нуклеофил [37, 38].
|
|
O |
EtOH |
O |
|
|
|
O |
|||
|
|
|
|
||
|
|
O |
|
|
N |
Cl |
|
N Ph |
|
|
Ph |
|
|
H |
|
|
|
|
|
|
EtOH, EtO− |
O |
|
|
|
|
|
|
O |
|
|
|
|
|
O |
Ph |
|
|
+ |
Ph |
O |
|
|
HN |
|
||
HN |
O |
|
O |
O |
O O |
|
|
|
|||
O |
|
Br |
|
|
−PhNH2 |
|
|
|
|
||
|
|
|
|
|
|
Этил-N-(3-гидроксипропил)уретаны циклизуются в 2-оксотетрагидро-1,3- оксазины 33 под действием метоксида натрия [39]. Интересный подход к синтезу таких соединений предложен в работе [10], который состоит во взаимодействии N-(хлорметил)карбамата с олефином в присутствии BF3.
+ |
N |
|
|
OEt BF3 |
|
|
|
N |
|
|
|
|
|
|
|||||||
Cl |
|
|
|
|
Ph |
|
O |
O |
|
|
|
O |
|
|
|||||||
|
|
|
|
|
|
|
33 |
|
|
|
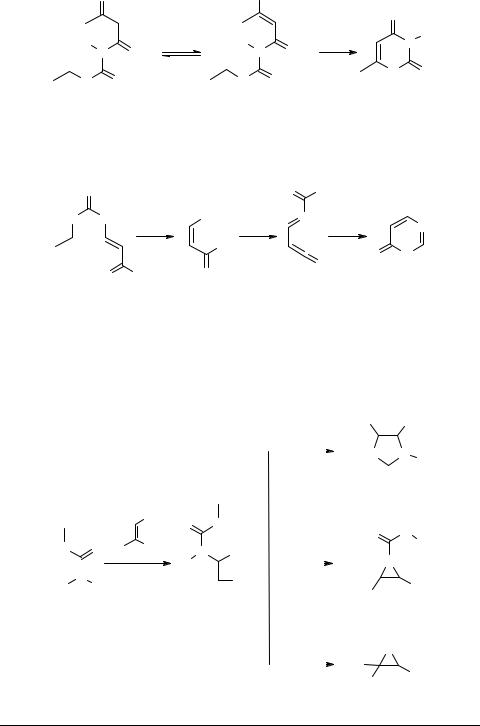
N-Ацетоацетилуретаны 34 могут циклизоваться в концентрированной серной |
||||||||||
кислоте с образованием производных 1,3-оксазин-2,4-диона 35 [40]. |
|
|||||||||
|
|
|
|
|
|
|||||
Избранные методы синтеза и модификации гетероциклов, том 2 |
45 |
|||||||||
O |
|
OH |
|
|
|
|
|
|
|
O |
|
R N |
O |
R N |
|
O |
N R |
O |
O |
O |
O |
O |
O |
|
|
||||
34 |
|
|
|
35 |
|
Мейер [41], Кранц и Хопп [42] пиролизом (650°С) 3-этоксикарбониламино- проп-2-еналя 36 получили 6Н-1,3-оксазин-6-он 37.
O |
|
|
O H |
|
O NH |
∆ |
NCO |
N |
N |
|
||||
|
|
H |
O |
O |
|
|
|
||
O |
H |
O |
O |
|
|
|
|||
36 |
|
|
|
37 |
Особую группу гетероциклизаций представляют реакции продуктов взаимодействия N-галогенкарбаматов с ненасыщенными соединениями.
Мочалин и Филенко [43, 44] показали возможность превращения β-бром- карбаматов 38 в замещенные оксазолидиноны 39 и азиридины 40 и 41 соответственно при пиролизе и обработке щелочью.
|
|
|
|
|
|
|
|
|
|
|
|
|
R" |
|
|
|
R'" |
||
|
|
|
|
|
|
|
|
|
|
∆ |
|
R' |
|
|
|
|
|
N R |
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
−MeBr |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
||
|
|
|
R'" |
|
|
|
|
|
|
|
|
|
|
|
|
39 |
|||
|
|
|
O |
|
|
O |
|
|
|
|
|
O |
|
|
|
O R |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
O |
|
|
O R' R" |
|
N |
|
R'" |
KOH |
|
|
|
|
|
||||||
|
|
R |
|
|
|
|
|
N |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
Et2O |
|
|
|
|
|
|||||
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
R'" |
|
|
|
|
|||||||
Br |
R |
R" |
|
Br |
|
|
|
|
|
|
R" |
||||||||
|
|
|
|
|
|
|
|
|
|
|
R' |
|
|
|
|||||
|
|
|
|
|
|
|
R' |
|
|
|
40 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
38 |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
||
|
|
|
|
|
|
|
|
|
|
NaOH |
R'" |
|
N |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R" |
|||
|
|
|
|
|
|
|
|
|
|
H2O−EtOH |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
R' |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
41 |
|||
46 |
Серия научных монографий InterBioScreen |
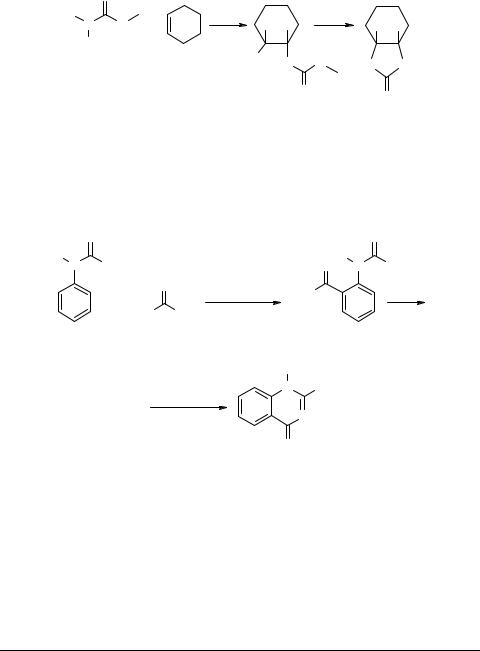
В отличие от N,N-дихлоркарбаматов N-бром- и N,N-дибромкарбаматы присоединяются к этиленовым соединениям более стереоспецифично; процесс в основном протекает как транс-присоединение, что показано [45] на примере реакции N-бромкарбаматов с циклогексеном.
|
O |
|
∆ |
|
|
Br N |
O + |
Br H |
H |
H |
|
R |
|
|
−MeBr |
|
|
H |
|
|
|
|
|
|
HN |
O |
O |
NH |
O O
Взаимодействие анилидов 42a, b с этилкарбаматом при кипячении в ксилоле в присутствии Р2О5 приводит к получению природных хиназолонов – гликофимина 43a и арборина 43b [46, 47]. Авторы статьи [48] установили, что взаимодействие ациламинобензолов 42a–d с этилкарбаматом в ксилоле в присутствии AlCl3 приводит к получению о-(ациламино)бензамидов 44a–d, которые, в свою очередь, могут циклизоваться в присутствии Р2О5 в соответствующие хиназолоны 43a–d.
O |
|
O |
|
R N R' |
|
O R N R' |
|
O |
AlCl3, ксилол |
H N |
|
+ H N OEt |
|||
∆ |
2 |
||
|
|||
2 |
|
|
|
42a−d |
|
44a−d |
|
|
|
R |
|
P2O5, ксилол |
N R' |
||
|
|||
∆ |
|
N |
|
O
43a−d
R = H, R' = Bn (a); R = Me, R' = Bn (b);
R = H, R' = i-Pr (c); R = H, R' = Me (d)
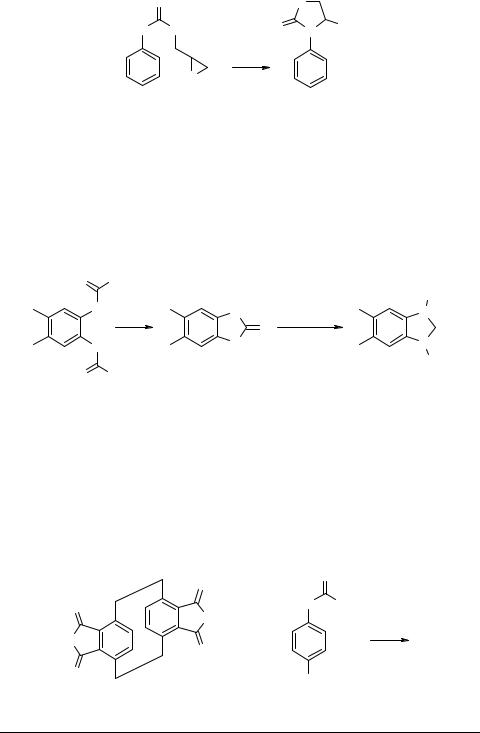
Глицидилфенилуретан 45 способен циклизоваться за счет внутримолекулярного взаимодействия внутренних эпоксидной и карбаматной групп в соединение
46 [49, 50].
Имеется ряд работ [51–53], в которых изучалась рециклизация N-фенил- глицидилуретанов 45, в том числе с использованием метода ЯМР 1Н спектроскопии, однако единого мнения о механизме и структуре продуктов реакции до сих пор нет.
Избранные методы синтеза и модификации гетероциклов, том 2 |
47 |
O |
O |
HN O |
O N OH |
|
∆ , кат. |
|
O |
45 |
46 |
Описан [54] метод N-алкилирования 2-бензимидазолонов 47, которые были получены, в свою очередь, при внутримолекулярной циклизации и декарбоксилировании о-ди(метоксикарбониламино)бензолов. Оба этапа, циклизация и N-алки- лирование с образованием соединений 48a–f, были осуществлены за одну операцию с использованием алкилирующего агента, толуола как растворителя, смеси порошкообразных гидроксида и карбоната калия как основания и в присутствии соли четвертичного аммониевого основания, например, ТЭБАХ, выступающего в качестве катализатора межфазного переноса.
O |
OMe |
|
|
|
|
|
|
R' |
NH |
|
− |
R' |
H |
KOH/K2CO3 |
R' |
HO |
N |
TEBAC |
|||||
|
|
|
|
|
|
O |
|
R' |
NH |
|
|
R' |
N |
R"X |
R' |
|
|
толуол |
|||||
|
|
|
|
|
H |
|
|
O |
OMe |
|
|
47 |
|
|
|
|
|
|
|
|
|
|
|
R' = H, R'' = Bn (a); R' = H, R'' = Me (b); R' = H, R'' = Et (c);
R' = H, R'' = sec-Bu (d); R' = Me, R'' = Bn (e); R' = Me, R'' = Bu (f)
R"
N
 O
O
N
R"
48a−f
Изучены реакции [12] фталевого ангидрида и диангидрида пиромеллитовой кислоты с эфирами N-арилкарбаминовой кислоты при сплавлении, которые приводят к образованию соответствующих имидов.
Исследовано [55] взаимодействие диангидрида [2,2]парациклофан-4,5,12,13- тетракарбоновой кислоты 49 с N-арилкарбаматами и установлено, что продуктами реакции являются бисимиды 50a–e.
|
O |
O |
|
|
|
O |
O |
HN OEt |
|
|
|
O |
O |
+ 2 |
|
|
|
O |
|
R |
|
49 |
|
|
|
48 |
Серия научных монографий InterBioScreen |

O
O
N R
R N
O
O
50a−e
a R = MeO; b R = Me; c R = Ph; d R = NO2; e R = Cl
Хлорметилирование метил-N-(n-толил)карбамата приводит к получению наряду с ожидаемым метил-N-(2-хлорметил-4-толил)карбаматом 6-метил-1-метокси- карбонил-1,2-дигидро-4H-3,1-бензоксазина 51, выход которого повышается с 10% (при концентрации НСl ~43% ) до 25% (при концентрации НСl ~37%) [56].
O
O O
HN O
H2CO + HCl |
N |
диоксан, 20°C O
51
В работе [57] исследовано поведение этил-N-[2-(1-гидрокси-2-Y-этил)фенил]- карбаматов (52, Y = SMe, SOMe, SO2Me) при действии оснований и получены N-гетероциклы 53, 54.
|
O |
|
|
|
|
|
|
|
O |
NH |
Y |
|
|
|
Y |
|
|
|
|
|
|
|
|
|
||
|
|
OH |
K2CO3 |
|
|
O |
|
|
|
|
|
|
|
|
|
||
|
|
|
Y = SMe |
|
N |
O |
|
|
|
|
|
|
|
|
|
||
|
52 |
|
|
53 |
H |
|
|
|
|
Br2 |
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
O |
NH |
Br |
|
HO OH |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
TsOH |
|
|
||
|
|
OH NaH |
|
|
|
|
||
|
|
|
ТГФ |
N |
|
толуол |
N |
|
|
|
|
|
|
|
|||
|
|
|
|
O |
OEt |
O |
OEt |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
54 |
|
Избранные методы синтеза и модификации гетероциклов, том 2 |
|
49 |
||||||
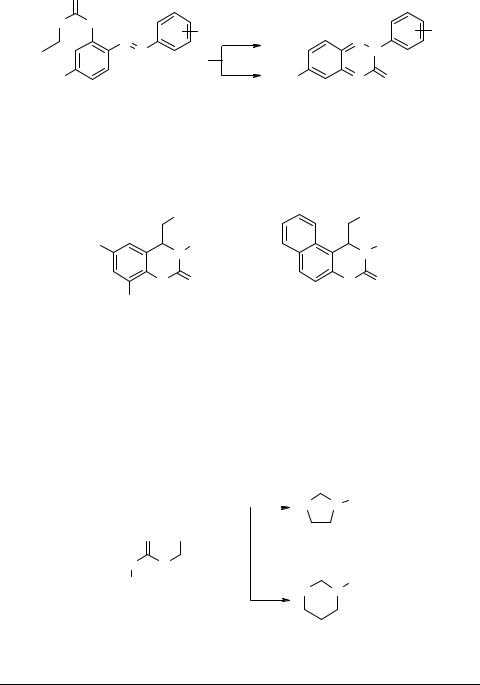
Исследованы синтез и циклизации в производные бензотриазинона 55 некоторых этиловых эфиров замещенных азобензол-2-карбаминовых кислот 56 [58, 59].
|
O |
|
|
|
|
O |
NH |
R ∆ |
|
|
R |
|
N |
|
N |
||
|
N |
|
N |
||
H2N |
|
HCl |
H2N |
N |
O |
|
|
||||
|
55 |
|
|
56 |
|
N-Арил[2-(2-нитроэтенил)арил]- и N-арил[1-(2-нитроэтенил)нафталин-2-ил]- карбаматы легко циклизуются при комнатной температуре в присутствии основного катализатора в соответствующие 3-арил-4-нитрометил-3,4-дигидро-2Н-1,3- бензоксазин-2-оны 57a–e и 2-арил-1-нитрометил-2,3-дигидро-1Н-нафт[1,2-e][1,3]- оксазин-3-оны 58 [60].
|
NO2 |
NO2 |
R" |
N Ar |
N Ar |
O |
O |
O O |
R' |
|
|
57a−e |
|
58a, b |
57: R' = R'' = H, Ar = Ph (a), R' = R'' = H, Ar = p-ClC6H4 (b),
R' = H, R'' = Cl, Ar = Ph (c), R' = H, R'' = Cl, Ar = p-ClC6H4 (d),
R' = H, R'' = Br, Ar = Ph (e);
58: Ar = Ph (a), p-ClC6H4 (b)
N-Арилкарбаматы β-галогенэтанолов и γ-галогенпропанолов 59 могут также циклизоваться [12, 61–63] соответственно в 2-оксазолидиноны 60 и N-арил-2-оксо- тетрагидро-1,3-оксазины 61.
|
|
|
|
|
O |
|
|
O |
Hal |
|
n = 2 |
O |
|
N Ar |
|
|
|||||||
|
|
|
|||||
HO− |
|
60 |
|
||||
HN |
O ( )n |
|
|
|
O |
Ar |
|
|
|
|
|||||
|
|
|
|
|
|||
Ar |
|
|
n = 3 |
O |
|
N |
|
|
|
|
|||||
59 |
|
|
|
|
|||
|
|
|
|
|
|
|
|
61
Hal = Cl, Br; Ar = Ph, 3,4-ClC6H3
50 |
Серия научных монографий InterBioScreen |
