
Карцев В.Г. - Избранные методы синтеза и модификации гетероциклов. Том 2 (2003)(ru)
.pdf
Исходя из 2-гетарилхроманонов, несущих остатки тиофена, пиридина, пиррола, были получены соответствующие гетероаналоги флавонов, причем в качестве дегидрирующего средства был использован пятихлористый фосфор в бензоле
[80, 95].
Известно несколько методов синтеза 2-гетарилхромонов, где гетероциклическое кольцо достраивается к готовому хромону. Так, например, 2-(1Н-тетразо- лил-5)хромоны 29 были получены при взаимодействии 2-цианхромонов 28 с азидом натрия [113] (схема 10).
Схема 10
|
HN |
N |
O CN NaN3 |
O |
N |
N |
||
O |
O |
|
28 |
29 |
|
Аналогичным путем был осуществлен синтез бис-2-(1Н-тетразолил-5) хромо-
нов [114, 115].
Конденсации 2-карбонильных производных хромонов 30 и 32 с о-фени- лендиаминами приводят к бензимидазольным аналогам флавонов 31 и 33 [116] (схема 11).
|
|
|
|
|
Схема 11 |
O |
O |
H2N |
NH2 |
N |
|
OEt |
ПФА |
O |
N |
||
|
+ |
|
|
H |
|
O |
|
|
|
O |
|
30 |
|
|
|
31 |
|
|
O |
|
HN |
|
N |
O |
H |
H2N |
(AcO)2Cu |
O |
N |
|
+ |
|
|
|
|
O |
|
|
|
O |
|
32 |
|
|
|
33 |
|
Избранные методы синтеза и модификации гетероциклов, том 2 |
201 |
||||
Одним из наиболее удобных и дающим количественные выходы целевого продукта методов синтеза флавонов является гидролиз солей 4-этоксифлавилия [117, 118]. Последние могут быть получены реакцией 2-гидроксихалконов 18 и ортомуравьиного эфира в присутствии 70% хлорной кислоты или, минуя стадию выделения халконов, непосредственно из ацетофенонов, альдегидов и триэтилортоформиата [119, 120] (схема 12). Образующийся на первой стадии флаванон 19 алкилируется диэтоксикарбониевым ионом, превращаясь при этом через соответствующий 4-этоксихромен 34 в перхлорат 4-этоксифлавилия 35.
|
|
|
|
|
|
|
|
Схема 12 |
(EtO)3CH + HClO4 |
|
[CH(OEt)2]+ClO−4 |
+ EtOH |
|
|
|||
OH |
R' |
|
|
O |
|
R' |
+ |
− |
|
|
|
|
|
||||
R |
|
R |
|
|
|
(EtO)2CH ClO4 |
||
|
|
|
|
|
|
|
||
O |
|
|
19 |
O |
|
|
|
|
18 |
|
|
|
|
|
|
|
|
|
O |
R' |
+ |
− |
|
O |
|
R' |
|
|
|
|
|
||||
R |
|
(EtO)2CH ClO4 |
R |
+ |
ClO−4 |
|||
|
|
|
|
|
||||
|
|
|
|
|
|
|
||
|
OEt |
|
|
|
|
OEt |
|
|
34 |
|
|
|
|
|
35 |
|
|
По этому методу были синтезированы диоксановые, диоксоловые и диоксепановые аналоги флавонов [121, 122].
Литература
1.Kostanecki S., Tambor J., Ber. Bunsen-Ges. Phys. Chem. 1895 28 2302.
2.Emilewicz T., Kostanecki S., Tambor J., Ber. Bunsen-Ges. Phys. Chem. 1899 32 2448.
3.Czaykowski J., Kostanecki S., Tambor J., Ber. Bunsen-Ges. Phys. Chem. 1900 33 1988.
4.Kostanecki S., Rozycki A., Tambor J., Ber. Bunsen-Ges. Phys. Chem. 1900 33 3410.
5.Kostanecki S., Tambor J., Ber. Bunsen-Ges. Phys. Chem. 1900 33 330.
6.Kostanecki S., Steuermann J., Ber. Bunsen-Ges. Phys. Chem. 1901 34 109.
7.Gulat K.C., Venkataraman K., J. Chem. Soc. 1936 (2) 267.
202 |
Серия научных монографий InterBioScreen |

8.Reichel L., Henning H.-G., Ann. 1959 621 72.
9.Fletcher H., Philbin E.M., Thorton P.D., Wheeler T.S., Tetrahedron Lett. 1959
(6)9.
10.Koninklijke Ind., Dutch Patent 70 267; Chem. Аbstr. 1953 47 6445h.
11.Wander A.-G., Brit. Patent 728 767; Chem. Abstr. 1956 50 7877b.
12.Schmutz J., Hirt R., Kunzle F., et al., Helv. Chim. Acta 1953 36 620.
13.Koo J., J. Org. Chem. 1961 26 635.
14.Baker W., J. Chem. Soc. 1933 (11) 1381.
15.Baker W., J. Chem. Soc. 1934 (12) 1953.
16.Mahal H.S., Venkataraman K., Curr. Sci. 1933 2 214.
17.Mahal H.S., Venkataraman K., J. Chem. Soc. 1934 (11) 1767.
18.Dayle B.G., Gogan P., Gowan J.E., et al., Sci. Proc. Roy. Dublin Soc. 1948 24 291.
19.Gowan J.E., Wheeler T.S., J. Chem. Soc. 1950 (7) 1925.
20.Schmid H., Banholzer K., Helv. Chem. Acta 1954 37 1706.
21.Virkar V.V., Wheeler T.S., J. Chem. Soc. 1939 (11) 1679.
22.Ollis W.D., Weight D., J. Chem. Soc. 1952 (10) 3826.
23.Devitt P.F., Timoney A., Vicars M.A., J. Org. Chem. 1961 26 4941.
24.Donnelly D., Geoghegan R., O'Brein C., et al., J. Med. Chem. 1965 8 (6) 872.
25.Thakar K.A., Deshpande G.D., J. Indian Chem. Soc. 1972 49 (10) 1029.
26.Толмачев А.И., Белая Ж.Н., Химическое строение, свойства и реактивность органических соединений, Киев: Наукова думка, 1969, с. 38.
27.Толмачев А.И., Белая Ж.Н., Химическое строение, свойства и реактивность органических соединений, Киев: Наукова думка, 1969, с. 45.
28.Simonis H., Z. Angew. Chem. 1926 39 1461.
29.Chavan J.J., Robinson R., J. Chem. Soc. 1933 (4) 368.
30.Dunne A.T.M., Gowan J.E., Keane J., et al., J. Chem. Soc. 1950 (4) 1252.
31.Lynch H.M., O'Toole T.M., Wheeler T.S., J. Chem. Soc. 1952 (6) 2063.
32.Уилер Т., Синтезы органических препаратов, Москва: Изд-во иностранной литературы, 1953, с. 516.
33.Юрьев Ю.К., Магдесиева Н.Н., Титов В.В., ЖОрХ 1965 1 163.
34.Jain A.C., Mathur S.K., Seshadri T.R., J. Sci. Ind. Research B (India) 1962 21 214.
35.Rama Rao A.V., Telang S.A., Nair P.M., Indian J. Chem. 1964 2 (11) 431.
36.Srimannarayana G., Subba Rao N.V., Indian J. Chem. 1968 6 (12) 696.
37.Subba Rao A.V., Subba Rao N.V., Curr. Sci. 1966 35 (6) 149.
38.Grover S.K., Jain A.C., Mathur S.K., Seshadri T.R., Indian J. Chem. 1963 1
(9)382.
39.Recordati S.F., Ital. Patent 6 410 430; Chem. Abstr. 1965 63 9917e.
40.Looker J.H., Edman J.R., Dappen J.I., J. Heterocycl. Chem. 1964 1 (3) 141.
41.Allan J., Robinson R., J. Chem. Soc. 1924 125 2192.
42.Gripenberg J., in The Chem. of Flavonoid Compounds, Geissman T.A., Ed., London: Pergamon Press, 1962, p. 411.
43.Baker W., F1emons G.F., Winter R., J. Chem. Soc. 1949 (6) 1560.
44.Kuhn R., Low I., Ber. Bunsen-Ges. Phys. Chem. 1944 77 196.
45.Szell T., Dozsai L., Zarandy M., Menyharth K., Tetrahedron 1969 25 715.
46.Huffmann K.R., Kuhn C.E., Zweig A., J. Am. Chem. Soc. 1970 92 (3) 599.
47.Banerji K.D., Poddar D., J. Indian Chem. Soc. 1976 53 (11) 1119.
48.Thakar K.A., Muley P.R., Indian J. Chem. 1976 50 (12) 3298.
Избранные методы синтеза и модификации гетероциклов, том 2 |
203 |

49.Ruhemann S., Ber. Bunsen-Ges. Phys. Chem. 1913 46 2188.
50.Bogert S., Marcus J., J. Am. Chem. Soc. 1919 41 83.
51.Gottesmann A., Ber. Bunsen-Ges. Phys. Chem. 1933 66 1168.
52.Seka R., Prosche G., Monatsh. Chem. 1936 69 284.
53.Simonis H., Remmert P., Ber. Bunsen-Ges. Phys. Chem. 1914 47 2229.
54.Mentzer C., Pillon D., Compt. Rend. 1952 234 444.
55.Pillon D., Bull. Soc. Chim. Fr. 1954 (1) 9.
56.Pillon D., Bull. Soc. Chim. Fr. 1955 (1) 39.
57.Pillon D., Massicot J., Bull. Soc. Chim. Fr. 1954 (1) 26.
58.Pacheco H., Gatto R., Bull. Soc. Chim. Fr. 1960 (1) 95.
59.Teoule R., Bull. Soc. Chim. Fr. 1959 (2) 423.
60.Teoule R., Grenier G., Pacheco H., Chopin J., Bull. Soc. Chim. Fr. 1961 (3) 546.
61.Adams J.H., J. Org. Chem. 1967 32 3992.
62.Limaye S.D., Limaye D.B., Rasayanam 1952 2 (2) 41; Chem. Abstr. 1953 47 4879.
63.Marathe K.G., J. Univ. Poona Sci. Technol. 1958 14 63; Chem. Abstr. 1960 54
3402.
64.Litkei Gy., Bognar R., Dinya Z., Acta Chim. Acad. Sci. Hung. 1972 71 (4) 403.
65.Kesselkaul L., Kostanecki S., Ber. Bunsen-Ges. Phys. Chem. 1886 29 1896.
66.Nadkarni D.R., Wheeler T.S., J. Chem. Soc. 1938 (11) 1320.
67.Tambor J., Ber. Bunsen-Ges. Phys. Chem. 1916 49 1704.
68.Motwani D.C., Wheeler T.S., J. Chem. Soc. 1935 (10) 1098.
69.Litkei Gy., Bognar R., Acta Phys. Chim. Debrecina 1971 (3) 239.
70.Chhaya G.S., Trivedi P.L., Jadhav G.V., J. Univ. Bombay, Sect. A 1958 27 26;
Chem. Abstr. 1960 54 8807.
71.Kutumbe K.R., Marathey M.G., Ber. Bunsen-Ges. Phys. Chem. 1963 96 913.
72.Seshadri T.R., in The Chem. of Flavonoid Compounds, Geissman T.A., Ed., London: Pergamon Press, 1962, p. 161.
73.Donnelly D.J., Donnelly J.A., Murphy J.J., et al., Chem. Commun. 1966 12 351.
74.Mahal H.S., Rai H.S., Venkataraman K., J. Chem. Soc. 1935 (9) 866.
75.Wadodkar P.N., Indian J. Chem. 1963 1 163.
76.Джоши Уша Г., Амин Г.С., Изв. АН СССР, Отд. хим. наук 1960 2 267.
77.Donnelly J.A., Doran H.J., Murphy J.J., Tetrahedron 1973 29 (7) 1037.
78.Annigeri A.C., Siddappa S., Indian J. Chem. 1964 2 (10) 413.
79.Annigeri A.C., Siddappa S., Monatsh. Chem. 1965 96 (2) 625.
80.Kumari S.S., Krishna K.S.R., Mohan Rao A.V., Subba Rao N.V., Curr. Sci. 1967 36 (16) 430.
81.Corvaisier A., Bull. Soc. Chim. Fr. 1962 (3) 528.
82.Hoshino Y., Oohinata T., Takeno N., Bull. Chem. Soc. Jpn. 1986 59 (7) 2351.
83.Hoshino Y., Oohinata T., Takeno N., J. Chem. Soc. Jpn. 1985 11 2104.
84.Doshi A.G., Soni P.A., Ghiya B.J., Indian J. Chem., Sect. B 1986 25 (7) 759.
85.Хиля В.П., Грабовская В.В., Бабичев Ф.С., ХГС 1975 (8) 1146.
86.Гришко Л.Г., Грабовская В.В., Марчук Л.А., Хиля В.П., Докл. АН УССР,
Сер. Б 1978 (5) 428.
87.Гришко Л.Г., Туров А.В., Потрусаева И.А., Хиля В.П., Укр. хим. журн. 1983
49 (2) 174.
88.Гришко Л.Г., Туров А.В., Спасенов М.Г., Хиля В.П., ХГС 1981 (9) 1202.
89.Хиля В.П., Аль Буди Х., Айтмамбетов А. и др., ХГС 1992 (7) 879.
204 |
Серия научных монографий InterBioScreen |

90.Grishko L., Turov A., Khilya V., et al., Acta Chim. Hung. 1983 112 (4) 401.
91.Хиля В.П., Айтмамбетов А., Туров А.В. и др., ХГС 1986 (2) 192.
92.Algar J., Flynn J.P., Proc. Roy. Irish Acad. B 1934 42 1.
93.Oyamada T., J. Chem. Soc. Jpn. 1934 55 1256.
94.Annigeri A.C., Siddappa S., J. Karnatak. Univ. 1964–1965 9–10 21; Chem. Abstr. 1966 64 9676h.
95.Raut K.B., Wender S.H., J. Org. Chem. 1960 25 50.
96.Corvaisier A., Tirouflet J., Compt. Rend. 1960 251 1641.
97.Venturella P., Bellino A., Piozzi F., Farmaco Ed. Sci. 1971 26 (7) 591.
98.Summins B., Donnelly D.M.X., Philbin E.M., et al., Chem. Ind. 1960 348.
99.Summins B., Donnelly D.M.X., Eades J.F., et al., Tetrahedron 1963 19 (4) 499.
100.Geissman T.A., Fukushima D.K., J. Am. Chem. Soc. 1948 70 1686.
101.Balakrishna K.J., Seshadri T.R., Viswanath G., Proc. Indian Acad. Sci. A 1949 30 120.
102.Wheeler T.S., Record Chem. Progr. 1957 18 133.
103.Simpson T.H., Whalley W.B., J. Chem. Soc 1955 (1) 166.
104.Christian С.М., Amin G.C., Acta Chim. Acad. Sci. Hung. 1959 21 391; Сhem. Аbstr. 1960 54 22б07.
105.Amad W.I., El.-Neweihy M.F., Selim S.F., J. Org. Chem. 1960 25 1333.
106.Reichel L., Hempel G., Ann. 1959 625 184.
107.Kostanecki S., Szabranski W., Ber. Bunsen-Ges. Phys. Chem. 1904 37 2634.
108.Nakagawa K., Tsukahima H., J. Chem. Soc. Jpn. (Nippon Kagaku Zasshi) 1954 75
485; Chem. Abstr. 1957 51 11339f.
109.Schönberg A., Schutz G., Ber. Bunsen-Ges. Phys. Chem. 1960 93 1466.
110.Singh O.V., Kapoor R.P., Tetrahedron Lett. 1990 31 (11) 1459.
111.Prakash O., Pahuja S., Synth. Commun. 1990 20 (10) 1417.
112.Takeno N., Fukushima T., Takeda S., Kishimoto K., Bull. Chem. Soc. Jpn. 1985 58
(5) 1599.
113.Augstein J., Cairns H., Hunter D., King J., Brit. Patent 2 142 527; Chem. Abstr. 1972 77 5488g.
114.Augstein J., Cairns H., Hunter D., King J., Brit. Patent 2 142 556; Chem. Abstr. 1972 77 5475h.
115.Peel M.E., Oxford Al.W., Brit. Patent 2 111 145; Chem. Abstr. 1972 76 3864q.
116.Hennart C., Fr. Patent 1 488 223; Сhem. Аbstr. 1968 69 36130f.
117.Дорофеенко Г.Н., Межерицкий В.В., Лопатина Н.А., ХГС 1971 (8) 1112.
118.Дорофеенко Г.Н., Ткаченко В.В., Межерицкий В.В., ХГС 1975 (4) 465.
119.Дорофеннко Г.Н., Ткаченко В.В., ЖОрХ 1972 8 (10) 2188.
120.Дорофеенко Г.Н., Ткаченко В.В., Межерицкий В.В., ЖОрХ 1976 12 432.
121.Ищенко В.В., Носиченко Е.И., Фальковская О.Т., Хиля В.П., ХГС 1995 (3) 322.
122.Ищенко В.В., Шуляк Т.С., Хиля В.П., ХГС 2002 (3) 306.
Избранные методы синтеза и модификации гетероциклов, том 2 |
205 |
Илиды серы в синтезе гетероциклических соединений
Карцев В.Г.1, Лакеев С.Н.2, Майданова И.О.2, Галин Ф.З.2, Толстиков Г.А.3
1InterBioScreen
119019, Москва, а/я 218
2Институт органической химии Уфимского научного центра РАН 450054, Уфа, просп. Октября, 71 3Новосибирский Институт органической химии им. Н.Н. Ворожцова Сибирского отделения РАН 630090, Новосибирск, просп. акад. Лаврентьева, 9
Введение
Поиск новых реакционноспособных синтонов для целенаправленного синтеза гетероциклических соединений остается актуальной задачей. В этой связи весьма перспективным представляется направление, связанное с использованием для синтеза гетероциклов реакционноспособных соединений – илидов серы. Илиды серы – соединения, в которых отрицательно заряженный атом углерода непосредственно связан с положительно заряженным атомом серы. В общем виде они могут быть представлены двумя резонансными структурами – илидной 1 и илено-
вой 2 [1].
+ S |
− |
S |
|
1 |
2 |
Большинство илидов серы вполне доступны. Основными методами их получения являются депротонирование сульфониевых солей [2] и взаимодействие сульфидов с диазосоединениями в присутствии катализаторов [2–5]. Илиды серы генерируют либо in situ, либо применяют заранее полученные индивидуальные соединения. Стабилизация илидов достигается за счет делокализации электронной плотности под действием электроноакцепторных заместителей у карбанионного центра [6, 7].
Наибольшее распространение в органическом синтезе получили реакции илидов серы с соединениями, содержащими С=Х связи (Х = О, С, N). Реакция протекает как нуклеофильное присоединение с последующим 1,3-элиминирова- нием серусодержащей группы и образованием соответствующих эпоксида, циклопропана или азиридина. Данные по этим реакциям подробно освещены в монографии Троста [2] и обзорах [8–13].
В последние годы илиды серы успешно используются в синтезе и модификации гетероциклических соединений с числом атомов в цикле более трех. Как правило, реакции протекают в относительно мягких условиях, с высокой стерео- и
206 |
Серия научных монографий InterBioScreen |
региоселективностью и во многих случаях по препаративной ценности превосходят известные классические методы синтеза гетероциклов. Единственная обзорная статья на эту тему рассматривает публикации до 1985 г. [10]. В работе представлены наиболее интересные литературные данные последних 15 лет по использованию илидов серы в синтезах гетероциклических соединений, систематизированные по типам образующихся гетероциклов. Из рассмотрения авторами исключены реакции илидов, приводящие к образованию трехчленных гетероциклов.
1. Серусодержащие гетероциклы
Цвиттерионный характер сульфониевых илидов определяет их широкое использование в перегруппировочных процессах, позволяющих формировать новые С-С связи часто с высокой стерео- и региоселективностью. В синтезах гетероциклических соединений наибольшее синтетическое применение находят 1,2-пере- группировки Стивенса [3, 14] и 2,3-сигматропные перегруппировки [3, 13–16] циклических илидов серы. Использование перегруппировок илидов серы в синтезе циклических соединений стало особенно перспективным в связи с развитием карбенового метода генерирования циклических сульфоилидов. Образование илидов происходит за счет электрофильного присоединения к атому серы карбеноидной частицы, генерируемой из диазогруппы под действием соединений переходных металлов (преимущественно Rh или Cu) [3].
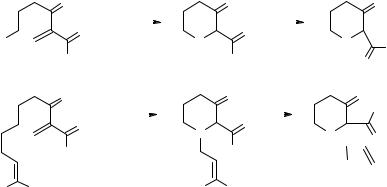
Так, замещенные шести-семичленные циклические тиоэфиры 3a–e получены при термической перегруппировке илидов серы с выходами 40–60% [17, 18]. Илиды генерировали внутримолекулярной циклизацией диазосульфидов 4а–е в присутствии ацетата родия. В случае бензильного заместителя при атоме серы продукт 3а образуется в результате 1,2-сдвига, тогда как продукты 3b–е c аллильным заместителем образуются в результате 2,3-сигматропной перегруппировки (схема 1).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Схема 1 |
( ) |
O |
|
Rh2(OAc)4 |
( ) |
|
O |
|
|
∆ |
( ) |
|
|
|
O |
|||||
n |
|
|
|
|
|
n |
− |
|
|
|
|
n |
|
|
|
Bn |
|||
BnS N2 |
O |
|
∆ |
|
+ |
O |
|
S |
|
|
|
||||||||
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
S |
|
|
|
|
|
|
|
|
|
OEt |
||||
OEt |
|
|
|
|
|
|
OEt |
|
|
|
|||||||||
4a |
|
|
|
|
Bn |
|
3a |
O |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
( ) |
O |
Rh2(OAc)4 |
( ) |
|
O |
|
|
∆ |
( ) |
|
|
O |
|||||||
n |
|
|
|
|
|
n |
− |
|
|
|
|
n |
|
|
OEt |
||||
N2 |
O |
|
∆ |
|
+ |
O |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
S |
|
|
|
|
|
S |
|
|
|
O |
||||
|
OEt |
|
|
|
|
|
|
OEt |
R |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
R' |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
R |
R' |
|
|
|
|
|
|
|
|
|
|
|
|
R4b−eR' b R = R' = H, n = 2; c R = R' = Me, n = 1; |
|
|
|
|
|
3b−e |
|||||||||||||
|
d R = Ph, R' = H, n = 2; e R = Me, R' = H, n = 2 |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Избранные методы синтеза и модификации гетероциклов, том 2 |
207 |
||||||||||||||||||
Замещенные 1,3-дитианы 5 синтезированы 1,2-перегруппировкой 1,2-дитио- лановых илидов 6, протекающей с разрывом связи S-S [19]. Если циклические дисульфиды содержат более четырех заместителей, в илидах 6 может происходить разрыв связи С-S. Последующее десульфирование интермедиатов 7 приводит к тиетанам 8 (схема 2).
R2 |
|
|
|
R3 |
|
R4 |
|
|
|
|
|
|
R2 |
|
R3 |
||||||||||
|
|
|
|
|
|
|
|
|
N2CR62 |
|
|
|
|
|
|
|
R4 |
||||||||
R1 |
|
|
|
|
|
|
|
|
|
R5 |
|
R1 |
|
|
S+ |
|
|
|
R5 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
S |
|
S |
|
|
|
|
|
|
hν или кат. |
R6 |
− |
|
S |
|||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R6 |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R3 |
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|||
|
|
|
|
R2 |
|
|
R4 |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
R1 |
|
|
|
|
|
|
|
R5 |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
S |
|
|
|
|
S |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
R6 |
5 |
|
R6 |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R2 |
|
R3 |
|
R4 |
R2 |
R3 |
|
R4 |
|
|
|
|
||||||||||
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|||||||||||||
|
|
|
R1 |
|
|
|
R5 |
R1 |
|
|
R5 |
|
−R62C=S |
||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
:S |
|
S |
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
S |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
R6 |
|
|
|
|
R6 |
|
− |
|
|
|
|
|
||||||||
|
|
|
|
|
|
− |
R6 |
R6 |
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7 |
|
|
|
|
|
|
|
|
|
Схема 2
R3
R2 R4 R1 S R5
S R5
8
Предложен мягкий и эффективный метод синтеза 3-аллилизотиохроман-4-она 9 2,3-сигматропной перегруппировкой циклического илида серы 10, образующегося при внутримолекулярной циклизации диазосульфида 11 под действием родиевого катализатора [20] (схема 3).
Схема 3
O |
O |
|
O |
N2 |
[Rh] |
− |
~2,3 |
S |
|
S+ |
S |
11 |
10 |
|
9 |
208 |
Серия научных монографий InterBioScreen |
Для синтеза макроциклических серусодержащих соединений перспективным является метод, основанный на 2,3-сигматропных перегруппировках циклических аллилсульфониевых илидов, которые протекают с расширением цикла [15, 21].
Так, синтез производного тиациклоундека-4,7-диена 12, предшественника агликона макролидного антибиотика метимицина – метинолида 13, осуществлен исходя из тетразамещенного тиолана 14 [22–24]. Перегруппировка илида 15, полученного из соли 16, дает тиациклооктен 17, из которого в несколько стадий синтезируют илид 18. Последующая стереоселективная 2,3-сигматропная перегруппировка илида 18 приводит к (Z)-тиациклоундекадиену 13 (схема 4).
Схема 4
RO |
|
RO |
|
|
|
RO |
|
|
a |
|
+ |
|
b |
|
|
S |
|
|
− |
|
+ |
|
|
|
|
S OTf |
|
S |
O |
||
|
|
|
O |
|
|
− |
|
|
|
|
OEt |
|
|
OEt |
|
14 |
|
|
16 |
|
|
15 |
|
|
OR |
|
|
|
OR |
c |
OR |
|
|
|
|
|
|
|
|
O |
|
|
S |
|
|
S+ |
|
S |
|
|
|
|
|
||
OEt |
|
|
|
|
|
− |
O |
17 (36%) |
|
|
|
|
18 |
Et |
|
|
|
|
|
|
|||
|
|
|
|
|
|
O |
|
|
|
OR |
... |
|
|
|
OH |
|
|
|
|
|
|
|
|
|
S |
|
|
|
|
O |
|
O |
Et |
|
|
|
|
HO Et |
O |
|
|
|
|
|
|
||
|
12 (89%) |
|
Tf = F3CSO2 |
|
13 |
|
|
|
|
|
|
|
|
||
a - TfOCH2CO2Et; b - K2CO3; c - TfOCHMeCOEt, K2CO3
2,3-Cигматропная перегруппировка бициклических аллилсульфониевых илидов, приводящая к производным тиабицикло[6,3,1]-ундец-3-ена 19, использована этими же авторами в полном синтезе цитохалазинов [25, 26]. Исходным веществом
Избранные методы синтеза и модификации гетероциклов, том 2 |
209 |

послужил винильный иодид 20. Ключевой стадией в этом синтезе является перегруппировка илида 21, полученного из сульфониевой соли 22 при ее обработке поташом (схема 5).
Схема 5
|
SiMe3 |
|
|
|
|
I− |
|
|
|
|
|
|
|
|
|
I |
MeCN |
|
S + |
K2CO3 |
|
OAc S |
70°C |
AcO |
|
||
Ph |
|
|
|
|||
|
|
|
|
|
||
|
N |
|
|
|
O |
|
Ac |
O |
|
|
|
|
|
O |
|
|
|
|
||
|
20 |
|
|
22 |
|
|
|
|
|
|
|
||
|
|
|
|
|
SiMe3 |
|
|
AcO |
S+ |
− |
|
OAc |
|
|
|
|
Ph |
S |
||
|
|
|
|
|||
|
|
|
O |
|
N |
|
|
|
|
Ac |
O |
|
|
|
|
|
|
O |
||
|
|
21 |
|
|
19 (65%) |
|
|
|
|
|
|
||
Осуществлен синтез труднодоступных бициклических непредельных дисульфидов 23, 24 с мостиковой двойной связью, так называемых битвинаненовых структур [27, 28]. При нагревании дитиокеталя 25 с диазоацетатом в присутствии CuSO4 получается илид 26, который в результате 2,3-сигматропной перегруппировки образует два геометрических изомера 23 и 24 в соотношении 4 : 1 (схема 6).
Схема 6
|
O |
O R' |
|
O |
|
R' |
O |
O R' |
|
|
|
R |
|||||
S S |
|
− |
|
|
|
O |
||
R |
|
|
|
|
||||
+ |
|
S |
R |
|
|
S |
||
a |
|
SS |
~ 2,3 |
+ 8( |
) |
|||
( )8 |
|
|
|
( )8 |
|
|
||
( |
)8 |
|
S |
|
|
|
S |
|
25 |
26 |
|
23 |
|
|
|
24 |
|
a - N2C(R)CO2R', CuSO4, ∆ |
|
|
|
|
|
|||
210 |
Серия научных монографий InterBioScreen |
