
Карцев В.Г. - Избранные методы синтеза и модификации гетероциклов. Том 2 (2003)(ru)
.pdf
Схема 40
|
|
|
|
|
|
|
MeO |
|
|
O |
|
MeO |
O |
|
|||
S |
|
|
|
+ |
|
|
− O |
+ |
O− |
||||||||
N2C(CO2Me)2 |
|
S |
|
|
|
|
|
|
S |
|
|
||||||
|
|
|
|
|
|
OMe |
|
|
OMe |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
Rh2(OAc)4 |
|
|
|
|
|||||||||||
t-Bu Bu-t |
t-Bu |
Bu-t |
t-Bu |
Bu -t |
|||||||||||||
|
|
|
|
||||||||||||||
158 |
|
|
|
|
|
|
|
|
|
|
|
|
159 |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
O |
|
|
|
|
|||||
|
|
|
|
|
|
|
MeO |
|
|
|
|
S |
Bu -t |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
MeO |
|
|
|
|
O |
Bu -t |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
O |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
160 |
|
|
|
|
|||||
Новый тип циклизации аминозамещенного тиокарбонильного илида 161 (схема 41), описанный в работе [82], открывает путь к 1,6-дитиа-3,9-диазаспиро- [4,4]нон-2-енам 162.
Схема 41
|
|
|
|
|
|
|
O |
N |
+ |
O |
толуол, ∆ |
N |
S |
OMe |
|
|
S |
− |
|
S |
N |
OMe |
|
|
S H |
|
OMe |
|
|
||
|
N |
|
|
|
Ph |
O |
|
|
Ph |
|
OMe |
|
|
|
|
|
|
|
|
|
|
||
|
O |
|
|
|
|
162 |
|
|
161 |
|
|
|
|
|
|
Необычная реакция внутримолекулярной циклизации происходит при взаимодействии тиокарбонильного илида 163 с тиоацетамидом 164 [83]. Первоначально образующийся аддукт 165 циклизуется в 2-тиа-4-азабицикло[3,1,1]гепт-2-еновое производное 166 (схема 42). Это первый пример нуклеофильного присоединения к карбонильной группе производного циклобутанона, протекающее без раскрытия четырехчленного кольца.
Избранные методы синтеза и модификации гетероциклов, том 2 |
231 |

|
|
|
|
|
Схема 42 |
|
+ |
S |
S |
S |
S R |
O |
S − |
+ |
O |
|
N |
|
CH |
R NH2 |
S |
|
|
|
|
2 |
|
|
OH |
|
|
|
HN |
R |
|
|
|
|
|
||
|
163 |
164 |
165 |
|
166 (64%) |
|
R = Me, Ph |
|
|
|
|
Анализ литературы показывает, что последние годы характеризуются быстрым переходом от изучения сравнительно простых реакций илидов серы к более сложным превращениям. Мы полагаем, что в ближайшем будущем лидирующим направлением использования илидов в синтетической химии гетероциклических соединений может стать полный синтез природных продуктов и их биологически активных синтетических аналогов, а также получение новых соединений уникального строения. Особого внимания заслуживают реакции илидов, позволяющие синтезировать алкалоиды и алколоидоподобные соединения, многие из которых занимают все более значительное место среди лекарственных препаратов онкологического и кардиологического направления. Не исключено, что среди серуорганических гетероциклических соединений, получаемых илидными методами, будут обнаружены новые биологически активные вещества.
Анализ публикаций и патентов последних лет обнаруживает многообразие биологически активных серуорганических гетероциклов как по химическим классам, так и по спектру биологической активности. В таблице 1 приводятся некоторые примеры таких соединений из нескольких сот, представленных в базе данных WDA, DERWENT-2000 [84], а также описание видов проявляемых ими биологической активности и механизмов действия.
Таблица 1. Примеры биологической активности различных классов серусодержащих гетероциклов и механизмы их действия
Формула |
|
|
|
Вид |
Механизм |
Название |
Лит. |
|
|
|
|
активности |
действия |
|
|
|
|
|
|
|
|
|
|
O O |
|
|
|
Antibacterial, |
Cytochrome- |
Thiethazole |
[85] |
S |
|
|
|
immuno- |
P450-inhibitor, |
|
|
O |
|
|
|
suppressive, |
antioxidant |
|
|
− |
|
+ |
cytostatic, |
|
|
|
|
N |
O |
K |
|
antianemic |
|
|
|
S |
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
232 |
Серия научных монографий InterBioScreen |
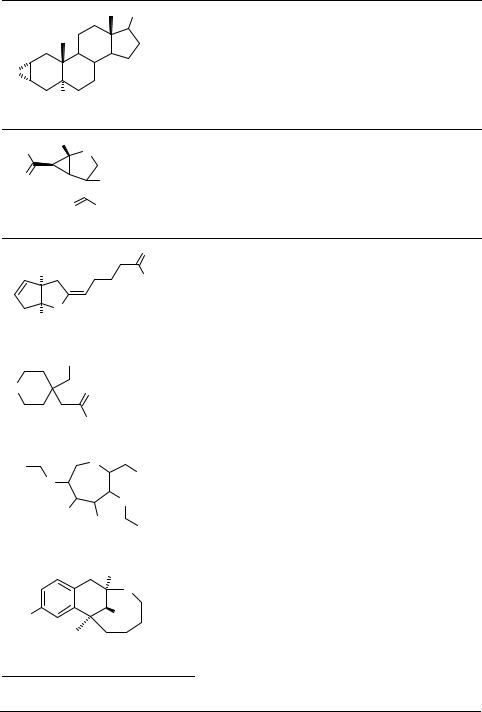
Таблица 1. Продолжение
OH Osteopathic Mepitio- [86] stane,
Epitio-
stanol
S
H
H
HO S
O H
 NH2 O OH
NH2 O OH
Neuroprotec- Glutamate- tive, cerebro- agonist-2, protective Glutamate-
agonist-3
LY- [87] 379268,
LY389795
|
|
|
|
O |
Antiulcer |
Gastric- |
WD-94- |
[88] |
|
H |
|
|
OH |
|
secretion- |
013318 |
|
|
|
|
|
|
inhibitor |
|
|
|
|
H |
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH2 |
|
Anticonvulsant, |
Gabaminergic |
WD-97- |
[89] |
|
S |
|
|
O |
|
nootropic, |
|
010381 |
|
|
|
|
antidepressant, |
|
|
|
||
|
|
|
|
|
tranquilizer, |
|
|
|
|
|
|
OH |
|
analgesic, |
|
|
|
|
|
|
|
|
antiparkinsonic |
|
|
|
|
|
|
|
|
|
|
|
|
Ph |
|
|
S |
Ph |
Anti-HIV |
HIV-protease- |
WD-98- |
[90] |
|
O |
|
|
|
inhibitor |
011946 |
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
O |
|
|
|
|
|
|
OH |
Ph |
|
|
|
|
||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
Analgesic, |
Opioid-Mu |
WD-98- |
[91] |
|
|
|
|
S |
neuroprotec- |
|
004406 |
|
HO |
|
|
NH2 |
tive |
|
|
|
|
|
|
|
|
|
|
|||
Здесь и далее: Derwent WDA №
Избранные методы синтеза и модификации гетероциклов, том 2 |
233 |
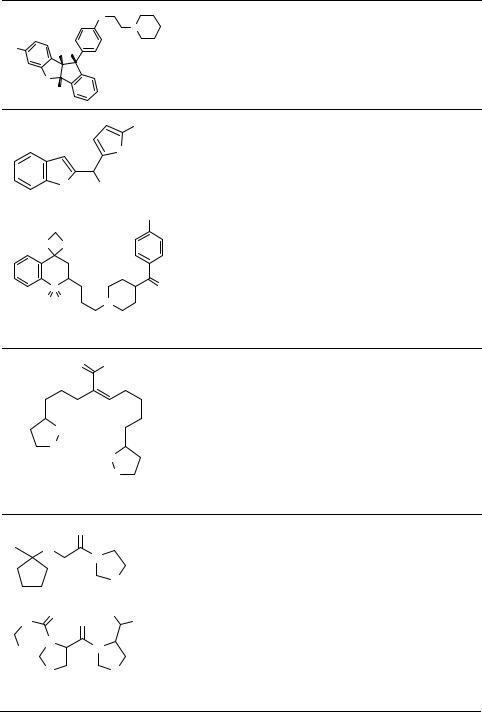
Таблица 1. Продолжение
O
N
HO |
H H |
|
S
H
Endocrine, |
Estrogen- |
WD-98- |
[92] |
antilipemic, |
antagonist |
004113 |
|
cytostatic, |
|
|
|
vasotropic |
|
|
|
|
Cl |
|
Nootropic, |
Amyloid- |
WD-99- |
[93] |
|
S |
|
neuroprotect- |
protein- |
006545 |
|
|
|
tive |
antagonist-β |
|
|
|
S |
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
F |
|
Cardiovascular, |
Antisero- |
WD-97- |
[94] |
S S |
|
|
cerebroprotec- |
tonin-2 |
000100 |
|
|
|
tive, cardiant, |
|
|
|
|
|
|
|
vasotropic, |
|
|
|
S |
|
O |
antiarrhyth- |
|
|
|
N |
mic, antiarte- |
|
|
|
||
O O |
|
riosclerotic, |
|
|
|
|
|
|
|
|
|
|
hypotensive, antiinflamatory
O OH
S
S
S
S
Cytoprotectant, Antioxidant, WD-2000- [95] hypotensive, nitric-oxide 007640 antiasthmatic, antagonist
tranquilizer, neuroprotective, anti-HIV, antacid, antiinflammatory, antiulcer, nephrotropic
|
OH |
H |
O |
Antidiabetic |
Dipeptidyl- |
WD-2000- [96] |
|
|
|
N |
N |
|
peptidase- |
011473 |
|
|
|
|
|
||||
|
|
|
|
inhibitor-IV |
|
|
|
|
|
|
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
O |
OMeO |
OMe Nootropic |
Vasopressin- |
ZTTA-1 |
[97] |
|
|
N |
|
|
agonist |
|
|
|
Ph |
N |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
S |
S |
|
|
|
|
234 |
Серия научных монографий InterBioScreen |

Таблица 1. Продолжение
|
|
|
O |
OH |
Hypotensive, |
ACE-inhibitor, |
ER-32935 |
[98] |
|
|
|
H |
diuretic |
neutral- |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
S |
|
endopeptidase- |
|
|
|
O |
|
N |
|
inhibitor |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
N |
O |
|
|
|
|
|
|
|
H |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
SH |
|
|
|
|
|
|
|
|
|
|
HN |
NH2 |
Anticoagulant |
Thrombin- |
WD-97- |
[99] |
|
H |
|
|
NH |
|
inhibitor |
012035 |
|
|
|
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
Ph |
O O |
N |
|
N |
|
|
|
|
|
|
H |
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
Immuno- |
Tyrosine- |
WD-98- |
[100] |
|
|
|
|
|
suppressive |
kinase- |
011590 |
|
S |
N |
|
|
|
|
inhibitor |
|
|
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
OMe |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ph |
|
MeO |
OMe |
Cardiovascular, |
Calcium- |
Ho-7 |
[101] |
|
|
|
|
|
inotropic |
antagonist |
|
|
S |
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
S |
N |
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
H |
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
Endocrine-Gen. |
Tyrosine- |
WD-97- |
[102] |
|
|
|
|
|
kinase- |
001705 |
|
|
|
|
|
|
|
|
|
||
|
|
N |
|
N |
|
inhibitor |
|
|
S
S
Избранные методы синтеза и модификации гетероциклов, том 2 |
235 |
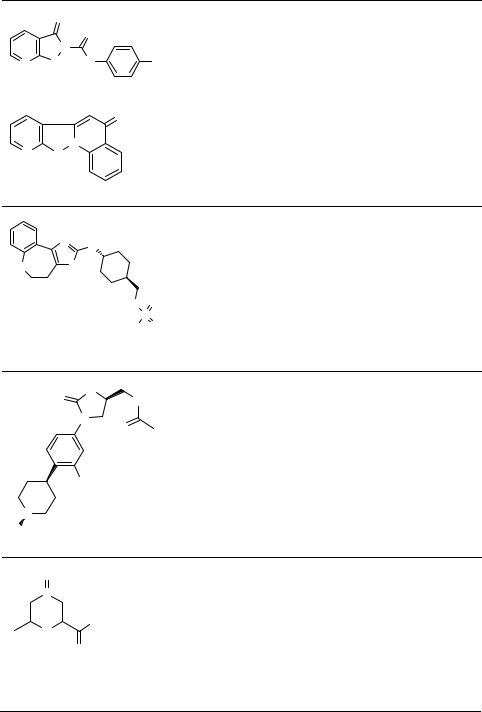
Таблица 1. Продолжение
|
O |
O |
Cytostatic |
NADH- |
WD-98- |
[103] |
|
N |
|
oxidase- |
012067 |
|
|
N |
N |
Cl |
inhibitor |
|
|
|
S |
|
|
|
|||
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
Antiarthritic |
Interleukin- |
WD-94- |
[104] |
|
S N |
|
|
1-β-inhibitor |
002888 |
|
N |
|
|
|
|
|
N H N
S S
HN O
S
R O
Vasotropic, |
Neuropepti- |
WD-2000- [105] |
antiinfertility, |
dea-antago- |
013369 |
antidepressant, |
nist-Y5 |
|
anticonvulsant, |
|
|
hypotensive, |
|
|
cerebropro- |
|
|
tective, hemo- |
|
|
static, cardiant, |
|
|
sedative |
|
|
O |
O |
NH |
Antibacterial |
Protein- |
PNU- |
[106] |
|
|
synthesis- |
177780, |
|
||
|
N |
|
|
|
||
|
O |
|
inhibitor |
PNU- |
|
|
|
|
|
|
176797 |
|
|
|
|
|
|
|
|
F
−O S+
O
S
N
OH
H O
Antilipemic, |
MTP-inhibitor, |
WD-99- |
[107] |
antiarterio- |
VLDL- |
016459 |
|
sclerotic |
antagonist |
|
|
236 |
Серия научных монографий InterBioScreen |
Таблица 1. Продолжение
|
H |
O |
O |
|
|
Anti-inflam- |
Elastase- |
PNU- |
[108] |
|
|
S |
|
|
matory |
inhibitor |
156575 |
|
|
O |
N |
|
S |
N N |
|
|
|
|
|
|
O |
|
N |
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
O |
Cardiant, |
Vasopepti- |
BMS- |
[109] |
|
|
|
|
O |
S |
H |
hypotensive |
dase-inhibitor |
198433, |
|
HS |
|
|
|
N |
|
|
|
BMS- |
|
|
|
N |
|
|
|
253653 |
|
||
|
|
|
|
|
|
|
|||
Ph |
|
|
H |
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
HO |
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
NH2 |
|
|
|
|
Anti-HIV |
HIV-Protease- |
GS-4234, |
[110] |
|
|
|
|
|
|
|
|
inhibitor-1 |
GS-4263 |
|
|
|
O |
O |
|
|
|
|
|
|
|
|
S O |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
O |
O |
|
|
|
|
|
NH2
OH |
OH |
Antidiabetic |
Hypoglycemic Kotalanol [111] |
HO |
|
|
|
S+ |
OH |
OH |
|
|
|
|
|
O |
|
OH |
|
O S |
O |
|
|
|
|
||
O |
HO |
OH |
|
|
|
|
Избранные методы синтеза и модификации гетероциклов, том 2 |
237 |

Литература
1.Джонсон А., Химия илидов, М.: Мир, 1969 [Jonson A., Ylid Chemistry, New York–London: Acad. Press., 1966].
2.Trost B.M., Melvin L.S., Sulfur Ylides, Emerging Synthetic Intermediates, New York–San-Francisco–London: Acad. Press, 1975.
3.Ye T., McKervey A., Chem. Rev. 1994 94 1091.
4.Adams J., Spero D.M., Tetrahedron 1991 47 1765.
5.Padwa A., Hornbuckle S.F., Chem. Rev. 1991 91 263.
6.Белкин Ю.В., Полежаева Н.А., Успехи химии 1981 50 909.
7.Садеков Н.Д., Минкин В.И., Семенов В.В., Успехи химии 1981 50 813.
8.Block E., in The Chemistry of Sulfonim Group, Stirling C.J.M., Patai S., Eds., New York, 1981, p. 673.
9.Jonson C.R., Acc. Chem. Res. 1973 6 341.
10.Магдесиева Н.Н., Сергеева Т.А., ХГС 1990 147.
11.Romo D., Romine J.L., Midura W., Meyers A.I., Tetrahedron 1990 46 4951.
12.Romo D., Meyers A.I., Tetrahedron 1991 47 9503.
13.Li An-Hu, Dai Li-Xin, Aggarwal V.K., Chem. Rev. 1997 97 2341.
14.Marko I.E., in Comprehensive Organic Synthesis, Trost B.M., Fleming I., Pattenden G., Eds., Oxford: Pergamon Press, 1991, p. 913.
15.Vedejs E., Acc. Chem. Res. 1984 17 358.
16.Meyer O., Cagle P.C., Weickhardt K., et al., Pure Appl. Chem. 1996 68 79.
17.Moody C.J., Taylor R.J., Tetrahedron Lett. 1988 29 6005.
18.Moody C.J., Taylor R.J., Tetrahedron 1990 46 6501.
19.Ando W., Kumamoto Y., Takata T., Tetrahedron Lett. 1985 26 5187.
20.Padwa A., Hornbuckle G.E., Fryxell G.E., Stull P.D., J. Org. Chem. 1989 54 817.
21.Vedejs E., Hagen J.P., J. Am. Chem. Soc. 1975 97 6878.
22.Vedejs E., Buchanan R.A., Conrad P.C., et al., J. Am. Chem. Soc. 1987 109 5878.
23.Vedejs E., Buchanan R.A., Conrad P.C., et al., J. Am. Chem. Soc. 1989 111 8421.
24.Vedejs E., Buchanan R.A., Watanabe Y., J. Am. Chem. Soc. 1989 111 8430.
25.Vedejs E., Fedde C.L., Schwartz C.E., J. Org. Chem. 1987 52 4269.
26.Vedejs E., Reid J.G., Rodgers J.D., Wittenberger S.J., J. Am. Chem. Soc. 1990 112 4351.
27.Nickon A., Rodriguez A.D., Ganguly R., Shirhatti V., J. Org. Chem. 1985 50 2767.
28.Cere V., Paolucci C., Pollicino S., et al., J. Org. Chem. 1981 46 486.
29.Sashida H., Tsuchiya T., Chem. Pharm. Bull. Jpn. 1986 34 3644.
30.Tanzawa T., Shirai N., Sato Y., et al., J. Chem. Soc. Perkin Trans. 1 1995 2845.
31.Kataoka T., Kataoka M., Ikemori M., et al., J. Chem. Soc. Perkin Trans. 1 1993 1973.
32.Hori M., Kataoka T., Shimizu H., et al., J. Org. Chem. 1987 52 3668.
33.Buter J., Wassenwaar S., Kellog R.M., J. Org. Chem. 1973 37 4045.
34.Middleton W.J., J. Org. Chem. 1966 31 3731.
35.Herstroeter W.G., Schults A.G., J. Am. Chem. Soc. 1984 106 5553.
36.Hamaguchi M., Funakoshi N., Oshima T., Tetrahedron Lett. 1999 40 8117.
37.Takano S., Tomita S., Takahashi M., Ogasawara K., Synthesis 1987 1116.
38.Moran J.R., Tapia I., Alcazar V., Tetrahedron 1990 46 1783.
39.Mloston G., Huisgen R., Polborn K., Tetrahedron 1999 55 11475.
40.Mloston G., Heimgartner H., Helv. Chim. Acta 1991 74 1386.
238 |
Серия научных монографий InterBioScreen |

41.Kametani T., Yukawa H., Honda T., J. Chem. Soc., Chem. Commun. 1986 651.
42.Kametani T., Yukawa H., Honda T., J. Chem. Soc. Perkin Trans. 1 1988 833.
43.Chappie T.A., Weekly R.M., McMills M.C., Tetrahedron Lett. 1996 37 6523.
44.Kametani T., Nakayama A., Itoh A., Honda T., Heterocycles 1983 2355.
45.Kametani T., Yukawa H., Honda T., J. Chem. Soc., Chem. Commun. 1988 685.
46.Baldwin J.E., Adlington R.M., Godfrey C.R.A., et al., Synlett 1993 51.
47.Baldwin J.E., Adlington R.M., Godfrey C.R.A., et al., J. Chem. Soc., Chem. Commun. 1993 1434.
48.Ko K.-Y., Lee K.-I., Kim W.-J., Tetrahedron Lett. 1992 33 6651.
49.Толстиков Г.А., Галин Ф.З., Лакеев С.Н., Изв. АН СССР, Сер. хим. 1989 1209.
50.Галин Ф.З., Лакеев С.Н., Толстиков Г.А., ХГС 1989 1693.
51.Толстиков Г.А., Галин Ф.З., Лакеев С.Н. и др., Изв. АН СССР, Сер. хим.
1990 612.
52.Халилов Л.М., Султанова В.С., Лакеев С.Н. и др., Изв. АН СССР, Сер. хим.
1991 2298.
53.Галин Ф.З., Лакеев С.Н., Толстиков Г.А., Изв. АН, Сер. хим. 1996 165.
54.Галин Ф.З., Лакеев С.Н., Толстиков Г.А., Изв. АН, Сер. хим. 1997 2008.
55.Галин Ф.З., Лакеев С.Н., Чертанова Л.Ф., Толстиков Г.А., Изв. АН, Сер. хим.
1998 2376.
56.Галин Ф.З., Лакеев С.Н., Муллагалин И.З. и др., в кн. Азотистые гетероциклы и алкалоиды, под ред. Карцева В.Г., Толстикова Г.А., М.:
Иридиум-Пресс, 2001, т. 1, с. 262.
57.Бахман В., Струве В., в сб. Органические реакции, М.: Изд-во Иностранной литературы, 1948, с. 53.
58.Карцев В.Г., Дисс. д-ра хим. наук, М.: МГУ, 1988.
59.Fang F.G., Prato M., Kim G., Danishefsky S.J., Tetrahedron Lett. 1989 30 3625.
60.Kim G., Chu-Moyer M.Y., Danishefsky S.J., J. Am. Chem. Soc. 1990 112 2003.
61.Kim G., Chu-Moyer M.Y., Danishefsky S.J., Schulte G.K., J. Am. Chem. Soc. 1993
115 30.
62.Fang F.G., Danishefsky S.J., Tetrahedron Lett. 1989 30 2747.
63.Fang F.G., Maier M.E., Danishefsky S.J., J. Org. Chem. 1990 55 831.
64.Kim G., Kang S., Kim S.N., Tetrahedron Lett. 1993 34 7627.
65.Kido F., Sinha S.C., Abiko T., Yoshikoshi A., Tetrahedron Lett. 1989 30 1575.
66.Kido F., Sinha S.C., Abiko T., et al., Tetrahedron 1990 46 4887.
67.Kido F., Sinha S.C., Abiko T., et al., J. Chem. Soc., Chem. Commun. 1990 418.
68.Kido F., Kazi A.B., Yoshikoshi A., Chem. Lett. 1990 613.
69.Kido F., Kawada Y., Kato M., Yoshikoshi A., Tetrahedron Lett. 1991 32 6159.
70.Kido F., Abiko T., Kazi A.B., et al., Heterocycles 1991 32 1487.
71.Deng W.-P., Li A.-H., Dai L.-X., Hou X.-L., Tetrahedron 2000 56 2967.
72.Sashida H., Tsuchiya T., Chem. Pharm. Bull. Jpn. 1986 34 3682.
73.Kataoka T., Tomoto A., Shimizu H., et al., J. Chem. Soc. Perkin Trans. 1 1984 515.
74.Meth-Cohn O., Vuorinen E.J., J. Chem. Soc., Chem. Commun. 1988 138.
75.Modro T.A., Vuorinen E., Phosph., Sulfur and Silicon and Relat. Elem. 1993 74 449.
76.Kurth M.J., Tahir S.H., Olmstead M.M., J. Org. Chem. 1990 55 2286.
77.Tahir S.H., Olmstead M.M., Kurth M.J., Tetrahedron Lett. 1991 32 335.
78.Crow W.D., Gosney I., Ormiston R.A., J. Chem. Soc., Chem. Commun. 1983 643.
79.Kitano T., Shirai N., Sato Y., J. Chem. Soc. Perkin Trans. 1 1997 715.
Избранные методы синтеза и модификации гетероциклов, том 2 |
239 |

80.Hadjiarapoglou L.P., Tetrahedron Lett. 1987 28 4449.
81.Tokitoh N., Suzuki T., Itami A., et al., Tetrahedron Lett. 1989 30 1249.
82.Romanski I., Mloston G., Linden A., Heimgartner H., Pol. J. Chem. 1999 73 475.
83.Mloston G., Gendek T., Linden A., Heimgartner H., Helv. Chim. Acta 1999 82 290.
84.WDI/WDA Derwent Databases, London, 2000.
85.Sadykov R.F., Sibiryak S.V., Kataev V.A., Sergeeva S.S., Proc. XIII Int. Congr. on Pharmacology, Munich, Germany, 1998, P52.28.
86.Jpn. Patent 7 215 878, 1995.
87.Bond A., Hicks C.A., Ward M.A., et al., Proc. Eur. Forum Neuroscience 2000, Brighton (UK), 2000, poster 106.05.
88.Passarotti C.M., Valenti M., Grianti M., Boll. Chim. Farm. 1994 133 (9) 510.
89.Horwell D.C., Bryans J.S., Kneen C.O., Ratcliffe G.S., World Patent 29 101, 1997.
90.Bischofberger N.W., Choung U.K., Kwawczyk S.H., et al., US Patent 5 811 450, 1998.
91.Dixit D.M., DiMaio J., Lemaire S., Proc. 215th Am. Chem. Soc. National Meeting, Dallas, 1998, poster MEDI 139.
92.Bell M.G., Muehl B.S., Winter M.A., Eur. Patent 832 891, 1998.
93.Jpn. Patent 11 116 476.
94.Mizuno A., Shibata M., Iwamori T., Inomata N., Eur. Patent 749 971, 1997.
95.Haj-Yehia A., World Patent 31 060, 2000.
96.Villhauer E.B., US Patent 6 107 317, 2000.
97.Taniguchi A., Yamamoto T., Watanabe S., Proc. 67th Ann. Meeting Jpn. Pharmacol. Soc., Kyoto, 1994, P-645.
98.Matsuoka T., Saito M., Mori N., et al., Jpn. J. Pharmacol. 1996 71 (Suppl. 1) 146.
99.Tarazi M., DiMaio J., Siddiqui M.A., Proc. 214th Am. Chem. Soc. National Meeting, Las Vegas, 1997, poster MEDI 052.
100.Tu N.P., Madar D.J., BaMaung N.Y., et al., Proc. 216th Am. Chem. Soc. National Meeting, Boston, 1998, poster MEDI 261.
101.Studenik C., Lemmens-Gruber R., Heistracher P., Gen. Pharmacol. 1999 33 (4) 319.
102.Sawyer T.K., Proc. II Winter Conference on Medicinal and Bioorganic Chemistry, Steamboat Springs, Colorado (USA), 1997, L-30.01.97.
103.Alonso M., Manu M., Arteaga C., et al., Proc. XV Int. Symp. on Medicinal Chemistry, Edinburgh (Scotland), 1998, P344.
104.Miller W.H., Pinto D.J.P., McHugh R.J.Jr., et al., Bioorg. Med. Chem. Lett. 1994 4
(6) 843.
105.Marzabadi M.R., Wong W.C., Noble S.A., US Patent 6 124 331, 2000.
106.Friis J.M., Shobe E.M., Palandra J., et al., Proc. 39th Int. Conf. on Antimicrobial Agents and Chemotherapy, San-Francisco, 1999, poster F-569.
107.Yanagita T., Anno T., World Patent 61 015, 1999.
108.Bissolino P., Alpegiani M., Corigli R., et al., Proc. XIV Int. Symp. on Medicinal Chemistry, Maastricht (Netherlands), 1996, poster 5.10.
109.Cohen M.B., Kostis J., Klapholz M., et al., Proc. 101st Annual Meeting of the American Society for Clinical Pharmacology and Therapeutics, Century City, Los Angeles, 2000, PI-23.
110.Cherrington J.M., Mulato A.S., Fuller M.D., et al., Proc. 36th Int. Conf. on Antimicrobial Agents and Chemotherapy, New Orleans, 1996, poster I3.
111.Jpn. Patent 086 653, 2000.
240 |
Серия научных монографий InterBioScreen |
