
Карцев В.Г. - Избранные методы синтеза и модификации гетероциклов. Том 2 (2003)(ru)
.pdf
Взаимодействием третичных ацетиленовых спиртов с арилизоцианатами в присутствии АсОNa получены 6,6-дизамещенные 3-арил-1,3-оксазин-2-оны 63, которые образуются в результате внутримолекулярной циклизации первоначально образующихся карбаматов 62 [64].
|
|
|
|
|
|
Ar |
||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
O |
R |
|
|
|
O |
H |
N |
||
|
|
|
||||||
|
|
|
|
|
O |
|||
|
|
|
|
|||||
|
R' |
|
|
|||||
|
N |
|
|
|
||||
|
|
|
|
O |
Ar |
R |
R' |
|
|
|
|
|
62a, b |
|
63a, b |
||
a R = Me, R' = Et; b R+R' = (CH2)5
В то же время известно, что подобные N-фенилкарбаматы при нагревании в пиридине превращаются в соответствующие 4-метилен-3-фенил-2-оксазолиди-
ноны 64 [65].
|
|
|
O |
R O |
Ph |
N |
O |
Ph |
|
R' |
|
R' |
N |
|
|
|
R |
||
O |
H |
|
|
|
|
|
64 |
Реакция фенилизоцианата с замещенными 4-диалкиламино-2-бутин-1-олами приводит к N-фенилкарбаматам 65a–c, которые не подвергались гетероциклизации
в2-оксазолидиноны в присутствии таких катализаторов, как Py, KOH, MeONa [66]. Различие в поведении карбаматов аминоспиртов 65а–с и их терминальных аналогов (см. работу [65]) объяснено полярным влиянием заместителя при этинильной группе. Гетероциклизация, судя по условиям ее проведения, происходит
врезультате нуклеофильной атаки атомом азота карбаматной группировки на этинильный углеродный атом, и для успешного ее протекания необходима соот-
ветствующая поляризация тройной связи. Как показано при изучении спектров ЯМР 13С карбаматов ацетиленовых аминоспиртов 65а–с [66] и сравнении последних с данными работ [67, 68], поляризация тройной связи под влиянием электронодонорного заместителя R'2NCH2 не благоприятствует циклизации. В то же время
виодметилате 66с электронная плотность тройной связи под влиянием аммонийной группы смещена в сторону последней, и на атоме С(2) бутинильной группы
имеется дефицит электронов (∆δ = 12.6), благоприятствующий гетероциклизации. Действительно, иодметилат карбамата 66с в присутствии MeONa при 18–25°С циклизовался с образованием иодида 5,5-диметил-4-(триметиламмониоэтилиден)- 3-фенилоксазолидин-2-она 67с.
На основании спектров ЯМР 13С и реакционной способности бромацетиленовых спиртов было отмечено, что атом брома при этинильной группе, оказывает на последнюю сильное электроноакцепторное влияние, увеличивая способность их карбаматов к гетероциклизации [69].
Избранные методы синтеза и модификации гетероциклов, том 2 |
51 |
Ph NH |
|
|
|
|
|
|
|
|
HN Ph |
|
|
|
|
|
I− |
||||
O O |
|
|
|
|
|
|
R' |
|
O |
O |
|
|
|
|
|
||||
|
|
|
|
|
|
MeI |
|
|
|
+ |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
R |
|
|
|
|
|
|
N |
R' |
R |
|
|
|
|
N |
|
R' |
|||
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
R |
|
|
|
|
|
|
|
|
R |
|
|
R' |
||||||
|
|
|
65a−c |
|
|
|
|
|
66a−c |
||||||||||
|
|
|
|
|
|
|
|
|
|
I− |
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
O |
|||||||
|
|
|
|
|
|
|
|
|
|
|
R' |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R' |
N+ |
|
N |
|
O |
||||
|
|
|
|
|
|
|
|
|
|
|
|
Ph |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
67c |
|
|
|
|
|
|
|
|
a R = H, R' = Me; b R = H, R' = Et; c R = R' = Me
Найдено [70], что образующийся в реакции винилового эфира моноэтаноламина с 3-хлор-1,2-пропиленкарбонатом N-(2-винилоксиэтил)-3-хлор-2-гидрокси- пропилкарбамат 68 при перегонке изомеризуется в N-(3-хлор-2-гидроксипро- пилоксикарбонил)-2-метилоксазолидин 69, т.е. имеет место внутримолекулярное присоединение группы NH карбамата к двойной связи винилового эфира. Обработка оксазолидина 69 порошкообразным NaOH в ацетоне приводит к соответствующему эпоксиду 70 [71].
|
OH |
|
|
Cl |
OH |
|
|
Cl |
|
O O |
|
|
|
||
|
|
|
|
|
|
||
|
O |
NH |
∆ |
|
O |
N |
NaOH |
|
|
|
|
O |
O |
||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
68 |
|
|
|
69 |
|
|
|
|
|
|
N |
O |
|
|
|
|
|
O |
O |
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
70 |
|
|
Изучен [72] распад этиловых эфиров N-(о-азидоарил)карбаминовых кислот 71 под действием гидрида натрия в ДМФА при 70°С, протекающий с отщеплением азота и образованием 6-R-бензимидазолонов 72 наряду с карбаматными производными азобензола.
52 |
Серия научных монографий InterBioScreen |

O |
|
O |
|
|
|
NH |
|
H |
|
|
NaH/ДМФА |
N |
||
|
|
|
|
O |
R |
N |
+ |
R |
N |
N − |
H |
|||
71a−c |
N |
|
72a−c |
|
|
|
|||
a R = H; b R = Cl; c R = Me
Катрицкий А. [73] установил, что нагревание 2-(этоксикарбониламино)пири- дин-1-оксида 73 приводит к получению 1,2,4-оксадиазоло[2,3-a]пиридин-2-она 74.
O
EtO NH
+ |
O− |
N |
N |
∆ |
|
|
N |
O |
|
O |
|
73 |
74 |
|
В дальнейшем [74] было показано, что 2-(этоксикарбониламино)хинолин- 1-оксид и 1-(этоксикарбониламино)изохинолин-2-оксид в аналогичных условиях также циклизуются в соответствующие оксадиазолоны.
При обработке некоторых N-арилкарбаматов дигалогенангидридами щавелевой кислоты получены производные оксазолидинтриона [75].
Осуществлен синтез бензофуроксанов путем термолиза орто-нитроазидо- производных арилкарбаматов [76–78].
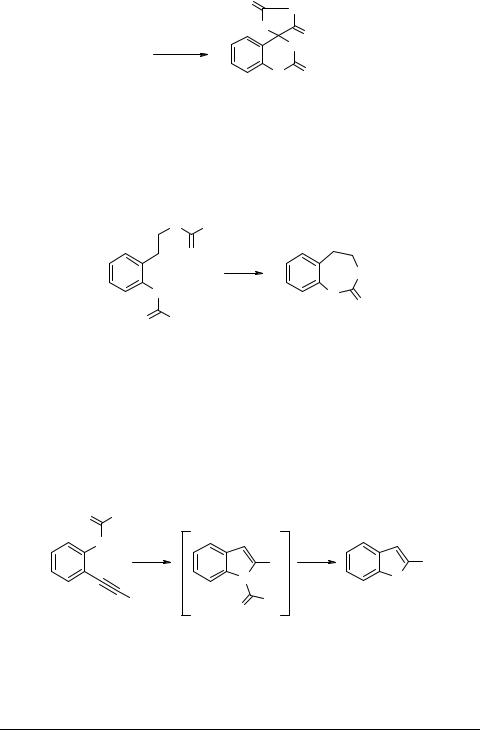
N-Этоксикарбонилизатин 75 и мочевина при нагревании в ампуле с аммиаком, гидразином или гидроксиламином образуют при 120°С за 4 ч спиро(имидазо- лидин-4,4'(1Н)-хиназолин)-2,2',5(3Н)трион 76 [79, 80], причем постулировано образование в качестве промежуточного соединения 2-гетерилзамещенного N-арилкарбамата.
|
|
|
|
|
|
|
H |
|
O |
|
|
|
|
|
|
N |
|
|
|
O |
|
ТГФ, |
HN |
O |
|
|
|
|
|
|
|
||||
|
|
+ H N |
|
толуол |
|
OH |
|
|
|
O |
|
|
|
|
|||
N |
|
NH |
2 |
|
NH |
|
||
|
2 |
|
|
|
|
|||
O |
OEt |
|
|
|
|
O |
OEt |
|
|
|
|
|
|
|
|||
75 |
|
|
|
|
|
|
|
|
Избранные методы синтеза и модификации гетероциклов, том 2 |
53 |
|||||||
|
O |
H |
|
|
N |
RNH2 |
HN |
NRO |
|
||
−EtOH |
N |
O |
|
||
|
H |
|
|
76 |
|
R = H (59%), NH2 (57%), OH (15%)
Синтез 1,3-бензодиазепин-2-она 78 включает циклизацию производного N-арилкарбамата 77, аналогично получен и 1,3-бензодиазоцин-2-он [81–83].
H |
NH2 |
|
N |
|
|
O |
|
|
|
|
NH |
NH |
N |
O |
O OPh |
H |
|
|
|
|
77 |
78 |
|
Сакамото, Кондо и Яманака разработали простой метод получения индолов из этил-N-(o-бромфенил)карбаматов, включающий кросс-сочетание последнего с ацетиленами, катализируемое соединениями палладия [84]. Модификация аминогруппы в карбаматную существенна не только для осуществления указанного кросс-сочетания, но и для последующей циклизации, поскольку о-броманилин не вступает в эту реакцию, а о-бромацетанилид в процессе реакции с TMS−C≡CH в присутствии Pd осмоляется.
O OEt |
|
|
|
|
NH |
EtONa |
|
|
H2O |
|
|
R |
||
|
|
|
R |
|
|
|
N |
|
N |
|
R |
|
OEt |
H |
|
O |
|
||
|
|
|
|
|
R = SiMe3, Bu, Ph |
|
|
R = H, Bu, Ph |
|
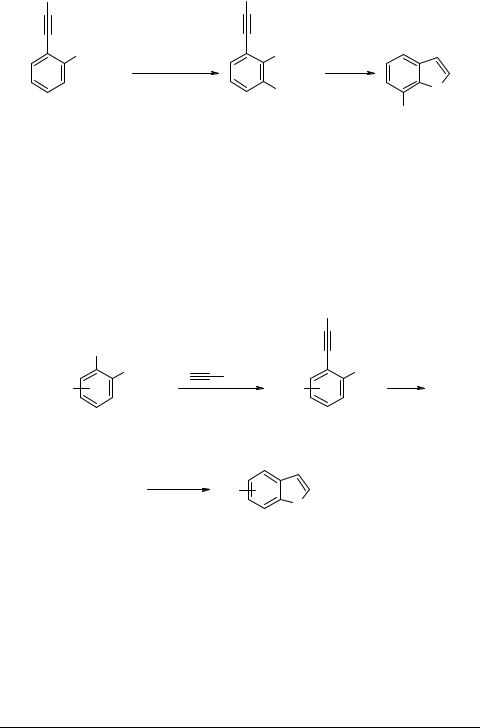
Позже [85] 7-замещенные индолы 80 были получены кипячением в спирте 6-замещенных трет-бутил-2-(триметилсилилэтинил)фенилкарбаматов 79 в присутствии соответствующих алкоголятов.
54 |
Серия научных монографий InterBioScreen |
SiMe3 |
|
SiMe3 |
|
|
NHBoc |
t-BuLi (2.2 экв.) |
NHBoc |
t-BuOK |
|
|
Et2O, −20°C, 3 ч |
|
t-BuOH |
|
|
E+ |
E |
∆ |
N |
|
|
|
|
H |
|
|
79 |
|
E |
|
|
|
80 |
E= Br, I, Me2C=CHCH2, PhCO
Вдальнейшем авторы статей [86–88] разработали стратегию синтеза производных индола, имеющих кислородсодержащие заместители (OMe или -O-Si(i-Pr)3)
вразличных положениях бензольного кольца. Она включает реакции литиирования, иодирования, этинилирования и индольной циклизации.
|
|
|
|
SiMe3 |
|
I |
|
|
|
|
NHBoc |
|
SiMe3 |
NHBoc |
RO |
|
|
RO |
|
|
Pd(PPh3)2Cl2 |
|||
|
|
|
||
|
|
CuI, Et3N, 20°C |
|
|
|
t-BuOK |
|
|
|
|
t-BuOH |
RO |
|
|
|
|
∆ |
N |
|
|
|
|
||
|
|
|
|
H |
R= 4-Me (70%), 7-Me (70%), 5-Me (79%), 6-Si(i-Pr)3 (67%), 7-Si(i-Pr)3 (10%), 5-Si(i-Pr)3 (70%)
Дилитийпроизводные карбаматов представляют значительный интерес как компоненты гетероциклизаций (синтез хинолинов, индолов, бензоксазинов и др.) [89–91]. Так, при взаимодействии дилитиированного производного трет-бутил-N- фенилкарбамата 81 с бензонитрилом, фенилизоцианатом и п-хлорбензальдегидом получены производные хиназолинона 82, хиназолиндиона 83 и 1,3-оксазина 84, соответственно.
Избранные методы синтеза и модификации гетероциклов, том 2 |
55 |

|
|
H |
O |
|
PhCN |
N |
|
|
2 ч, −20°C |
N |
|
|
1 ч, 20°C |
Ph |
|
|
|
|
|
Li |
|
82 (83%) |
|
O O |
|
|
|
N |
|
H |
O |
PhN=C=O |
N |
||
|
|
|
|
Li |
2 ч, −20°C |
N |
Ph |
1 ч, 20°C |
|
||
81 |
O |
|
|
|
|
||
|
|
83 (57%) |
|
|
|
H |
O |
|
p-ClC6H4CHO |
N |
|
|
|
|
|
|
2.5 ч, 20°C |
O |
|
C6H4Cl-p
84 (35%)
На реакции орто-литиированного трет-бутил-N-арилкарбамата 81 с маскированными производными малондиальдегида 85 и последующей циклизации, индуцированной кислотой, основан новый вариант синтеза хинолинов по Фридлендеру. Обсуждены вероятные пути превращения литиевого производного 81 в присутствии соединений типа 85 в хинолины 86 [92].
|
|
ClO−4 |
|
NMe2 |
N |
|
|
Me2N |
+ |
|
|
R' |
|
|
|
R |
|
|
|
R |
|
||
|
|
|
|
||
2 t-BuLi R' |
|
Li |
85 |
R' |
N H2O |
ТГФ |
|
N |
|
|
N |
HN O |
|
|
|
||
O |
OLi |
|
|
O OLi |
|
O |
|
|
|||
|
|
|
|
|
|
|
81 |
|
|
|
|
56 |
Серия научных монографий InterBioScreen |
|
|
H |
|
|
|
|
|
H |
|
O |
R |
|
|
|
|
O |
R |
|
|
|
|
|
R' |
|
||
R' |
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH |
|
|
−Me2NH |
|
|
NH |
|
|
|
|
|
|
|
||
|
|
Boc |
|
|
|
|
|
Boc |
|
|
N |
|
|
|
|
|
|
R' |
|
|
R |
R' |
R |
R' |
|
R |
|
|
N |
OH |
|
N |
H+ |
|
N OH |
|
|
Boc |
|
|
86 |
|
|
Boc |
R = R' = H (a); R = H, R' = F (b); R = H, R' = Cl (c); R = H, R' = Me (d);
R = H, R' = OMe (e); R = Ph, R' = F (f); R = Ph, R' = Cl (g); R = Ph, R' = Me (h); R = Ph, R' = OMe (i); R = Me, R' = H (k)
Для сравнения в этой реакции изучено поведение N-пивалоиланилинов, которые орто-литиируются легче, чем трет-бутил-N-арилкарбаматы. Установлено, что применение карбаматного производного предпочтительнее, так как удаление пивалоильной группы происходит в гораздо более жестких условиях.
Предложен [93] новый синтез 3-арил-5-трет-бутил-4-оксазолин-2-онов 88, 89 по реакции этил-N-арилкарбаматов с 1-бром-3,3-диметилбутан-2-оном 87а или 1-бром-3-этил-3-метилпентан-2-оном 87b с использованием 2.2 экв. LiN(TMS)2 при 20°С. Предложен вероятный механизм превращений.
|
O |
|
|
|
|
|
Br |
|
|
|
|
O |
87a |
|
N |
|
|
HN OEt |
|
|
O |
|
|
|
|
|
|
||
|
R |
O |
|
|
|
LiN(TMS)2 |
O |
|
|
||
R' |
|
88 |
|
R' |
|
R |
|
|
|
|
|
ДМФА |
Br |
|
|
|
|
|
|
|
|
|
|
|
R' |
|
|
|
|
|
87b |
|
N |
|
R' |
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
R |
O |
|
|
|
|
|
89 |
|
|
Избранные методы синтеза и модификации гетероциклов, том 2 |
57 |
||||

N-(трет-бутоксикарбонил)анилины были превращены в N-(трет-бутокси- карбонил)-1,2,3,4-тетрагидрохинолины 90 посредством орто-литиирования и последующей реакции с 1-хлор-3-иодпропаном [94].
Boc
|
H |
|
|
|
N |
|
N |
O |
2.5 экв. t-BuLi, ТГФ |
||
R |
|
O |
|
Cl , ∆ |
R |
|
|
I |
|
||
|
|
|
|
|
90 |
В аналогичных условиях 4-(трет-бутоксикарбониламино)пиридин был превращен в 1,2,3,4-тетрагидро-1,6-нафтиридин 91.
Boc
N
N
91(28%)
Встатье [95] описано применение аддуктов 92a, b несимметричных бензохинондиимидов с метилциклопентан-1,3-дионом для синтеза пирроло[1,2-a]- индолов 93a, b. Эти исследования важны для разработки подходов к получению соединений, родственных митомицинам.
X
O
|
H /Pd/C |
X |
|
OH P2S5 |
|
|
|
||
|
2 |
|
|
|
O NH |
NaH/ТГФ |
|
N |
Ni Ренея |
|
O |
|
|
|
O |
|
|
|
|
|
|
O |
|
|
92a, b |
|
|
|
|
|
|
|
|
X
N
93a, b
X = HNTs (a), HNSO2NMe2 (b)
58 |
Серия научных монографий InterBioScreen |

Взаимодействием N,N'-диметоксикарбонил-п-бензохинондиимина с β-дикар- бонильными соединениями и α-тозилкетонами в диоксане при 20°С в присутствии MeONa получены соответствующие аддукты присоединения по Михаэлю 94, которые кипячением в 22%-ной соляной кислоте циклизованы в соответствующие карбаматные производные индола 95 [96, 97].
O |
|
|
|
|
|
|
|
HN |
OMe |
|
|
MeO |
H |
R' |
|
|
O |
|
HCl |
N |
|
|
|
|
|
|
|
|
R |
||
|
|
|
∆ |
|
O |
N |
|
|
|
R |
|
|
|||
|
|
|
|
|
|
||
O NH |
R' |
|
|
|
|
O |
OMe |
|
|
|
|
|
|
|
|
OMe |
94a−g |
|
|
|
|
|
|
|
|
|
|
|
95a−g |
|
|
R = Me, R' = COMe (a); R = Me, R' = COPh (b); R = R' = CH2CМe2CH2CO (c);
R = Me, R' = CO2Et (d); R = Ph, R' = CO2Et (e); R = Me, R' = Ts (f); R = Ph, R' = Ts (g)
Таким образом, приведенные в обзоре данные показывают, что производные карбаматов являются ценными ключевыми соединениями в синтезе различных азотсодержащих гетероциклов.
Литература
1.Vor der Brück D., Bühler R., Plieninger H., Tetrahedron 1972 (28) 791.
2.Imagawa T., Sisido K., Kawanisi M., Bull. Chem. Soc. Jpn. 1973 46 2922.
3.Максимова Т.Н., Мочалин В.Б., Унковский Б.В., ХГС 1980 (2) 273.
4.Cava M.P., Wilkins C.K., Chem. Ind. (London) 1964 1422.
5.Арбузов Ю.А., Климова Е.И., Антонова Н.Д., Томилов Ю.И., ЖОрХ 1974
10 1164.
6.Biehler G.-M., Fleury G.-P., Perchai S.I., Regent A., Tetrahedron Lett. 1968 4227.
7.Merten R., Belg. Patent 618 455; Chem. Abstr. 1963 58 9033g.
8.Merten R., Belg. Patent 611 643; Chem. Abstr. 1962 57 16373b.
9.Merten R., Belg. Patent 608 904; Chem. Abstr. 1963 59 2781d.
10.Merten R., Müller G., Angew. Chem. 1962 74 866.
11.Merten R., Müller G., Chem. Ber. 1964 97 682.
12.Adams R., Baron F.A., Chem. Rev. 1965 65 567.
13.Quan P.M., Kains T.K.B., Quin L.D., Chem. Ind. (London) 1964 1553.
14.Sen R.N., Mukherji A., J. Indian Chem. Soc. 1930 7 275; Chem. Abstr. 1930
244779.
15.Krow G., Rodebaugh R., Carmosin R., et al., J. Am. Chem. Soc. 1973 95 5273.
Избранные методы синтеза и модификации гетероциклов, том 2 |
59 |

16.Krow G., Rodebaugh R., Grippi M., et al., J. Org. Chem. 1973 38 3094.
17.Sasaki T., Fguchi S., Sugimoto M., Hibi F., J. Org. Chem. 1972 37 2317.
18.Giordano C., Abis L., Gazz. Chim. Ital. 1974 104 1181.
19.Huisman H.O., Angew. Chem. 1971 83 511.
20.Fowler F.W., J. Org. Chem. 1972 37 (9) 1321.
21.Fraenkel G., Cooper J.W., Fink C.M., Angew. Chem. 1970 82 518.
22.Павлов А.В., Мочалин В.Б., ЖОрХ 1983 19 123.
23.Великородов А.В., ЖОрХ 2000 36 1242.
24.Kresze G., Shulz G., Firl F., Angew. Chem. Int. Ed. 1963 2 (5) 263.
25.Великородов А.В., Белоконев А.Н., Максимова Т.Н., Мочалин В.Б.,
Изв. Вузов, Сер. химия и хим. технол. 1994 37 (10–12) 23.
26.Hisano T., Yoshikawa S., Muraoka K., Chem. Pharm. Bull. 1974 22 (7) 1611.
27.Velikorodov A.V., Mochalin V.B., Abstr. 4th Int. Symp. Mod. Probl. of Aliphatic Diazo Compounds Chemistry, Saint-Petersburg (Russia), 2000, p. 37.
28.Великородов А.В., Бабайцев Д.Д., ЖОрХ 2002, в печати.
29.Великородов А.В., Мочалин В.Б., ЖОрХ 2001 37 (1) 93.
30.Великородов А.В., Мочалин В.Б., в кн. Современные проблемы органической химии, экологии и биотехнологии: мат. 1 Междунар. научн. конф., Луга, 2001, с. 13.
31.Великородов А.В., Мочалин В.Б., Мухин А.А., в кн. Азотистые гетероциклы
иалкалоиды, под ред. Карцева В.Г., Толстикова Г.А., М.: Иридиум-Пресс, 2001, т. 2, с. 62.
32.Великородов А.В., Мухин А.А., Черняева Е.А., Изв. Вузов, Сер. химия и хим.
технол. 2001 44 (6) 22.
33.Семенова Е.Б., Великородов А.В., Зубков Ф.И., Тез. 7 Междунар. научно-тех.
конф. "Наукоемкие химические технологии–2001", Ярославль: Ярославский гос. техн. ун-т, 2001, c. 112.
34.Махсумов А.Г., Атаходжаева М.А., Талипова М.А., Джураев А.Д., Хим.-фарм.
журн. 1998 22 (4) 431.
35.Hegarty A.F., Frost L.N., J. Chem. Soc. Perkin Trans. 2 1973 (13) 1249.
36.Carpino L.A., Parameswaran K.N., Kirkley R.K., et al., J. Org. Chem. 1970 35 (10) 3291.
37.Scott F.L., Fenton D.F., Tetrahedron Lett. 1970 (9) 681.
38.Farrissey M.J., Nasky A.M., J. Heterocycl. Chem. 1970 7 (2) 331.
39.Schmidt K., Ger. Patent 1 257 147; Chem. Abstr. 1968 69 10447.
40.Warrener R.N., Cain F.N., Tetrahedron Lett. 1966 3231.
41.Meier G., Angew. Chem. Int. Ed. 1974 13 425.
42.Krantz A., Hoppe B., J. Am. Chem. Soc. 1975 97 6590.
43.Мочалин В.Б., Филенко Н.И., ХГС 1979 (12) 1628.
44.Филенко Н.И., Мочалин В.Б., ЖОрХ 1979 15 (3) 475.
45.Филенко Н.И., Автореф. дис. канд. хим. наук, М., 1979.
46.Bhattacharya P., Sarkar M., Roychoudhury T., Chakraborty D.P., Chem. Ind. (London) 1978 532.
47.Sarkar M., Chakraborty D.P., Phytochemistry 1979 18 694.
48.Chakraborty P., Mandal A.K., Roy S.K., Synthesis 1981 (12) 977.
49.Сорокин М.Ф., Шоде Л.Г., Клочкова Л.В., Деп. в ВИНИТИ 29.07.80,
№ 4044-80.
60 |
Серия научных монографий InterBioScreen |
