
Карцев В.Г. - Избранные методы синтеза и модификации гетероциклов. Том 2 (2003)(ru)
.pdf
50.Сорокин М.Ф., Шоде Л.Г., Павлюков С.А., Оносова Л.А., Изв. Вузов,
Сер. химия и хим. технол. 1978 (8) 1220.
51.Червинский А.Ю., Зубрицкий М.Ю., Болдескул И.Е., Капкан Л.М., Укр. хим.
журн. 1990 56 (1) 17.
52.Сорокин М.Ф., Шоде Л.Г., Изв. Вузов, Сер. химия и хим. технол. 1981 (5) 561.
53.Зубрицкий М.Ю., Червинский А.Ю., Чуприна В.С., в сб. Термический анализ
ифазовые равновесия, Пермь: Перм. гос. ун-т, 1987, с. 60.
54.Julia S., Ginebreda A., Bernabe M.L., Grau M., Afinidad 1982 (39) 275.
55.Nourad A.E., Nour-El-Din A.M., J. Prakt. Chem. 1983 325 (11) 2616.
56.Великородов А.В., Изв. Вузов, Сер. химия и хим. технол. 1998 41 (2) 98.
57.Garcia Ruano J.L., Pedregal C., Rodrigues J.H., Tetrahedron 1989 45 (3) 203.
58.Slouka J., Nalepá K., Z. Chem. 1986 26 (4) 134.
59.Slouka J., Bekárek V., Collect. Czech. Chem. Commun. 1980 45 1379.
60.Latif N., Mishriky N., Assad F.M., Austr. J. Chem. 1982 35 1037.
61.Dox A.W., Yoder L., J. Am. Chem. Soc. 1923 45 723.
62.Pierce J.S., Adams R., J. Am. Chem. Soc. 1923 45 790.
63.Stoffel P.J., Speziale A.J., J. Org. Chem. 1962 27 3079.
64.Shapiro S.L., Bandurco V., Freedman L., J. Org. Chem. 1961 26 3710.
65.Frances T., Thorne M.P., Can. J. Chem. 1976 54 24.
66.Кругликова Р.И., Сотниченко Т.В., Шингареева А.Г., Унковский Б.В., ЖОрХ
1981 17 (3) 649.
67.Rosenberg D., Drenth W., Tetrahedron 1971 27 3893.
68.Сотниченко Т.В., Кругликова Р.И., Мартон Варга и др., ЖОрХ 1979 15 254.
69.Кругликова Р.И., Сотниченко Т.В., Унковский Б.В., в сб. Химия и хим.
технология органических производств, МХТИ, 1978, т. 8, № 2, с. 15.
70.Недоля Н.А., Рахматулина Т.Н., Раппопорт Л.Я., Гаврилова О.П., ЖОрХ 1986
22 (6) 1333.
71.Недоля Н.А., Рахматулина Т.Н., Дымченко В.И. и др., ЖОрХ 1988 24 (7) 1382.
72.Smalley R.K., Stocker A.W., Tetrahedron Lett. 1984 25 (13) 1389.
73.Katritzky A.R., J. Chem. Soc. 1956 2063.
74.Tanida H., Yakugaku Zasshi 1959 79 (8) 1063.
75.Stoffe P.J., J. Org. Chem. 1964 (28) 2796.
76.Boulton A.G., Ghosh P.B., Katritzky A.R., J. Chem. Soc. B 1966 (11) 1004.
77.Hobin T.P., Tetrahedron 1968 24 6145.
78.Хмельницкий Л.И., Новиков С.С., Годовикова Т.И., Химия фуроксанов.
Строение и синтез, М.: Наука, 1996.
79.Бакибаев А.А., Яговкин А.Ю., Вострецов С.И., Успехи химии 1998 67 (4) 333.
80.Yamagishi M., Yamada Y., Ozaki K., et al., J. Med. Chem. 1992 35 (11) 2085.
81.Hilse A., Hilse U., Dissertation, Potsdam, 1985.
82.Kempter G., Spindler J., Z. Chem. 1989 29 (8) 276.
83.Kempter G., Ehrlichmann W., Grünert K., et al., Wiss. Z. Päd. Hochschule Potsdam
1980 24 19.
84.Sakamoto T., Kondo Y., Yamanaka H., Heterocycles 1986 (24) 31.
85.Kondo Y., Kojima S., Sakamoto T., Нeterocycles 1996 43 (12) 2741.
86.Sakamoto T., Kondo Y., Iwashita S., Yamanaka H., Chem. Pharm. Bull. 1987 35
(5) 1823.
87.Sakamoto T., Kondo Y., Iwashita S., et al., Chem. Pharm. Bull. 1988 36 (4) 1305.
Избранные методы синтеза и модификации гетероциклов, том 2 |
61 |

88.Kondo Y., Kojima S., Sakamoto T., J. Org. Chem. 1997 62 6507.
89.Muchowski J.M., Venuti M.C., J. Org. Chem. 1980 45 (23) 4798.
90.Stanetty P., Koller H., Mihovilovic M., J. Org. Chem. 1992 57 (25) 6833.
91.Cho I.-S., Grong L., Muchowski J.M., J. Org. Chem. 1991 56 (26) 7288.
92.Reuter D.C., Flippin L.A., McIntosh J., et al., Tetrahedron Lett. 1994 35
(28)4899.
93.Kudo N., Taniguchi M., Sato K., Chem. Pharm. Bull. 1996 44 (4) 699.
94.Reed J.N., Rotchford J., Strickland D., Tetrahedron Lett. 1988 29 (45) 5725.
95.Ohnuma T., Sekine Y., Ban Y., Tetrahedron Lett. 1979 27 2533.
96.Великородов А.В., Мочалин В.Б., ЖОрХ 1998 34 (10) 1555.
97.Великородов А.В., Мочалин В.Б., ЖОрХ 2001 37 (7) 1100.
62 |
Серия научных монографий InterBioScreen |
Образование гетероциклов при каталитическом карбонилировании ацетиленовых соединений
Визер С.А.
Институт химических наук им. А.Б. Бектурова Министерства образования и науки Республики Казахстан 480100, Казахстан, Алматы, ул. Ш. Валиханова, 106
Введение
Карбонилирование непредельных углеводородов, спиртов, органических галогенидов и других субстратов, катализируемое переходными металлами, их солями и органическими комплексами, широко применяется для синтеза новых карбонил-, карбоксил- и алкоксикарбонилсодержащих соединений, в том числе создания или модификации гетероциклических соединений [1–6]. Однако в цитированных книгах и обзорах практически нет сведений о синтезе гетероциклов при карбонилировании ацетиленовых соединений, т.к. они появились, в основном, в последние 20 лет. Эти данные и отражены в настоящем обзоре.
Синтез азагетероциклов
Чюсоли с сотрудниками [7] найдено, что α,α,α',α'-тетраалкилзамещенные дипропаргиламины реагируют с окисью углерода и спиртами или водой в присутствии комплекса PdCl2–тиомочевина, образуя изомерные алкоксикарбонильные производные диметиленпирролидина 1, 2 (схема 1).
Схема 1
|
|
|
|
|
H |
H |
|
|
|
|
MeOH кат. |
N |
N |
HN |
+ |
CO |
+ |
|
O + |
|
|
|
|
|
OMe O OMe
OMe
1 |
2 |
При использовании PdCl2 как катализатора и в присутствии кислорода (СО/О2 = 90 : 10) в метаноле наряду с соединениями 1 и 2 преимущественно образуются диметоксикарбонильные производные диметиленпирролидина 3 и 4. Аналогичная картина наблюдается и при катализе Pd0/C в присутствии KI и кислорода (СО/О2 = 94 : 6), причем в небольшом количестве образуется еще и третий стереоизомер 5 [8] (схема 2).
Избранные методы синтеза и модификации гетероциклов, том 2 |
63 |
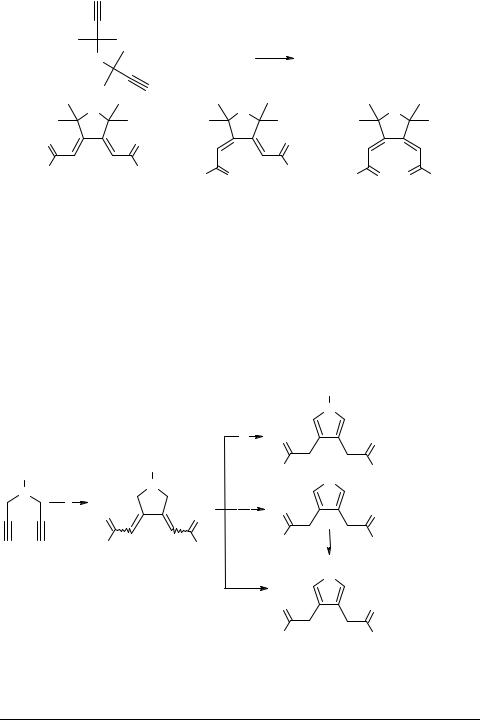
Схема 2
HN |
+ CO + MeOH кат. |
1 + 2 |
+ |
||
H |
|
H |
|
|
H |
N |
O + |
N |
O + |
|
N |
+ O |
|
|
|
||
MeO |
OMe |
MeO O |
OMe |
MeO |
O O OMe |
3 |
|
|
|||
|
4 |
|
|
5 |
|
Метоксикарбонилирование дипропаргилметиламина при катализе комплексом PdCl2–тиомочевина приводит к образованию как моно-, так и диметоксикарбонильных производных N-метилдиметиленпирролидина, но с низкими выходами [8].
При окислительном алкоксикарбонилировании дипропаргиламинов и амидов смесью СО/воздух при давлении 4 атм в спиртовой среде и катализе Pd0/C в присутствии KI получена смесь стереоизомеров 3,4-бис(алкоксикарбонилметилен) пирролидинов 6, которые в разных условиях превращаются в изомерные пирролы 7 и свободные пиррол-3,4-диуксусные кислоты 8 [9] (схема 3).
Схема 3
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
N |
|
|
|
|
ii |
|
O |
|
O 7 (15−85%) |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
R |
|
R |
|
R'O |
H |
OR' |
|
N |
i |
N |
|
|
|
N |
|
iii |
|
|
|
|
|||
|
|
O |
|
O |
|||
|
O |
O |
|
|
|||
|
|
|
|
||||
|
|
|
|
|
|
|
(27-81%) |
|
R'O |
OR' |
|
R'O |
v |
OR' |
|
|
|
|
|||||
|
|
6 (17−95%) |
|
|
|
H |
|
|
|
|
iv |
|
|
N |
|
|
|
|
R = COPh |
O |
|
8 (80%) |
|
|
|
|
|
O |
|||
R = Alk, Ar, AlkOCO, Ts; R' = Alk; |
(66%) |
|
|
|
|
||
i - CO/воздух, R''OH, Pd/C, KI; |
|
HO |
|
OH |
|||
ii - ДМСО или MeCN/Et3N, 25−70°C, 3−70 ч; |
|
||||||
|
|
|
|
||||
iii- R''OH, Et3N, 25−80°С, 5−70 ч;
iv- (1) Ba(OH)2/H2O, 100°C, 15 ч, (2) H2SO4/H2O;
v- (1) NaOH/H2O, 100°C, 30−40 мин, (2) H2SO4/H2O, 0°C
64 |
Серия научных монографий InterBioScreen |
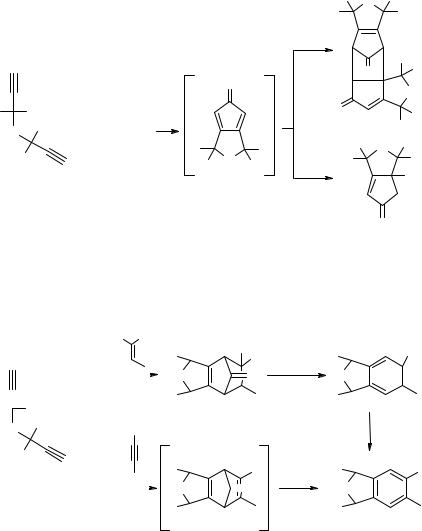
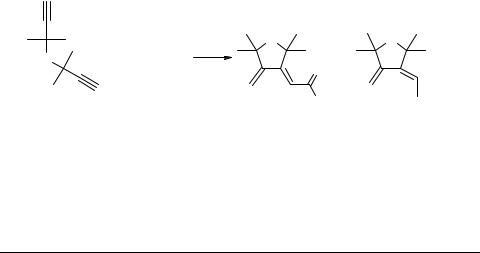
Те же авторы нашли [10], что при карбонилировании 1,6-диинов 9 в присутствии Pd0 на угле образуются продукты циклокарбонилирования 10–12 (схема 4). Реакция протекает при комнатной температуре и атмосферном давлении окиси углерода. Полициклические соединения 11 образуются при димеризации циклопентадиенона 10. При проведении реакции в щелочно-спиртовой среде (при X = NH, NMe, R = Alk) циклопентадиенон 10 присоединяет спирт с образованием соответствующих алкоксициклопентенонов 12.
|
|
|
|
|
|
|
|
|
Схема 4 |
|
|
|
|
|
|
|
R |
X |
|
R |
|
|
|
|
|
|
|
R |
|
R |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
O |
|
|
|
|
O |
|
R |
R |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
X |
|
|
|
|
|
|
|
O |
|
|
|
|
R |
R |
|
|
|
|
11 |
|
|
R |
|
|
|
|
|
|
|
R |
||||
X |
R + CO + MeOH |
|
|
|
|
R |
|
|
|
|
|
R |
|
|
R |
|
|
X |
R |
||
R |
X |
|
|
R |
|
|
R |
|||
R |
R |
|
R'OH |
|
|
|
||||
9 |
10 |
|
|
|
|
OR' |
||||
|
|
|
|
|
|
|
||||
|
R = H, Alk; X = NH, O |
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
12 |
|
||
Применение в качестве диенофилов, используемых для "улавливания'' циклопентадиенона 10, различных алкенов и алкинов позволяет расширить круг образующихся полициклических соединений 13–15 [11] (схема 5).
|
|
|
|
Q |
Y |
|
|
|
|
|
|
|
|
|
|
|
Схема 5 |
||||
|
|
|
|
R |
|
Y |
|
|
R |
|
Y |
||||||||||
|
|
|
|
|
|
|
|
R |
|
|
Q 180−250°C R |
|
|
|
|
||||||
|
|
|
|
|
|
Z |
|
|
|
|
|
|
|
|
Q |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
X |
|
|
O |
−CO |
X |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
R |
|
|
R |
|
|
|
R |
|
13 |
|
Z |
R |
|
|
|
14 |
|
Z |
|||
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
R |
|
|
|
R |
|
|
||||||||||
|
|
|
|
|
|||||||||||||||||
|
X |
R + CO |
кат. |
|
Y |
|
|
|
|
|
|
|
|
|
∆ |
Q = H |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
R |
|
|
|
|
|
R |
|
|
|
|
|
R |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
||||||
9 |
|
|
|
Z |
R |
|
|
|
|
Y |
∆ |
|
|
|
Y |
||||||
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
X |
|
|
O |
X |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
−CO |
|
|
Z |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
R |
|
|
|
|
Z |
R |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
R |
15 |
|
|
||||
|
|
|
X = NH, NCO2Me, NCOPh, O; Y = Ph, CO2Me, H, CN,CH=CH2; |
|
|
|
|||||||||||||||
|
|
|
Z = H, Me, CO2Me; Q = H, Me, CO2Me |
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Избранные методы синтеза и модификации гетероциклов, том 2 |
65 |
||||||||||||||||||||

В качестве катализатора используется Pd0/C (10%), комплексы Pd0, такие как Pd2(dba)3 (dba – дибензилиденацетон) или соли Pd, легко восстанавливающиеся в условиях реакции до металлического палладия. Использование алкинов в качестве диенофилов приводит к образованию продуктов, которые при нагревании самопроизвольно ароматизируются. Лучшие выходы полициклических соединений 13 и 15 (до 98%) наблюдались в реакциях с терминальными алкенами и алкинами. В отсутствие СО в этих же условиях никакие реакции не проходят. Однако при использовании в качестве катализаторов комплексов Ni и Co наблюдалась циклоароматизация диинов 9 [12].
Нами было показано, что при окислительном метоксикарбонилировании N,N-дипропаргилариламинов окисью углерода в метаноле при катализе PdCl2 в присутствии CuCl2 и AcONa помимо диэфиров N-арилиминодипропаргиловых кислот 16 образуются гетероциклические соединения – триметил-1-арил-5-карбо- ксиметилен-1,2,5,6-тетрагидропиридин-3,4-трикарбоксилаты 17 [13, 14] (схема 6).
Схема 6
|
|
O |
OMe |
|
|
|
|
|
|
|
|
MeO |
|||
|
|
|
|
|
|
O |
|
|
i |
|
|
|
|
O |
|
xC6H4N |
xC6H4N |
+ xC6H4N |
|||||
|
|||||||
|
|||||||
|
|
|
|
|
|
OMe |
|
|
|
O |
OMe |
O |
|
OMe |
|
|
|
|
|||||
|
|
|
|||||
|
|
|
|
||||
|
|
|
|
|
|||
|
|
16 |
|
17 |
|||
17 X = H (11%), p-Cl (36%), m-Cl (40%), m-Br (47%), o-Cl (24%), o-Br (45%) i - CO, MeOH, 10 мол. % PdCl2, 4 экв. CuCl2, 1 экв. AcONa на 1 экв. амина
Образование циклических аминотриэфиров 17 происходит путем аддитивного метоксикарбонилированияоднойизтройныхсвязейариламинодиэфиров 16, сопровождающегося циклизацией. Наблюдающаяся зависимость образования циклических 17 или ациклических ариламиноэфиров 16 от электронной природы заместителя Х и его положения в арильном цикле (при X = p-CH3, p-OCH3 и p-Br циклические соединения 17 совсем не образуются) по-видимому, связана со стабильностью промежуточно образующихся комплексов аминодиэфиров 16 с катализатором PdCl2 [14].
Оппольцер с сотрудниками показали [15, 16], что катализируемая комплексами никеля и палладия высокостереоселективная реакция аннелирования/карбонилирования пропаргилаллиламинов 18a, b позволяет получать моно- 19 или бициклические 20, 21 производные пирролидинов (схема 7) в зависимости от используемого катализатора и условий реакции (см. таблицу 1).
66 |
Серия научных монографий InterBioScreen |

Схема 7
|
NTs |
M0L |
NTs |
CO |
|
|
|
|
|
||||
|
|
n |
|
MeOH |
|
|
|
|
|
|
|
||
X |
|
|
|
или |
|
|
|
|
MIILm |
AcOH |
|
||
|
|
|
|
|||
|
18a X = I; |
|
CH2N2 |
|
||
|
|
|
|
|
||
|
18b X = OAc |
|
|
|
|
|
|
|
O |
|
|
|
|
O |
|
MeO |
|
|
|
|
NTs |
+ O |
NTs |
+ O |
NTs |
||
MeO |
||||||
|
|
|
|
|
||
|
19 |
|
20 |
|
21 |
Таблица 1. Катализируемое никелем(0) и палладием(0) аннелирование/карбонилирование аминов 18a, b
Соединение |
Катализатор |
Условия реакции |
Выход продуктов, % |
||
|
|
(время, ч) |
|
|
|
|
|
|
19 |
20 |
21 |
|
|
|
|
|
|
18a |
Ni(CO)3PPh3 |
A (20) |
69 |
– |
– |
18a |
Ni(COD)2/dppb |
A (12) |
23 |
57 (20 : 1) |
– |
18b |
Pd(dba)2/PPh3 |
B (2) |
13 |
50 (7 : 1) |
16 |
A:25 мол. % Ni(0), THF/MeOH 4 : 1, CO (1 атм) комн. темп.;
B:10 мол. % Pd(0), HOAc, CO (1 атм), 45°С
Синтез карбоксилированных индолов и бензофуранов
Катализируемое хлористым палладием карбонилирование о-гексиниланилинов 22
и-фенолов 24 приводит соответственно к метил-2-бутилиндол-3-карбоксилату 23
иметил-2-бутилбензофуран-3-карбоксилату 25 [17] (схема 8).
Схема 8
|
|
O |
OMe |
|
|
|
|
|
|
|
i |
|
Bu |
|
|
|
N |
|
|
|
|
|
|
|
NH2 |
Bu |
H |
|
|
23 |
|
|
||
22 |
|
|
|
|
Избранные методы синтеза и модификации гетероциклов, том 2 |
67 |
|||
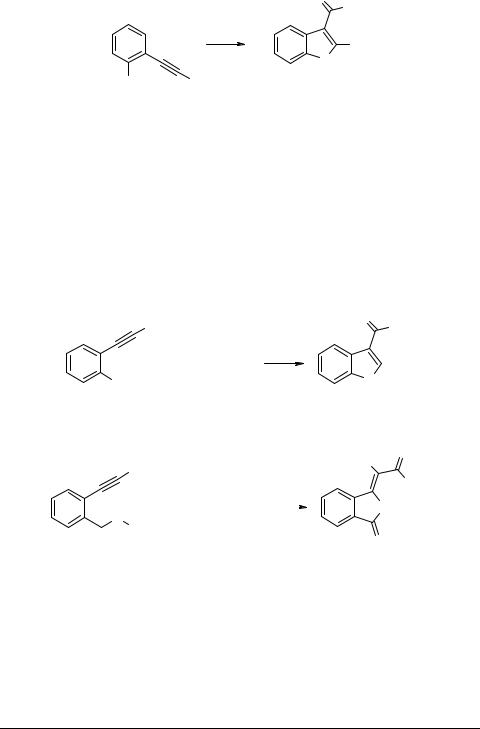
O
OMe
i
Bu O
OH Bu
24 |
25 (66%) |
|
i - CO, MeOH, NaOH, PdCl2, CuCl2 |
Обсужден механизм процесса, включающий образование промежуточного бициклического комплекса Pd, который карбонилируется с помощью СО до ацилпалладиевого комплекса, дающего в реакции с метанолом конечный продукт и частицы Pd0. Регенерация катализатора происходит в результате окисления Pd0 до
Pd2+ с участием CuCl2 [17].
Позднее область применения реакции была расширена, и получен ряд 2-заме- щенных 3-метоксикарбонилиндолов и бензофуранов 26. Из 2-алкинилформани- лидов в этих условиях образуются только лактамы 27 [18] (схема 9).
Схема 9
|
|
|
R |
|
|
|
|
O |
OMe |
|||
|
|
|
|
|
|
|
|
|
||||
|
|
|
+ CO |
+ |
|
i |
|
|
|
|
|
|
|
|
|
MeOH |
|
|
|
R |
|||||
|
|
|
X |
|
||||||||
|
|
XH |
|
|
|
|
|
|
|
|||
X = NSO2Me, NH, O; |
|
|
|
|
26 (19−79%) |
|
|
|
||||
|
|
|
|
|
|
|
|
|
||||
R = Ph, Bu, CO2Et |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
R |
|
|
O |
|
|
|
|
R |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
OMe |
|
|
|
|
|
|
|
i |
|
|
|
|
||
|
|
H |
+ CO |
+ |
MeOH |
N |
|
|
R' |
|||
|
|
|
|
|
||||||||
|
|
|
|
|||||||||
|
|
N |
R' |
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
O |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
27 (25−55%) |
|||||||
|
|
|
|
|
|
|
|
|||||
|
|
|
R = Ph, Bu; R' = H, Me |
|
|
|
|
|
||||
i - PdCl2, CuCl2, AcONa (или K2CO3), 3 ч, 20°С |
|
|
|
|
|
|||||||
Синтез непредельных лактамов и лактонов
α-Метилен-β-лактамы 28 образуются при карбонилировании α,α-дизамещенных пропаргилалкиламинов, тогда как γ-лактамы 29 или оксазолины образуются из незамещенных или ацилированных аминов [19] (схема 10).
68 |
Серия научных монографий InterBioScreen |
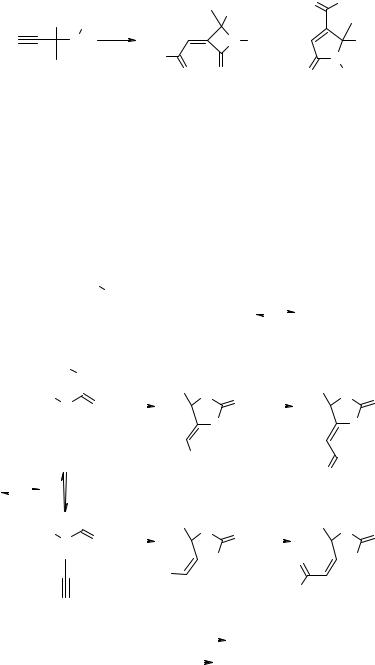
Схема 10
|
|
R |
O |
OMe |
R R' i |
|
|
|
|
|
N R' + |
|
R |
|
N |
|
|
||
H |
MeO |
|
|
N |
|
O 28 O |
|
O |
29 R' |
R = Me, Et; R' = Alk, H, COPh, COAlk
i - CO/воздух, Pd0/C, KI, MeOH
При одновременном взаимодействии пропинилалкиламинов с окисью и двуокисью углерода, катализируемом PdI2 или Pd0/C в присутствии KI, протекают последовательные реакции карбоксилирования и алкоксикарбонилирования с образованием оксазолинонов 30a, b [20] (схема 11). В отсутствие окиси углерода образуется только оксазолинон 31 (схема 12).
Схема 11
|
|
|
|
|
|
|
|
|
|
|
|
|
R NH |
|
+ CO2 |
|
+ PdI2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
R' |
|
|
|
|
R' |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
−HI |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
IPd O |
|
|
|
|
|
R' |
|
|
R |
|
|
|
CO, |
R' |
R |
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
R |
N |
|
|
|
O |
|
|
|
|
|
|
|
N |
O |
|
R"OH |
N |
O |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
R' |
|
|
|
|
|
R' |
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
−HI, |
|
|
|
|
|
|
|
O |
|
||||||||||||
|
|
|
R' |
|
|
|
|
|
|
R' |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
−Pd |
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
PdI |
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
OR" |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
KI |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
30a |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
O− |
|
|
|
|
|
R' |
|
|
R |
|
|
|
CO, |
R' |
R |
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
R |
N |
|
|
|
O |
|
|
|
|
|
|
|
N |
O |
|
R"OH |
N O |
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
R' |
|
|
|
|
R' |
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
−HI, |
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
R' |
|
|
|
|
|
|
|
R' |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
O |
|
|
|
O |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
IPd |
|
|
|
|
|
|
|
−Pd |
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OR" |
30b |
|
||||||||||
|
|
|
|
|
|
|
|
|
PdI2 |
+ |
1/2 O2 |
|
|
|
|
|
|
|
H2O + I2 |
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
2 HI |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Pd |
+ |
|
I2 |
|
|
|
|
|
|
|
PdI2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Избранные методы синтеза и модификации гетероциклов, том 2 |
|
|
|
|
69 |
|||||||||||||||||||||||||||||||||||||||||||

Схема 12
|
R' |
R |
|
R' |
R |
|
|||||
|
PdI2−KI |
|
|
|
|
||||||
|
N |
O |
|||||||||
|
|
|
+ |
|
|
|
|||||
|
|
N |
CO2 |
R' |
|
|
|
|
|
||
|
|
|
|
|
|||||||
|
|
|
|
|
|
||||||
|
|
|
|
|
|
||||||
|
R' H |
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
31 |
|||||
|
|
|
|
|
|
|
|
|
|||
Интерес к синтезу α-метилен-γ-бутиролактонов поддерживается благодаря высокой биологической активности и широкому спектру биологического действия природных продуктов, содержащих фрагмент α-метиленлактона [21, 22]. Например, элефантопин, ацетат эпаротона и вернолепин проявляют противоопухолевую активность [21], а природный сексвитерпеновый лактон фантомолин проявляет цитотоксическую активность [22]. Среди других методов синтеза таких структурных единиц каталитическое циклокарбонилирование ацетиленовых спиртов поначалу не имело большого значения, поскольку давало низкие выходы целевых α-метилен-γ-бутиролактонов 32 [23] (схема 13).
Схема 13
O
|
Ni(CO)4 |
OH |
O |
AcOH/H2O, 80°C |
|
|
32 (23%) |
Позднее был предложен [24, 25] общий метод синтеза α-метиленлактонов 33 в мягких условиях, заключающийся в циклокарбонилировании этинильных спиртов при катализе палладийорганическими комплексами (схема 14).
Схема 14
R OH |
|
|
O |
i |
|
|
|
+ CO |
O |
|
|
|
|
||
R' |
|
R |
R' |
|
|
33 (до 100%)
R, R' = H, (CH2)2Br, (CH2)2CH=CH;
R+R' = (CH2)3, (CH2)4, (CH2)5;
i - PdCl2 (0.07 экв.), SnCl2 (0.07 экв.), PPh3 (или PBu3) (0.14 экв.), CO (до 7.8 атм), MeCN, 65−75°C
70 |
Серия научных монографий InterBioScreen |
