
Периодический закон. 1 и 2 группы
.pdf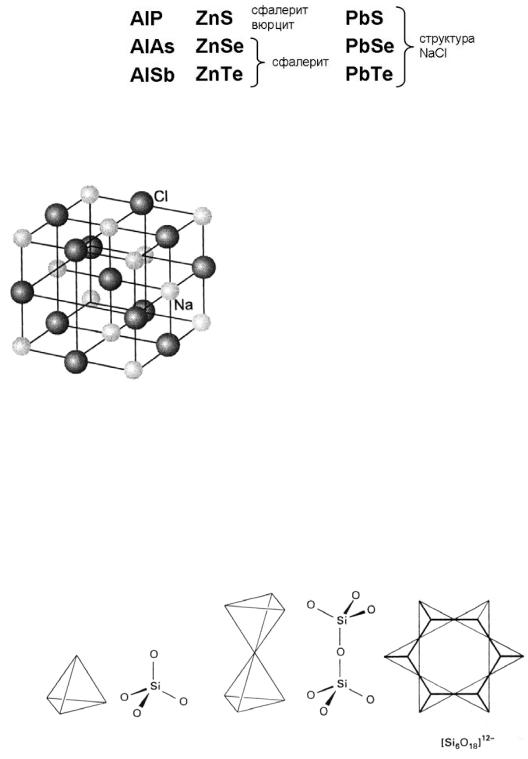
В верхнем ряду катионообразователи – это металлы средней и малой активности. Все эти соединения, в том числе и CuBr, кристаллизуются в структурном типе сфалерита. В нижнем ряду катионообразователи становятся всё более активными металлами, и разность электроотрицательностей в соединении существенно возрастает. Для членов изоэлектронных рядов возможно вертикальное изоэлектронное замещение по компоненту А:
Замещение может происходить и по компоненту В: AlP – GaP – InP. Таким образом, формируются семейства соединений – изоэлектронных аналогов: AIIIBV, AIIBVI и т.д. При вертикальном замещении анионообразователя связи в соединениях становятся менее полярными.
Для тип NaCl характерна гранецентрированная кубическая упаковка анионов, в которой катионы занимают октаэдрические пустоты (и наоборот), координационное число равно 6.
Состав AB2
В соединениях такого состава координационные числа атомов А и В не могут быть одинаковыми, как в эквиатомных.
Структурный тип SiO2 существует в виде нескольких структур (кварц, тридимит, кристобалит, α, β-кварц и т. д.). О ни бывают кубическими, гексагональными, но структурный мотив одинаков – тетраэдры SiO4 с общими вершинами. Здесь кремний окружён тетраэдрически четырьмя атомами кислорода, а кислород связан с двумя атомами кремния. Максимальное координационное число, равное 4, характеризует эту структуру как преимущественно ковалентную.
Рис. 16. Структурный тип SiO2, структурный мотив – тетраэдр SiO4
21

Структурный тип флюорита CaF2 (рис. 17). Кальций занимает положение ГЦК-ячейки, а фтор располагается в тетраэдрических пустотах – в центрах малых октантов. Координационное число кальция равно 8, координационное число фтора – 4, максимальное координационное число равно 8. Это ионная структура.
Структурный тип антифлюорита Li2O. Структура аналогична структуре флюорита, ностемотличием, чтоанионздесьзанимаетположениеГЦК-ячейки.
|
Координационное число кислорода равно 8, |
|
лития– 4. Этотакжеионнаяструктура. |
|
Структурный тип рутила TiO2 (рис. |
|
18). Координационное число титана равно |
|
6, кислорода – 3, максимальное равно 6. |
|
Структура более ионная, чем SiO2, но ме- |
|
нее ионная, чем CaF2. |
Рис. 17. Структурный тип |
Рассмотрим следующие примеры: |
− BeF2 изоморфен SiO2 – даже фтор в |
|
флюорита CaF2 |
соединении с бериллием не образует ниче- |
го более ионного, чем структурный тип SiO2. Отсюда можно сделать определённые выводы о химии бериллия: его амфотерность, склонность к образованию гидроксокомплексов, склонность солей к сильному гидролизу по катиону и т. д.
− AlPO4 изоморфен SiO2 – если рас- |
|
смотреть SiO2 · SiO2 и изоэлектронный |
|
аналог AlO2 · PO2, то можно проследить |
|
горизонтальную аналогию в ряду Al – Si – |
|
P (первая тройка по правилу Гунда). |
|
Правило октета |
|
При образовании химических связей |
Рис. 18. Структурный тип |
у одного из элементов в бинарном соеди- |
|
нении формируется октетная электронная |
рутила TiO2 |
|
конфигурация, что для простых веществ выражается правилом Юм-Розери, а для бинарных соединений – правилом октета:
ne = 8. na
Правило октета в обычном виде применимо для соединений, содержащих только связи типа K – A (катион – анион), т. е. подчиняющихся правилу формальной валентности.
Для анионоизбыточных фаз, содержащих связи А – А, используется правило Музера – Пирсона:
ne + ba = 8. na
22

Это обобщенное правило октета. Его действие можно рассмотреть на следующих примерах:
Cd3P2 (2 · 3 + 5 · 2)/2 + ba = 8, ba = 0; CdP2 (2 + 5 · 2)/2 + ba = 8, ba = 2;
CdP4 (2 + 5 · 4)/4 + ba = 8, ba = 2,5 = 5/2.
Нецелое число (А – А-связей) однозначно указывает на наличие структурно неэквивалентных атомов анионообразователя. Проиллюстрируем на при-
мере пропана: C3H8 (3 · 4 + 1 · 8)/3 + ba = 8, ba = 3/4.
Здесь центральный атом углерода неэквивалентен двум крайним.
Рассмотрим ещё пример:
GeAs2 (4 + 5 · 2)/2 + ba = 8, ba = 1; GeAs (4 + 5)/1 + ba = 8, ba = –1.
Отрицательное число анион-анионных связей указывает на то, что здесь имеется одна связь К – К. Следует отметить, что правилом Музера – Пирсона можно пользоваться, когда менее электроотрицательный элемент является s-,p-элементом или d-элементом подгруппы меди и цинка с завершённой d-оболочкой. Для соединений переходных металлов с дефектными d- оболочками этим правилом пользоваться не удаётся, т. к. невозможно оценить, сколько валентных электронов участвует в образовании связи.
Природа химической связи в бинарных соединениях
При рассмотрении химической связи в бинарных соединениях можно выделить три основных случая:
−Оба компонента расположены слева от границы Цинтля: доми-
нирует металлическая связь (исключение – некоторые богатые бором бориды), плотноупакованные структуры;
−Оба компонента расположены справа от границы Цинтля: реа-
лизуется преимущественно ковалентная связь, неплотноупакованные структуры;
−Компоненты расположены по разные стороны от границы Цинтля: наблюдаются ионно-ковалентные взаимодействия (исключение – фазы внедрения AB, AB2 (иногда AB3) – TiB, TiC, TiN, VB, VN, VC, TiH2,
VH2, AB1–x, AB2–x, AB3–x).
3.2. Основные классы бинарных соединений
Классификация бинарных соединений осуществляется по типу анионообразователя. Выделяют группы галогенидов (F, Cl, Br, I), халькогенидов (S, Se, Te), пниктогенидов (N и P). Для IVA-группы группового названия нет, рассматриваются карбиды, силициды, германиды, IIIA-группа – только бориды.
23
Кислородные соединения – оксиды
Особую роль в химии играют оксиды. Во-первых, из-за того, что кислород – самый распространённый элемент на Земле, во-вторых, по электроотрицательности он уступает только фтору. В-третьих, в настоящее время не получены оксиды всего трёх элементов – гелия, неона и аргона.
Оксиды играли важную роль при создании Периодической системы элементов. Д.И. Менделеев рассматривал «высшие солеобразующие окислы» как характеристические соединения, по свойствам которых можно наиболее полно выявить химическую природу элементов. Высшая валентность элемента по кислороду определяла принадлежность элемента к той или иной группе Периодической системы.
С современной точки зрения оксиды классифицируются по природе химической связи: с преимущественно металлической связью (фазы внедрения типа Ti6O, Ti3O), с преимущественно ионной связью (Li2O, MgO), с преимущественно ковалентной связью (SiO2, TiO2, CO2, NO2 и т. д). Кроме того, следует различать оксиды, подчиняющиеся правилу формальной валентности, оксиды с ионно-ковалентным типом связи.
Солеобразующие:
–основные (оксиды металлов в невысоких степенях окисления);
–кислотные (оксиды неметаллов в любых степенях окисления и металлов в высоких степенях окисления);
–амфотерные (оксиды металлов в промежуточных степенях окисле-
ния +2…+4 при ОЭО 1,4…1,8);
Несолеообразующие (CO, N2O, NO) – им не соответствуют гидроксиды и от них не происходят соли.
Также следует отличать соединения, не подчиняющиеся правилу формальной валентности:
−анионоизбыточные соединения;
−пероксиды (Na2O2, CaO2, …), степень окисления кислорода –1;
−супероксиды (надпероксиды) (KO2, …) степень окисления кисло-
рода –1/2;
−озониды (KO3, …) степень окисления кислорода –1/3;
−катионоизбыточные соединения – металлидные фазы типа соеди-
нений Курнакова (Ti6O, Ti3O, …).
К характеристическим оксидам относятся только ионно-ковалентные оксиды, подчиняющиеся правилу формальной валентности.
В зависимости от доминирующего типа химической связи в характеристических оксидах закономерно изменяется их структура. Для преимущественно ионных оксидов существует только координационные структуры с высокими координационными числами. Для преимущественно ковалентных оксидов возможны как координационные, так и молекулярные структуры (а также псевдомолекулярные – слоистые, цепные).
24

Оксиды типа ЭО.
Структурный тип NaCl: такие оксиды, как MgO, PbO, TiO и т.д.
К.ч. = 6; 6.
Структурный тип вюрцита: ZnO, BeO, к.ч. = 4; 4. Сфалеритная структура в оксидах не наблюдается, т.к. слишком высока электроотрицательность кислорода.
Оксиды типа ЭО2 (Э2О).
Структурный тип антифлюорита: Li2O, Na2O, к.ч. = 8; 4. Структурный тип рутила: SnO2, TiO2, GeO2, к.ч. = 6; 3.
Оксиды типа ЭО2.
Структурный тип SiO2 с к.ч. = 4; 2.
Молекулярные структуры: СО2, имеются малополярные ковалентные связи.
Таблица 2.
Структуры характеристических оксидов элементов IVA-VIIA-групп
25

Рис. 19. Область существования амфотерных оксидов для элементов-металлов
Амфотерные свойства оксидов
В отличие от гидроксидов многие амфотерные оксиды (ZnO, Al2O3, Cr2O3 и т.д.), особенно прокаленные, обладают малой реакционной способностью – проявляют амфотерность только в жестких условиях, при сплавлении:
Al2O3 + 2NaOH(безвод.) → 2NaAlO2 + H2O
Al2O3 + 3K2S2O7(безв.) → Al2(SO3)3 + 3K2SO4
Водородные соединения
Классификация
•Солеобразные гидриды: гидриды щелочных и щелочно-земельных металлов (LiH, NaH, …, CaH2);
•Полимерные и димерные гидриды: водородные соединения легких элементов IIA и IIIA-групп ((BeH2)x, (MgH2)x, (AlH3)x, B2H6, Ga2H6);
•Металлоподобные гидриды: фазы внедрения на основе переходных металлов с дефектной d-оболочкой (MeH1–x, MeH2–x, MeH3–x);
•Летучие водородные соединения (характеристические соединения): Молекулярные водородные соединения элементов (IVA–VIIA-групп)
•ЭIVH4 (CH4, SiH4, …)
•ЭVH3 (NH3, PH3, …)
•ЭVIH2 (H2O, H2S, …)
•ЭVIIH (HF, HCl, …)
Особенности номенклатуры.
Относительная электроотрицательность водорода равна 2,1. По этому признаку он занимает среднее положение между наиболее и наименее
26

электроотрицательными элементами. Поэтому с менее электроотрицательными элементами водород выступает в качестве анионообразователя, с более электроотрицательными – в роли катионообразователя. Таким образом, гидрид – бинарное соединение водорода с менее электроотрицательным элементом (степень окисления равна –1). Существуют солеобразные и полимерные гидриды элементов IA-IIIA-групп. Металлоподобные фазы внедрения являются гидридами условно (водород здесь не анионообразователь, говорить о степени окисления бессмысленно). Для элементов IVгруппы: CH4 → H4C – это карбид водорода (ОЭО(С) = 2,6). Однако, SiH4 – это гидрид кремния (ОЭО(Si) = 1,9), GeH4 – гидрид германия (ОЭО(Ge) = 2,0), SnH4 – гидрид олова (ОЭО(Sn) = 1,8). Для присвоения названия ис-
пользуется единообразная тривиальная номенклатура и формально степень
окисления: C(–4)H4(+1) – метан; Si(–4)H4(+1) – силан; Ge(–4)H4(+1) – герман; Sn(– 4)H4(+1) – станнан.
Для элементов V-группы: NH3 → H3N – нитрид водорода (ОЭО(N) = 3,0). Однако, PH3 – гидрид фосфора, фосфид водорода (ОЭО(P) = 2,1), AsH3 – гидрид мышьяка, SbH3 – гидрид сурьмы, BiH3 – гидрид висмута.
Построение названий аналогично элементам IVA-группы: N(–3)H3(+1) – аммиак (аммин); P(–3)H3(+1) – фосфин; As(–3)H3(+1) – арсин;
Sb(–3)H3(+1) – стибин; Bi(–3)H3(+1) – висмутин.
Многие переходные металлы образуют гидриды с преимущественно металлическим характером связи и они являются фазами внедрения. Отношение d-металлов к водороду схематично представлено на рисунке 20.
Рис. 20. Отношение d-металлов к водороду
27

Рис. 21. Изменение температур плавления в изо-рядах характеристических водородных соединений.
На рисунке 21 представлены изменения температур плавления в рядах характеристических водородных соединений элементов IVА – VIIАгрупп. Водородные соединения первых элементов VА – VIIА-групп (NH3, H2O, HF) заметно отличаются от своих более тяжёлых аналогов, что связано с образованием водородных связей.
Характер диссоциации в водных растворах.
Полярность связей в молекулах летучих гидридов возрастает при переходе от элементов IVA группы к элементам VIIA группы и уменьшается в пределах каждой группы сверху вниз. Соответственно изменяется отношение к воде, а также кислотно-основные свойства продуктов. Чем менее прочна или более полярна связь, тем легче происходит электролитическая ионизация по этой связи в водных растворах.
Преимущественно ковалентные соединения IVA группы плохо растворимы в воде и хорошо – в неполярных органических растворителях. В растворе они медленно гидролизуются с образованием гидроксокомплексов и выделением водорода. Взаимодействие между CH4 и H2O не происходит.
Соединения элементов VA группы хорошо растворимы в воде и продукты взаимодействия диссоциируют по основному типу:
28

NH3 + H2O R NH4+ + OH– (раствор – основание) Дальше – для элементов VIА группы:
H2O + H2O R H3O+ + OH– (идеальный амфолит)
Более полярные H2S, H2Se и H2Te при растворении в воде диссоциируют по кислотному типу:
H2S → H2Se → H2Te
Сила кислот в данном ряду увеличивается.
Галогеноводороды, как более полярные соединения, ещё лучше растворимы в воде, причём их водные растворы являются уже сильными кислотами (кроме HF).
H2O + HF R H3O+ + F– (раствор – кислота)
Сила кислот возрастает в ряду HCl → HBr → HI, несмотря на то, что полярность падает. Однако в этом же направлении падает и прочность связи.
Галогениды
Ни один из галогенов ни с одним из элементов Периодической Системы не образует металлоподобных фаз. По отношению к галогенам все элементы выступают как катионообразователи, максимальное количество атомов галогена на формульную единицу часто соответствует номеру группы, т.е. максимальной валентности последнего. В ряду F – Cl – Br – I
29

максимальная валентность элемента по галогену уменьшается: SF6 есть, а SCl6 не существует; есть PF5, PCl5, но есть лишь PBr3 и PI3.
Для галогенов характерно образование соединений, отвечающих промежуточным степеням окисления элементов. Повышение температуры способствует термической диссоциации, что приводит к понижению степени окисления катионообразователя:
Галогены также следует отнести к характеристическим соединениям элементов, т.к. в них чётко прослеживается взаимосвязь между положением элемента в Периодической Системе, характерными для него степенями окисления и их сравнительной устойчивостью в различных условиях. Галогениды даже более универсальны и дают больше информации о химической природе элемента, нежели оксиды и водородные соединения, т.к. они все подчиняются правилу формальной валентности.
Структуры галогенидов делятся на два основных типа: ионные и ковалентные. Последние в свою очередь – на координационные и молекулярные (и псевдомолекулярные – слоистые и цепные). Условная граница между этими двумя типами – диагональная граница между металлами и неметаллами. Ионные структуры образуются в случае, когда степень окисления элемента не выше +2 и элемент располагается слева от границы. Типичные структуры – NaCl, CsCl, CaF2. Когда разность электроотрицательностей недостаточна для возникновения ионных соединений, наблюдаются координационные структуры сфалерита (CuBr, CuI), вюрцита (AgI) и рутила (ZnF2), реже – слоистые структуры (HgBr2, HgI2). Если степень окисления +1 существует для неметаллического элемента, галогениды образуют молекулярные структуры: S2Cl2, SCl2. При более высоких степенях окисления катионообразователя образуются псевдомолекулярные и молекулярные структуры.
Тпл, оС1050 |
|
|
1000 |
NaF; 995оС |
|
950 |
|
|
900 |
|
|
850 |
NaCl; 800оС |
|
800 |
||
NaBr; 750оС |
||
750 |
||
|
||
700 |
|
|
650 |
NaI; 662оС |
|
600 |
|
|
|
30 |
Ионные кристаллы обнаруживают тенденцию к уменьшению температуры плавления при переходе от фторидов к иодидам, что связано с уменьшением прочности связи за счёт увеличения радиуса анионообразователя (рис. 22).
Рис. 22. Температуры плавления
