
Периодический закон. 1 и 2 группы
.pdf
Cl2, Br2, I2
к. ч. = 8 – 7 = 1, молекулярная решетка.
VIII А группа
кристаллы благородных газов к. ч. = 8 – 8 = 0, одноатомные молекулы.
Исключения из правила 8 — N
Для Pb, Bi, Po характерны плотноупакованные структуры с металлическим типом связи. С увеличением атомного номера элемента возрастает количество электронных слоёв и уменьшаются различия в энергиях соседних орбиталей. Вследствие этого у тяжёлых аналогов при образовании простых веществ валентные электроны могут попадать на вакантные 6d-орбитали. Наблюдается дефицит электронов, что приводит к возникновению плотноупакованных структур с металлическим типом связи.
B – неметаллические свойства, обусловленные кайносимметричностью 2p-орбитали. Дефицит валентных электронов, в кристаллических модификациях их обобществление, ограниченное локальными атомными группами. Структурный элемент –
икосаэдр (рис. 6). Каждый из атомов бора внутри икосаэдра связан с пятью соседями, а атомы в вершинах осуществляют сочленение икосаэдров друг с другом непосредственно или через промежуточные атомы бора.
Следует отметить, что граница Цинтля не является границей между металлами и неметаллами, а лишь разграничивает элементы с избытком и дефицитом валентных электронов, что определяет особенности кристаллохимического строения простых веществ. Граница между металлами и неметаллами проходит по диагонали от B к At между элементами: B – Al, Si – Ge, As – Sb, Te – Po. Однако эта граница достаточно условна, существуют элементы и отвечающие им простые вещества, которые по одним свойствам напоминают металлы, а по другим – неметаллы. Эти элементы: Al, Ga, In, Sn, Sb, As – расположены вблизи диагональной границы.
2.2. Физические свойства простых веществ
Молярный объем
Фундаментальной характеристикой простого вещества является молярный объем, представляющий собой отношение молярной массы вещества к его плотности:
d[ã/ ñì 3 ] = |
m[ã] |
|
= |
|
M[ã/ ì î ëü] |
|
=> |
V |
|
ñì 3 |
= |
M[ã/ ì î ëü] |
||
|
|
|
|
|
|
|
|
|
|
|||||
V[ñì 3 |
] |
V [ñì 3 |
/ ì î ëü] |
|
ì î ëü |
d[ã/ ñì 3 ] |
||||||||
|
|
|
m |
|
||||||||||
|
|
|
|
|
m |
|
|
|
|
|
|
|
|
|
11
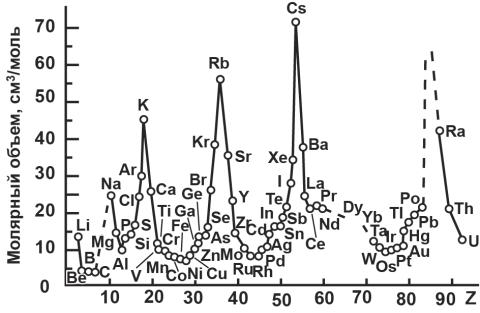
Молярный объем простых веществ – одно из первых свойств, которое подтвердило явление периодичности. На рис. 7 представлена зависимость молярного объема от порядкового номера элемента.
Рис. 7. Зависимость молярного объема гомоатомных соединений от порядкового номера элементов
Зависимость показывает, что при монотонном возрастании мольной массы мольный объём изменяется отчётливо периодически. У s- и p- элементов II и III периодов (малых) закономерность очень чёткая и простая
(рис. 7).
Наибольшими мольными объёмами обладают щелочные металлы, затем к II- и IIIAгруппам мольные объёмы уменьшаются, несмотря на возрастание мольной массы. Все эти структуры плотноупакованные, и уменьшение обусловлено более резким возрастанием плотности в знаменателе выражения по сравнению с мольной массой в числителе. С середины периодов, несмотря на продолжающееся уменьшение атомного радиуса, мольный объём начинает возрастать. Это обусловлено тем, что для элементов, расположенных справа от границы Цинтля, реализуются уже более рыхлые упаковки и плотность всё время уменьшается. Можно было бы ожидать, что наибольшими мольными объёмами в каждом периоде должны обладать кристаллы благородных газов, но у них реализуются плотноупакованные структуры (хотя и за счёт сил Ван-дер-Ваальса), поэтому плотность оказывается несколько выше ожидаемой, а мольный объём – несколько ниже. Для d-элементов атомный радиус меняется несильно, поэтому и мольные объёмы также изменяются несильно с незначительным минимумом в районе триад.
12
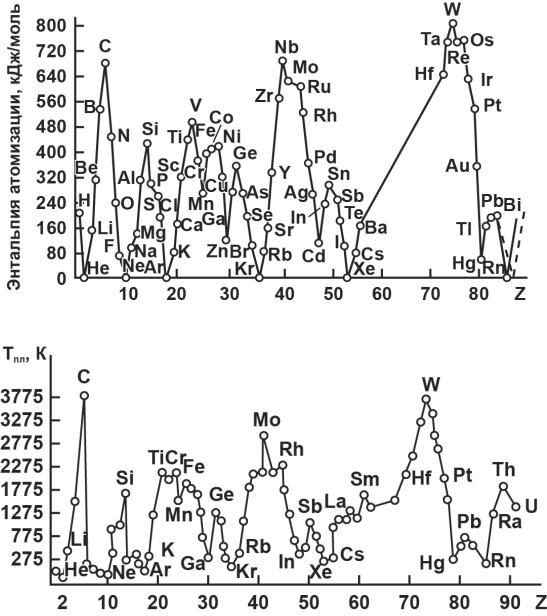
Энтальпия атомизации и температура плавления
В зависимостях энтальпии атомизации и температуры плавления от порядкового номера также имеются определённые черты сходства и различия (рис. 8, 9). У s- и p-элементов закономерности в общем совпадают. Наименьшими энтальпиями и температурами плавления обладают кристаллы благородных газов. Максимальные значения – у элементов IVAгруппы (алмазоподобные структуры).
Рис. 8. Зависимость энтальпии атомизации гомоатомных соединений от порядкового номера элементов
Рис. 9. Зависимость температуры плавления гомоатомных соединений от порядкового номера элементов
Если рассматривать d-элементы, то здесь закономерности несколько иные. Энтальпии плавления для кайносимметричных d-элементов чётко демонстрируют внутреннюю периодичность (две пятёрки). У марганца и цинка наименьшие энтальпии плавления вследствие стабильных d5- и d10-
13

конфигураций. Однако, если энтальпия плавления максимальна у ванадия, то температура плавления максимальна у хрома. За счёт проскока электрона у хрома реализуется наибольшее число дополнительных ковалентных связей, что упрочняет кристаллическую структуру и повышает температуру плавления. Аналогичная ситуация в V и VI периодах.
Максимальной температурой плавления там обладают аналоги хром,
молибден и вольфрам. Существенно
Рис. 10. Изменение температур плавле- то, что в подгруппе хрома сверху ния в подгруппах d-элементов
вниз температуры плавления возрастают, что объясняется увеличением прочности дополнительных ковалентных связей в структуре. В то же время в начале и в конце d-рядов (IIIB- и IIВ-группы) температуры плавления сверху вниз падают, как и в главных подгруппах. В целом получается так, как показано на рис. 10.
Энергии диссоциации двухатомных молекул гомоатомных соединений
На рис. 11 представлена зависимость энергии диссоциации двухатомных молекул от порядкового номера элемента. Двухатомных молекул не так много, поэтому эта зависимость не столь полная, но всё же достаточно наглядная. Помимо известных двухатомных молекул газов, подобные молекулы образуют щелочные металлы в паре, элементы подгруппы меди, углерод при очень высоких температурах. На рисунке видна периодичность, естественным образом объясняющаяся различием в прочностях связей с максимумом у элементов VA-группы (тройные связи) и абсолютным рекордом в молекуле азота N2 (кайносимметрия 2р-орбитали и малая длина связи).
Рис. 11. Энергии диссоциации двухатомных молекул гомоатомных соединений
14
2.3. Химические свойства простых вкществ
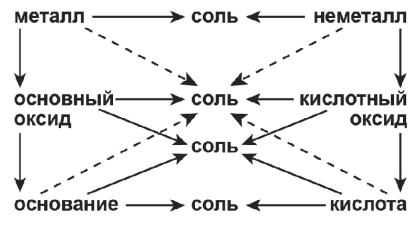
Простые вещества являются родоначальниками генетических рядов с взаимно противоположными свойствами. Ниже приведена генетическая связь между основными классами неорганических веществ (рис. 12):
Рис. 12. Генетическая связь между основными классами неорганических веществ.
Противоположные по свойствам объекты из двух генетических рядов взаимодействуют между собой, взаимно нейтрализуя свои противоположные качества и образуя при этом соль. Рассмотрим реакции:
Ca(OH)2 + Н2SO4 = CaSO4 ↓ + 2H2O
CaO + H2SO4 = CaSO4 ↓ + H2O
Ca(OH)2 + SO3 = CaSO4 ↓ + H2O
CaO + SO3 = CaSO4 ↓
Ca + H2SO4 = CaSO4↓ + H2↑
В первом случае выделяется 2 моля воды, во втором и третьем – по одному молю, в четвёртом – вообще не выделяется. Это объясняется тем, что в первом случае обе формы гидратированы, во втором и третьем одна из них гидратирована. Химическая сущность взаимного сродства от этого не меняется. Производные кальция и серы, обладая противоположными свойствами, взаимно нейтрализуют друг друга в широком смысле. В этом смысле главный продукт нейтрализации –это соль. Последняя реакция относится к окислительно-восстановительным, но химическая сущность ки- слотно-основного в широком смысле взаимодействия от этого не меняется. При взаимодействии простых веществ друг с другом окислительновосстановительный аспект выступает на первый план. Но при этом, по крайней мере, в ярко выраженных случаях, образуются соли бескислородных кислот, т. е. осуществляется нейтрализация в широком смысле.
Изучение химических свойств простых веществ – это первый этап в описательной химии элементов. Он позволяет выявить поведение в агрес-
15
сивных средах, типичные степени окисления, характер образующихся оксидов и гидроксидов и в целом наметить общие черты химии соответствующих элементов.
2.4. Нахождение в природе и общие принципы получения простых веществ
Распространённость в природе и основные формы природных соединений уже дают важную предварительную информацию о химии соответствующего элемента. Так, например, активные щелочные металлы могут существовать в природе в виде солей сильных кислот. Щелочно-земельные металлы уже не образуют хлоридов в природе, а в основном представлены труднорастворимыми сульфатами и карбонатами. Ещё менее активные металлы – алюминий, железо – уже представлены в основном оксидногидроксидными соединениями. Далее – сульфоарсенидные минералы (свинец, висмут, сурьма), полиметаллические руды. И наконец, самородные – золото, платина и ртуть. Таким образом, металлы в природе в основном находятся в окисленном состоянии, и для выделения их из руд металлы надо восстанавливать. Обратные подобные закономерности свойственны неметаллам. Наиболее активные неметаллы – фтор, хлор – встречаются в природе исключительно в восстановленном состоянии. Сера может быть как в восстановленном (сульфиды), так и в окисленном (сульфаты) состоянии. Ещё менее активные неметаллы, такие как фосфор и кремний, находятся в природе исключительно в окисленном состоянии.
Распространенность в природе также существенно различается. Лёгкие элементы с массовыми числами до 59 составляют более 99 атомных долей, процентов атмосферы, гидросферы и литосферы, причём около 80 % приходится лишь на три элемента: кислород, кремний и алюминий.
Необходимо различать два момента: общее содержание элемента на Земле и способность концентрироваться, образуя месторождения. Типичный пример – медь. Её общее содержание порядка приблизительно 10–3 % сравнительно невелико, но медь известна с глубокой древности благодаря способности концентрироваться с образованием месторождений.
Существуют редкие и рассеянные элементы. Редкими называют элементы, содержание которых на Земле невелико – 10–4–10–5 % и меньше, а рассеянными – элементы, не образующие собственных месторождений.
Общие принципы получения простых веществ приведены в табл. 1. Применительно к металлам общий принцип таков: чем более активный металл, тем более энергичный восстановитель требуется для его выделения. Малоактивные металлы можно восстанавливать водородом (на-
пример, медь из оксида меди CuO).
16
|
|
|
Таблица 1 |
Основные способы получения простых веществ |
|||
Метод |
Исходная форма |
Получаемые вещества |
|
|
Физические методы |
|
|
Разделение смесей |
Самородные |
простые ве- |
S, Au, Pt, Hg, Ag, платиновые |
|
щества |
|
металлы |
Фракционная перегонка |
Воздух (жидкий) |
O2, N2, благородные газы |
|
|
Химические методы |
|
|
А. Восстановление |
|
|
|
Водородное |
Оксиды, галогениды, соли |
Ga, In, Si, Ge, Mo,W, Re, В |
|
Карботермия |
Оксиды, соли |
|
Fe, Co, Ni, Cr, Mn, Si, Pb, Sn, |
|
|
|
Zn, Cd, Cu, P, As Sb, Bi, Mo,W |
Алюмотермия |
Оксиды |
|
Fe, Co, Ni, Cr, Mn, щелочно- |
|
|
|
земельные металлы |
Цинктермия |
Галогениды, соли |
Si, Ag, Au |
|
Магнийтермия |
Оксиды, галогениды |
Be, Ti, Zr, Hf, Si, B |
|
Кальцийтермия |
Оксиды, галогениды |
U, V, Nb, Ta, Sc, Y, La, ланта- |
|
|
|
|
ниды |
Щелочными металлами |
Оксиды |
|
Nb, Ta, Ti, Zr, Hf |
Катод электролизёра |
Галогениды, соли, вода |
Щелочные, щелочно-земель- |
|
|
|
|
ные металлы, Al, Ga, In, Tl, Be, |
|
|
|
Mg, Zn, лантаниды, Pb, Nb, Ta, |
Б. Окисление |
|
|
Mn, Cu, H2 |
|
|
|
|
Вытеснение хлором |
Бромиды, иодиды |
Br2, I2 |
|
Анод электролизёра |
Расплавы фторидов, рас- |
Cl2, F2, O2 |
|
|
творы, расплавы |
|
|
В. Разложение и |
хлоридов, вода |
|
|
Галогениды, |
субгалоге- |
Si, Ge, Ti, Zr, Hf, Mo, V, Nb, Ta, |
|
диспропорционирование |
ниды (кроме фторидов) |
Al, B |
|
|
Карбонилы |
|
Fe, Co, Ni, Mn |
Металлы, находящиеся в ряду напряжений до водорода, уже данным способом не получают. В качестве восстановителя можно использовать уголь при высоких температурах (карботермия). Более энергичными восстановителями являются активные металлы при высоких температурах – цинктермия, алюмотермия, кальцийтермия. А самые активные металлы – щелочные – можно восстановить лишь электрохимически. Самый сильный восстановитель – катод электролизёра.
Если элемент встречается в природе в самородном или свободном состоянии, то его выделение осуществляется физическими методами (сжижение и разгонка воздуха при получении N2 и О2, выплавка серы из месторождений).
17
ГЛАВА 3. БИНАРНЫЕ СОЕДИНЕНИЯ
Бинарные соединения – следующий качественный скачок на пути усложнения химической организации вещества. Здесь появляются два принципиально новых понятия:
–состав и связанные с ним проблемы постоянства состава;
–разность электроотрицательностей взаимодействующих атомов и, следовательно, все эффекты, связанные с поляризацией связи.
С этой точки зрения можно сказать, что изучение более сложных объектов, чем бинарные соединения, ничего качественно нового в химию элементов уже не внесёт, и поэтому бинарные соединения – очень важный класс объектов. Многие из них относятся к характеристическим соединениям, свойства которых наиболее ярко прорисовывают химическую природу элемента.
При образовании бинарных соединений реализуются 3 варианта взаимодействий:
Номенклатура
При записи формул бинарных соединений принято сначала писать менее, а затем более электроотрицательный элемент. Называются они в русской номенклатуре в обратном порядке – сначала более электроотрицательный, затем менее. Для более электроотрицательного элемента используется корень его латинского названия с окончанием «-ид» (например, CuO (оксид меди (II)), PbS (сульфид свинца)).
Бинарные соединения иногда называют идо-соединениями. Следует отметить, что эта номенклатура справедлива лишь для соединений с ион- но-ковалентным типом взаимодействия. Для интерметаллических соединений, где элемента-анионообразователя нет, такая номенклатура не используется. ИЮПАК рекомендует здесь нейтральную номенклатуру, например, Cu3Au (тримедьзолото).
3.1. Важнейшие структурные типы, характерные для бинарных соединений
В зависимости от природы химической связи в бинарных соединениях закономерно изменяется тип кристаллической решётки. Для интерметалличе-
18
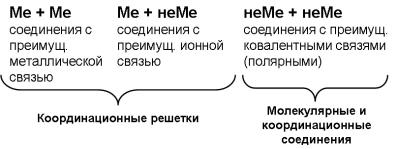
ских соединений характерны плотноупакованные структуры, плотнейшие шаровые упаковки с высоким координационным числом (8, 12).
Рис. 13. Структура |
Рис. 14. Структура |
сфалерита |
вюрцита |
Для преимущественно ионных кристаллов также характерны плотноупакованные структуры, но координационное число здесь несколько меньше (обычно 6 или 8), что связано с тем, что в ионных кристаллах упаковываются шары разных размеров и их плотно упаковать нельзя. Для ковалентных кристаллов характерны «рыхлые» структуры с невысокими координационными числами (как правило, не выше 4), что обусловлено направленностью и насыщаемостью ковалент-ной связи. Ниже приведено несколько важных структурных типов, характерных для бинар-ных соединений.
Состав AB
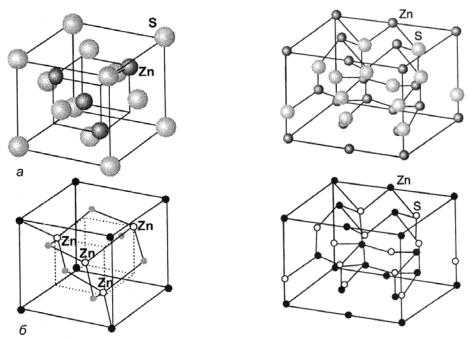
Для эквиатомных бинарных соединений состава АВ в основном встречаются 3 структурных типа: сфалерита, вюрцита и типа NaCl.
Структурный тип сфалерита (рис. 13) принадлежит к кубической сингонии и напоминает решётку алмаза, хотя и обладает более низкой симметрией вследствие наличия двух сортов атомов. Координационное число равняется 4, что соответствует sp3-гибридизации, тетраэдрическим ковалентным связям.
Структурный тип вюрцита (рис. 14) принадлежит к гексагональной сингонии, координационное число также равняется 4. Если сравнивать между собой структуры сфалерита и вюрцита, то можно заметить, что у вюрцита вершины двух смежных тетраэдров расположены друг над дру-
19
гом, а в структуре сфалерита тетраэдры развёрнуты на 60о. Это хорошо видно, если структуру сфалерита сориентировать в направлении <111>. В известном смысле структура сфалерита напоминает заторможенную конформацию этана, а структура вюрцита – заслонённую. В бинарных соединениях АВ в заслонённой конформации оказываются разные атомы, разноимённо заряженные, и дополнительные электростатические взаимодействия стабилизируют вюрцитную структуру. Она оказывается наиболее устойчивой, когда связь в соединении более полярна.
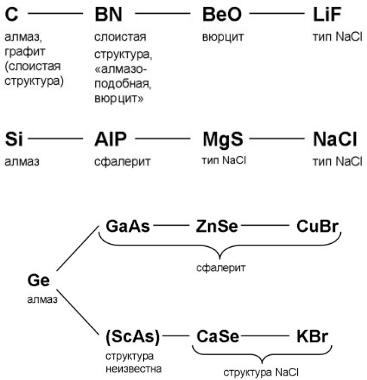
Эта закономерность наглядно иллюстрируется в так называемых изоэлектронных рядах, построенных на основе элементов IVA-группы. Изоэлектронным рядом называется последовательность соединений с одинаковым средним числом электронов на атом в формуле. Первый изоэлектронный ряд выглядит следующим образом:
C – BN – BeO – LiF.
Все члены этого ряда имеют в среднем 4 электрона на атом в формуле, но при таком замещении последовательно возрастает разность электроотрицательностей, связи становятся более полярными и закономерно изменяется тип структуры. Для углерода существуют тетраэдрическая структура алмаза и слоистая структура графита. У нитрида бора BN слоистая графитоподобная структура и тетраэдрическая «алмазоподобная» (сфалеритная) структура. Кроме того у BN появляется уже и вюрцитная структура. Для BeO существует только вюрцитная структура, LiF – преимущественно ионная связь и реализуется структура типа NaCl.
Следующий ряд выглядит так: Si – AlP – MgS – NaCl.
Для элементов больших периодов в изоэлектронных рядах возможно раздвоение по главным и побочным группам.
20
