
Периодический закон. 1 и 2 группы
.pdf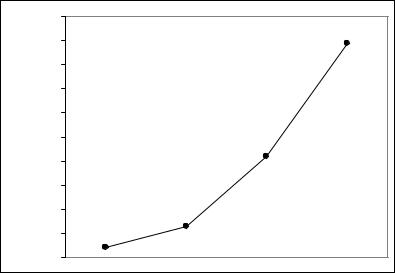
галогенидов натрия
Для молекулярных кристаллов галогенидов наблюдается обратная закономерность, т.е. увеличение температуры плавления за счёт усиления межмолекулярых взаимодействий вследствие роста поляризуемости анионообразователя в ряду F – Cl – Br – I. Температуры плавления ниже, чем у ионных галогенидов:
Тпл, оС 150 |
|
125 |
SiI4; 122оС |
|
|
100 |
|
75 |
|
50 |
|
25 |
|
0 |
SiBr4; 5оС |
|
|
-25 |
|
-50 |
|
SiF4; -90оС |
SiCl4; -68оС |
-75 |
|
-100 |
|
Рис. 23. Температуры плавления галогенидов кремния |
|
Галогениды можно подразделить на две группы по отношению к воде. К первой группе преимущественно относятся ионные галогениды – хорошо диссоциируют и не подвергаются гидролизу. Ко второй – преимущественно ковалентные галогениды неметаллов и некоторых переходных металлов в высшей степени окисления, в сильной степени склонные к гидролизу:
BBr3 + 3H2O → 3HBr + H3BO3
SiCl4 + 2H2O → 4HCl + SiO2
Такие галогениды «дымят» на воздухе вследствие интенсивного гидролиза. CCl4, SF6, NI3 в воде нерастворимы (нет гидролиза).
Окислительная активность галогенов уменьшается от фтора к иоду и в этом же направлении увеличивается восстановительная активность гало- генид-ионов Г-. Изменение восстановительных свойств:
NaF(к) + H2SO4(конц) → NaHSO4 + HF↑
NaCl(к) + H2SO4(конц) → NaHSO4 + HCl↑
В этих двух реакциях F- и Сl- не проявляют восстановительных свойств.
2NaBr(к) + 2H2SO4(конц) → Na2SO4 + Br2 + SO2↑ + 2H2O Br– восстанавливает H2SO4 до SO2
8NaI(к) + 5H2SO4(конц) → 4Na2SO4 + 4I2 + H2S↑ + 4H2O I– восстанавливает H2SO4 до H2S
31

Большинство галогенидов (кроме галогенидов типичных неметаллов) склонны к комплексообразованию. Галогенсодержащие ацидокомплексы характерны не только для переходных металлов, но и для ряда s- и p-элементов, которым комплексообразование не очень свойственно. Типичное координационное число равно 4: K2[HgI4], H[AuCl4]. Для фторидов помимо к.ч. 4 есть к.ч. 6: MeI2[BeF4], MeI3[AlF6], MeI2[SiF6].
Рассматривая галогениды, образуемые элементами одной подгруппы, можно сделать некоторые выводы относительно химических свойств этих элементов. В частности, в таблице 3 приведены галогениды, образуемые элементами подгруппы хрома. Здесь можно отметить некоторые закономерности. Так фтор как наиболее сильный окислитель способен образовывать высшие гексафториды, из которых CrF6 – твёрдое вещество, MoF6 – легкокипящая жидкость, а WF6 – газ, что свидетельствует об увеличении тенденции к образованию молекулярных структур и связано с ослаблением металлических свойств в ряду Cr – Mo – W. Наибольшее число фторидов образует хром, для которого реализуются все степени окисления от +2 до +6. У молибдена и вольфрама число известных фторидов значительно меньше, т.к. для них характерных высшие степени окисления.
В ряду хлоридов наиболее ярко видна стабилизация высших степеней окисления от хрома к вольфраму. Низшие хлориды хрома – типичные солеобразные соединения, а низшие хлориды молибдена и вольфрама уже не являются солеобразными соединения, а явялются так называемыми кластерами – многоядерными комплексами с непосредственной связью между атомами комплексообразователя.
Таблица 3. Галогениды элементов подгруппы хрома
|
F |
Cl |
Br |
I |
|
|
|
|
|
|
CrF6 - субл. |
— |
— |
— |
Cr |
CrF5 |
— |
— |
— |
CrF4 - пл. 200°С |
CrCl4 - газ |
— |
— |
|
|
CrF3 - субл. 1200°С |
CrCl3 - пл. 1150°С |
CrBr3 |
CrI3 |
|
CrF2 - пл 1100°С |
CrCl2 - пл. 824°С |
CrBr2 |
CrI2 |
|
MoF6 - кип. 35°С |
— |
— |
— |
Mo |
(MoF5)4 - пл. 67°С |
MoCl5 - пл. 194°С |
— |
— |
MoF4 |
MoCl4 - субл. |
MoBr4 |
MoI4 |
|
|
MoF3 |
MoCl3 |
MoBr3 |
MoI3 |
|
— |
MoCl2 – кластер |
MoBr2 - кластер |
MoI2 |
|
WF6 - кип. 17°С |
WCl6 - пл. 295°С |
WBr6 |
— |
W |
(MeF • WF5) |
WCl5 - пл. 243°С |
WBr5 - пл. 276°С |
— |
WF4 |
WCl4 |
(WBrCl3) |
WI4 |
|
|
— |
(3KCl • 2WCl3) |
— |
WI3 |
|
— |
WCl2 - кластер |
WBr2 - кластер |
WI2 |
32
Халькогениды
Халькогениды – это соединения серы, селена и теллура с менее электроотрицательными компонентами. Химическая связь в халькогенидах должна быть менее полярной, чем в оксидах и галогенидах. Сера достаточно часто выступает как конкурент кислорода, что видно в соединениях: например, кислоты HmЭОn и тиокислоты HmЭSn, спирты R-OH и тиоспирты R-SH, а также бинарные соединения CO2 и CS2. Для более тяжёлых аналогов эта тенденция менее характерна. Также отличает халькогены от кислорода склонность к образованию гомоатомных цепей. Устойчивость таких связей и разнообразие полисоединений в ряду S – Se – Te уменьшается.
По характеру химической связи халькогениды как и оксиды подразделяются на ионные, ковалентные и металлические. Преимущественно ионный характер носят соединения с активными металлами, подчиняющиеся правилу формальной валентности. Наименее электроотрицательные элементы IA и IIA групп склонны к образованию полихалькогенидов, например, Na2Sn Na2Sen. Халькогениды р-элементов имеют более разнообразный состав. В большинстве случаев в этих соединениях наблюдается преимущественно ковалентное взаимодействие. Для халькогенидов лёгких р-элементов, а также неметаллов VA-группы характерны ковалентномолекулярные структуры. B2S3, B2Se3 – легкоплавкие твёрдые вещества, CS2 и CSe2 – летучие жидкости. Молекулярные кристаллы образуют и галогениды фосфора: P4S3, P4S7, P4S10 (в паре P2S5), P4Se3. Псевдомолекулярным строением обладают халькогениды мышьяка, сурьмы и висмута. При этом существуют соединения, подчиняющиеся правилу формальной валентности (As2X3, As2S5, Sb2S3) и катионоизбыточные фазы (AsS, BiSe, BiTe).
Для переходных металлов характерно большое разнообразие халькогенидов самого различного состава, но можно выделить ряд общих закономерностей.
1.В большинстве случает разнообразие соединений уменьшается от сульфидов к теллуридам. Например, для молибдена известно 5 сульфидов, 4 селенида и 3 теллурида;
2.Для большинства переходных металлов халькогениды имеют формулу MeX и MeX2;
3.Наименьшее число халькогенидов характерно для переходных металлов с относительно устойчивыми d5 и d10-конфигурациями. Осмий, вольфрам, марганец, рений имеют не более двух халькогенидов, серебро и золото – один - два. Цинк, кадмий, ртуть – по одному.
4.По мере увеличения содержания халькогена в формульной единице соединения закономерно меняется характер химической связи от метал- ло-ковалентной к ковалентной вплоть до образования слоистых псевдомолекулярных структур.
33
Пниктогениды
Элементы VA группы по электроотрицательности уступают халькогенидам. Так, наиболее тяжелый висмут приближается по свойствам к переходным металлам. Однако азот принадлежит к числу наиболее электроотрицательных элементов. Из-за особенностей азота и его малого атомного радиуса нитриды отличаются от остальных пниктогенидов. С s- и р- элементами азот образует соединения, подчиняющиеся правилу формальной валентности. Нитриды активных металлов имеют солеобразный характер, но обладают повышенной склонностью к гидролизу. Нитриды элементов IIIA и особенно IVA группы являются преимущественно ковалент-
ными соединениями (AlN, GaN, Ge3N4, Ge3N2, Si3N4).
Особенностью взаимодействия с азотом переходных металлов является склонность к образованию металлидных фаз внедрения с типичным составом АВ (ScN, TiN, VN, CrN). Это всё односторонние фазы переменного состава с широкими областями гомогенности.
Пниктогениды кремния и германия известны только для фосфора и мышьяка, состав АВ и АВ2. SiP, SiP2, GeAs, GeAs2 и т.п. Хотя, согласно правилу 8-N, первые из них являются катионоизбыточными, а вторые – анионоизбыточными, все они обладают неметаллическими свойствами.
Все переходные металлы с пниктогенами образуют большое число соединений разнообразного состава. Ширина области гомогенности по мере нарастания ковалентной доли связи при переходе от низших пниктогенидов к высшим уменьшается. В этом направлении ослабляется металлический и усиливается неметаллический характер фаз. Все пниктогениды устойчивы к воде и неокисляющим минеральным кислотам. Поскольку они содержат летучий компонент, высшие пниктогениды при нагревании термически диссоциируют, впоследствии переходя в фазы, более бедные пниктогеном. Термическая устойчивость сильно повышается в направлении от фосфидов к арсенидам, антимонидам и висмутидам в соответствии с уменьшением летучести анионообразователя.
Пниктогениды IIB группы, у которых d-уровни полностью завершены, с азотом не реагируют, с остальными пниктогенами образуют нор- мально-валентные соединения Ме3П2, которые являются полупроводниками.
Карбиды, силициды, бориды
Углерод и кремний расположены справа от границы Цинтля, а бор – единственный неметалл, расположенный от той же границы слева. Его неметаллические свойства обусловлены кайносимметричностью 2рорбитали, однако дефицит валентных электронов приводит к необходимости коллективного электронно-атомного взаимодействия с делокализацией электронов. Во многих боридах реализуется такой же структурный мотив, как и в кристалле бора – икосаэдр. В силу дефицита валентных электронов
34
у бора среди боридов принципиально невозможны соединения, подчиняющиеся правилу формальной валентности. По этому признаку бориды близки к интерметаллическим соединениям. Из металлов IA группы с бором реагирует только литий (с образованием LiB6), щелочные металлы с ним не взаимодействуют. Щелочно-земельные образуют с бором по одному соединению MeB6. Но уже для магния и бериллия известно по три бо-
рида: MgB2, MgB6, MgB12, BeB, BeB2, BeB6. Из р-элементов бориды обра-
зует только алюминий.
Из переходных металлов с бором не взаимодействуют элементы IB и IIB групп. Остальные d-элементы образуют бориды двух видов: фазы внедрения (MeB1-x) и полибориды MeBn, где n = 66 – 70. Все бориды тугоплавки, особенно бориды переходных металлов. Бориды переходных металлов стойки по отношению к неокисляющим минеральным кислотам и кислороду воздуха даже при высоких температурах.
Среди карбидов лишь карбид кремния SiC является единственной фазой, в которой соблюдаются обычные валентные соотношения. SiC – типично ковалентное соединение, в котором атомы кремния и атомы углерода находятся в состоянии sp3-гибридизации. Карбид кремния кристаллизуется в структурном типе сфалерита, обладает высокой твёрдостью.
Правилу формальной валентности подчиняются Al4C3 и Be2C, которые можно рассматривать как производные метана. Ацетилениды Me2IC2 образуют литий, натрий и, возможно, другие щелочные металлы. Все карбиды активных металлов разлагаются водой:
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
CaC2 + 2H2O = Ca(OH)2 + C2H2
Для щелочных металлов ещё и характерны аддукты с графитом: NaC8, NaC16, NaC24 и т.д. Натрий образует такие соединения с трудом, а литий не образует вовсе. Их иногда называют графитидами, они активно взаимодействуют с водой, как и сами щелочные металлы. Механизм образования – регулярное заполнение пустот в графитовой сетке атомами металла.
Карбиды переходных металлов, например TiC, HfC, являются фазами внедрения типа АВ1-х. Фазы внедрения – наиболее типичные соединения переходных металлов с углеродом.
Кремний заметно уступает углероду по электроотрицательности, поэтому солеобразные силициды с преимущественно ионным типом связи не существуют. Правилу формальной валентности подчиняются лишь некоторые силициды (Li4Si, Mg2Si), но даже в таких системах существуют соединения, в которых это правило не соблюдается: Li2Si, LiSi2, NaSi2, CaSi, CaSi2, BaSi3. Металлы IIIA и IVA групп с кремнием соединений не образуют. Не взаимодействуют с кремнием химически и металлы, завершающие вставные декады. Напротив, d-металлы с дефектной d-оболочкой образует большое количество силицидных фаз в основном общих формул:
35
Э3Si, Э2Si, ЭSi и ЭSi2. Доминирующий тип связи – метало-ковалентный. Низшие силициды переходных металлов являются металлидами.
Силициды s-элементов, в том числе и полисилициды, разлагаются водой и разбавленными неокисляющими кислотами с выделением силанов (SiH4 и его аналогов):
Mg2Si + 4HCl = 2MgCl2 + SiH4
Силициды переходных металлов тугоплавки, устойчивы к окислению на воздухе даже при высоких температурах и не взаимодействуют с неокисляющими кислотами.
ГЛАВА 4. СЛОЖНЫЕ СОЕДИНЕНИЯ
Это многокомпонентные соединения с числом компонентов три и более. Их можно рассматривать как продукт взаимодействия бинарных соединений.
Традиционно сложные соединения делятся на основания, кислоты и соли (в т.ч. и комплексные кислоты, основания и соли). Однако имеются исключения из этой классификации: карбонилы металлов, многие хелаты и внутрикомплексные соединения, соединения типа CdSnAs2, ZnGeP2, CuFeS2 и другие. Универсальным признаком для единой классификации является доминирующий тип химической связи. В соответствии с этим признаком существует три типа сложных соединений:
1.Доминирует ионное взаимодействие, по крайней мере между отдельными фрагментами. Сюда относятся сложные соли, кислоты и основания. Отличительная особенность – гетеродесмичный характер структур. Внутри фрагментов преимущественно ковалентные взаимодействия, меж-
ду ними — преимущественное ионное. Примерами могут служить: K2SO4 – ромбическая структура, в узлах тетраэдры SO4 и атомы K. Между фрагментами – преимущественно ионная связь, внутри – ковалентная (связь S- O). K2[PtCl6] - здесь октаэдры PtCl6 (ковалентная связь) занимают позиции
вГЦК ячейке, а атомы K связаны с ними ионной связью и располагаются в тетраэдрических пустотах.
2.Вещества, в которых наблюдаются только ковалентные взаимодействия. Они не обладают ни кислотным, ни основным, ни солеобразным
характером. Примером может служить халькопирит CuFeS2, его структура типична для ковалентных соединений - тетраэдрические гибридные кова-
лентные sp3-связи, к.ч. = 4. CdSnP2, ZnGeAs2 – тройные алмазоподобные полупроводники, изоэлектронные аналоги AIIIBV, это трехмерные кова-
лентные структуры, с координационным числом, равным 4.
Кроме гомодесмичных тетраэдрических структур могут реализовываться слоистые, островковые, цепные, молекулярные структуры. Карбонилы переходных металлов, внутрикомплексные соединения и хелаты, между фрагментами имеются ван-дер-ваальсовы взаимодействия.
36
3. Интерметаллические многокомпонентные фазы с доминирующим металлическим типом связи – здесь реализуются плотноупакованные структуры с широкими областями гомогенности.
4.1. Генетическая связь сложных соединений с более простыми
Сложные соединения можно связать с более простыми бинарными и рассматривать как продукт взаимодействия бинарных соединений друг с другом. Ниже приведены основные примеры такого подхода:
H2SO4 – SO3 + H2O
Ca(OH)2 – CaO + H2O
Al(OH)3 – Al2O3 + 3H2O
Cu(OH)2 – CuO + H2O
Na2SiO3 – Na2O + SiO2
Формально аналогичном образом можно описать и такие соединения как CuFeS2 – CuS + FeS; CdSnP2 – Cd3P2 + Sn3P4. Этот справедливо и для комплексных соединений
4KCN + Fe(CN)2 = K4[Fe(CN)6]
4NaF + AlF3 = Na3[AlF6]
Часто формулы сложных минералов записываются в виде комбинации соответствующих соединений: асбест Mg3H4Si2O9 – 3Mg·2SiO2·2H2O,
каолин H4Al2Si2O9 – Al2O3·2SiO2·2H2O.
Чем резче бинарные соединения отличаются друг от друга по свойствам, тем более вероятно возникновение сильно полярного взаимодействия между структурными фрагментами сложного соединения (основания, кислоты, соли). Если бинарные соединения различаются по характеру несильно, то преимущественно ионное взаимодействие не реализуется.
В сложных соединениях проявляется неравноценность функций бинарных соединений, составляющих сложное соединение. Так, например, минерал ортоклаз имеет состав K2Al2Si6O16 или K2O·Al2O3·6SiO2; оксид алюминия амфотерен, диоксид кремния имеет слабокислый характер, они образуют ковалентный алюмосиликатный каркас, а калий, входящий в состав сильно основного К2О, связан с этим каркасом преимущественно ионной связью.
4.2. Гидроксиды как характеристические соединения
Гидроксиды рассматриваются как продукты взаимодействия оксидов с водой, независимо от того, может ли это взаимодействие происходить в действительности или гидроксид может быть получен только косвенным путем.
Вода является идеальным амфолитом:
H2O + H2O = H3O+ + OH–
37
Свойства гидроксида определяют принадлежность элемента к металлам (основания) или неметаллам (кислоты). Этими характеристическими свойствами гидроксиды обладают только в водных растворах.
N2O5 + H2O → HNO3 R H+ + NO3–
Здесь азотная кислота – сильная кислота, это характеризует азот как типичный неметалл, а N2O5 – как кислотный оксид. В других растворителях кислотно-основные свойства могут резко измениться, например:
HNO3 + HF R H2NO3+ + F–
Т.е. в сжиженном фтороводороде HNO3 ведёт себя как типичное основание, присоединяя протон. Характер диссоциации гидроксидов (по кислотному или основному типу), а также степень диссоциации зависят от природы растворителя, его донорно-акцепторной активности по отношению к протону. В ряду HF — H2O — NH3 увеличивается сродство к протону, поэтому слабые в водных растворах кислоты становятся сильными в средах жидкого NH3 и основаниями в среде жидкого HF. Поэтому сравнивать свойства можно лишь по отношению к определённому растворителю.
4.3. Кислотно-основные свойства и амфотерность гидроксидов
Общая формула гидроксидов Э(ОН)n, где n равняется степени окисления элемента. Максимальное значение числа n может быть равно 8, однако координационные сферы с большим числом гидроксогрупп неустойчивы. Поэтому могут отщепляться одна или несколько молекул воды, при этом часть монодентатных лигандов –ОН замещается на бидентатные лиганды =О. Чем выше степень окисления элемента, а, следовательно, меньше размер ион-атома, тем большее число молекул воды отщепляется для обеспечения устойчивости координационной сферы. На рисунке 24 рассмотрены основные случаи для элементов II, III и IV периодов:
38

Рис. 24. Устойчивые формы гидроксидов с кислотными свойствами
Таким образом, наиболее распространёнными гидратными формами р-элементов являются те, формулы которых можно получить вычитанием из предельной формулы Э(ОН)n чётного числа молекул воды для элементов чётных групп и нечётного – для элементов нечётных групп. Исключение составляют бор, углерод и азот с кайносимметричными 2рорбиталями.
Кислотные гидроксиды переходных металлов в высших степенях окисления подчиняются той же закономерности: с увеличением номера группы число отщепляемых молекул воды возрастает.
Рис. 25. Кислотные гидроксиды переходных металлов в высших степенях окисления
39
Общую формулу гидроксидов правильнее представлять не Э(ОН)n, а в виде ЭОm(ОН)n, где m = 0 … 4, а n = 0 … 6 в реально существующих гидроксидах.
m = 0, общая формула Э(OH)n – гидроксиды могут обладать как основными, так и кислотными свойствами, причём с увеличением числа гидроксогрупп в формульной единице (т.е. с увеличением степени окисления Э) ослабевают основные свойства и нарастают кислотные. Это объясняется ростом поляризующего действия катионообразователя в пределах каждого периода в связи с уменьшением его радиуса и увеличением степени окисления, например: NaOH, Mg(OH)2, Al(OH)3, Si(OH)4. При переходе сверху вниз в пределах каждой группы основный характер усиливается, что связано с ослаблением поляризующего действия катионообразователя за счёт увеличения его радиуса.
Гидроксиды ЭОm(OH)n с m≠0 обладают исключительно кислотными свойствами. Это объясняется тем, что атомы кислорода, ковалентно связанные с элементом, способствуют поляризации связи О–Н, в силу чего и облегчается диссоциация по кислотному типу. С возрастанием числа m сила кислот должна возрастать. От величины n сила кислоты практически не зависит, поскольку для многоосновных кислот концентрация ионов Н+ в растворе в основном определяется первой константой диссоциации. Ки-
слоты типа Э(OH)n с m=0 - очень слабые кислоты (H3PO3, HOCl, H6TeO6),
Kдис. = 10–8-10–10. Кислоты типа ЭO(OH)n (m = 1) – слабые кислоты: HClO2, HNO2, H2CO3, Kдис. = 10–2—10–4. Кислоты типа ЭO2(OH)2 (m = 2) – сильные
кислоты: HNO3 с Kдис. = 4·101, H2SO4 с Kдис. = 1·103. Кислоты типа
ЭO3(OH)n (m = 3) – очень сильные кислоты: HClO4 с Kдис. = 1·1010.
Этот подход позволяет объяснить и изменение кислотно-основного характера гидроксидов в зависимости от степени окисления элементов. Азотистая кислота HNO2 или NO(OH) слабее азотной HNO3 или NO2(OH), сернистая H2SO3 или SO(OH)2 слабее серной H2SO4 или SO2(OH)2. В ряду
Mn(OH)2, Mn(OH)3, Mn(OH)4, (HO)3MnO или H3MnO4, (HO)2MnO2 или
H2MnO4, (HO)MnO3 или HMnO4 для гидроксидов Mn(OH)n с увеличением n ослабевает основный характер, а для MnOm(OH)n с возрастанием m усиливаются кислотные свойства. При этом Mn(OH)3 и Mn(OH)4 проявляют амфотерность. Хотя оба гидроксила принадлежат к очень слабым электролитам, у первого ярче выражены основные свойства, а у второго – кислотные.
4.4. Проявление кислотно-основных свойств гидроксидов при химическом взаимодействии
Кислотно-основные свойства гидроксидов, как и других соединений, могут быть выявлены лишь при химическом взаимодействии. Эти свойства являются проявлением единого процесса кислотно-основного взаимодей-
40
