
Периодический закон. 1 и 2 группы
.pdf
Cуществует AuF3, может быть синтезирован из простых веществ. Также могут быть синтезированы хлорид и бромид Au(III):
Au2Cl6 + 4(C2H5)MgCl = 2Au(C2H5)2Cl + 4MgCl2
Это – удобный исходный реагент синтеза различных соединений зо-
лота.
Cуществует фторид AuF5:
Au + O2 + 3F2 →400 o C, P O2+[AuF6]-
O2+[AuF6]- →180 o C, âàê óóì AuF5 + O2 + ½F2
Фторид AuF5 – сильнейший окислитель, проявляет кислотные свой-
ства:
AuF5 + XeF2 → XeF4 + AuF3
AuF5 + H2O = 2HF + ½O2 + AuF2
NaF + AuF5 = Na[AuF6]
Сульфиды
Основные свойства некоторых сульфидов приведены в таблице 7.
Таблица 7. Свойства сульфидов элементов IB-группы
Соеди- |
|
Температура |
- |
Метод синтеза |
|
Окраска |
плавления, |
||||
нение |
lg(ПР) |
||||
|
оС |
|
|||
Cu2S |
Чёрная*1 |
1130 |
47,6 |
2H[CuCl2] + H2S = Cu2S + 4HCl |
|
|
|
|
|
700 o C |
|
|
|
|
|
2CuS + H2 → Cu2S + H2S |
|
Ag2S |
Чёрная |
827 |
49,7 |
2AgNO3 + H2S = Ag2S↓ + 2HNO3 |
|
|
|
|
|
2Ag + S = Ag2S |
|
Au2S |
Чёрно-ко- |
240*2 |
68,4 |
2K[Au(CN)2] + H2S = Au2S↓ + 2KCN + |
|
|
ричневая |
|
|
2HCN |
|
CuS |
Чёрная |
220*2 |
35,2 |
CuSO4 + H2S = CuS↓*3 + H2SO4 |
|
Au2S3 |
» |
*2 |
Водой |
(C2 H5 )2 O |
|
200 |
Au2Cl6 + 3H2S → Au2S3↓ + 6HCl |
||||
|
|
|
разла- |
|
|
|
|
|
гается |
|
*1 Крупные кристаллы имеют тёмно-синюю окраску *2 С разложением
*3 Осадок содержит небольшую примесь Cu2S; часто образуется коллоидный растовр, его разрушают, добавляя 2 М HCl
Для элементов IB группы характерна высокая устойчивость соединений, содержащих серу. Наиболее обширна химия соединений элементов в степени окисления +1. Устойчивость сульфидов типа MeS возрастает вниз по группе. Структура – производная от антифлюорита.
Получение:
2[Ag(NH3)2]+ + 3H2S = Ag2S↓ + 4NH4+ + 2HS-
61
Для сульфидов характерно крайне низкое значении ПР. Ag2S + 4KCN → 2K[Ag(CN)2] + K2S
3Ag2S + 8HNO3 (30%) = 6AgNO3 + 2NO↑ + 3S↓ + 4H2O
Образуют тиосоли с сульфидом и полисульфидом аммония. Известен CuS, он не реагирует с разбавленной H2SO4 и раствором NaOH, но растворяется в HNO3, растворах KCN и (NH4)2S. При нагревании сульфида меди CuS c серой до 350°С под давлением может быть получен CuS2 (строение аналогично пириту). Известен также сульфид золота (III), он является сильным окислителем. В водном растворе цианидов:
Au2S3 + 4KCN = 2K[Au(CN)2] + K2S3
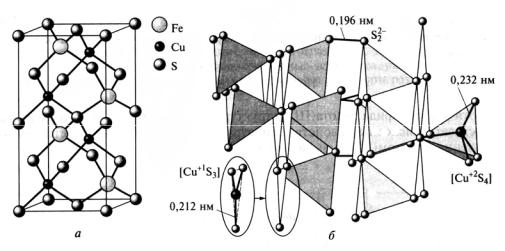
Рис. 32. Сульфиды меди:
а – халькопирит CuFeS2 (Cu+1Fe+3S2); б – ковеллин СuS (Cu2+1Cu+2S-2(S)2-1)
II ГРУППАПЕРИОДИЧЕСКОЙСИСТЕМЫ
ГЛАВА 7. IIA-ГРУППА
7.1. Общая характеристика
62
Свойства элементов IIA-группы
Основные характеристики элементов представлены в таблице 8.
Таблица 8. Основные характеристики элементов IIA-группы
Свойство |
Be |
Mg |
Ca |
Sr |
Ba |
Ra |
Заряд ядра Z |
4 |
12 |
20 |
38 |
56 |
88 |
Электронная конфигурация |
[He]2s2 |
[Ne]3s2 |
[Ar]4s2 |
[Kr]5s2 |
[Xe]6s2 |
[Rn]7s2 |
в основном состоянии |
|
|
|
|
|
|
Металлический радиус rмет*, нм |
0,112 |
0,160 |
0,197 |
0,215 |
0,217 |
0,223 |
Ионный радиус rион**, нм |
0,027 |
0,72 |
0,100 |
0,126 |
0,142 |
0,148 |
Энергия ионизации, кДж/моль: |
|
|
|
|
|
|
I1 |
899,5 |
737,7 |
589,8 |
549,5 |
502,8 |
509,3 |
I2 |
1757 |
1451 |
1145 |
1064 |
965 |
979 |
I3 |
14850 |
7733 |
4912 |
4138 |
3619 |
3300 |
Электроотрицательность: |
1,57 |
1,31 |
1,00 |
0,95 |
0,89 |
0,90 |
по Полингу |
||||||
по Оллреду - Рохову |
1,47 |
1,23 |
1,04 |
0,99 |
0,97 |
0,97 |
|
|
|
|
|
|
|
________________
*Для КЧ 12
**Для Ве2+ КЧ 4, для других М2+ КЧ 6
Особенности
•От элементов IA-группы элементы IIA-группы отличаются более высокими значениями энергии ионизации, убывающими в ряду: Be – Mg – Ca – Sr – Ba. Тенденция нарушается при переходе от Ba к Ra – резкое по-
вышение I1 и I2 для Ra по сравнению с Ba (эффект инертной 6sэлектронной пары);
•У элементов IIA-группы – единственная положительная степень окисления и невозможность восстановления ионов Me2+ в водной среде – сходство с остальными металлами s-блока.
Нахождение в природе
Наиболее распространены Mg (1,4 масс. %) и Ca (1,5 масс. %). Содержание Sr и Ba составляет 3,8·10-2 масс.% и 5·10-2 масс.% соответственно.
7.2. Химия бериллия
Минералы
Важнейшим природным соединением бериллия является минерал берилл Be3Al2Si6O18
или 3BeO·Al2O3·6SiO2.
Хризоберилл BeAl2O4 или BeO·Al2O3
63
Получение
Соединения концентрируют и переводят в BeF2 или BeCl2, затем – магнийтермия или электролиз расплава BeCl2 + NaCl (эвтектика, понижение tпл). Особочистый бериллий получают
зонной плавкой.
Физические свойства
Бериллий – серебристо-белого цвета, отличается твёрдостью и хрупкостью. Ве – диамагнетик. Электродный потенциал Be = –1,7 В, у Al = – 1,67 В (диагональная аналогия). Покрывается слоем пассивирующего оксида (диагональная аналогия)
Особенности химии бериллия
•Be по свойствам значительно отличается от других элементов IIAгруппы
•Ион Be2+ благодаря чрезвычайно малому ионному радиусу (0,027 нм), высокой плотности заряда, большим значениям энергии атомизации и ионизации оказывается устойчивым лишь в газовой фазе при высоких температурах. Поэтому химическая связь в бинарных соединениях даже с
наиболее электроотрицательными элементами (BeO, BeF2) обладает высокой долей ковалентности.
•Специфика водных растворов бериллия – в 1-ой координационной
сфере бериллия могут находиться лишь 4 лиганда – [Be(H2O)4]2+; [Be(OH)4]2-, что связано с малым ионным радиусом металла и отсутствием d-орбиталей.
Химические свойства
Be не подвержен действию водяного пара даже при высокой температуре, реагирует с кислотами и щелочами:
Be + 2HCl = BeCl2 + H2↑
Be + 4HF = H2[BeF4] + H2↑
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2↑ (подобно Al)
Be амфотерный элемент, расположен вблизи диагональной границы Be горит в O2, реагирует с галогенами, халькогенами, N, P, C.
Характеристические соединения
BeO (Be + O2). Чистый BeO получают разложением Be(OH)2, BeCO3, Be(NO3)2:
o
Be(NO3)2 t, C→ BeO + 2NO + ½O2↑
BeO – структура вюрцита (изоэлектронный ряд C). Преимущественно ковалентный характер связи. ОЭО (Be) = 1.5 (как у Al).
BeO – амфотерен:
64

o
2NaOH + BeO →t, C Na2BeO2 + H2O
Be(OH)2 - получают из растворов солей действием щелочи.
2+ |
→ |
0 |
→ |
2- |
[Be(H2O)4] |
2H+ |
[Be(OH)2(H2O)2] |
2OH− |
[Be(OH)4] |
←− |
←+ |
|||
|
2OH |
|
2H |
|
o
(NH4)2[BeF4] →t, C 2NH4F + BeF2 (структура SiO2!)
o
BeO + C + Cl2 →t, C BeCl2 + CO
BeCl2 представляет собой неорганический полимер с мостиковыми связями, атом бериллия подвергается sp3-гибридизации, к.ч. = 4.
Рис. 34. Строение хлорида бериллия: а – в газовой фазе; б – в твёрдом состоянии; в – образование связей в полимерном BeCl2; г – молекулярная модификация, образующаяся из пара при T < 405 oC
У алюминия существует димер Al2Cl6 (в паре), т.к. только 1 вакантная p-орбиталь. (BeH2)n – полимерный гидрид, получают косвенным путем, непосредственно с H2 бериллий не соединяется!
BeCl2 + 2LiH → BeH2 + 2LiCl
2Be(CH3)2 + Li[AlH4] → 2BeH2 + Li[Al(CH3)4]
o
Be + S →t, C BeS
K2S + BeS → K2BeS2
BeS здесь как бы выполняет функцию «кислотного оксида», при этом образуется тиосоль (тиобериллат калия). Аналогично:
CaO + CO2 = CaCO3 CaO + CS2 = CaCS3
Сазотом Be, в отличие от Li и Mg, взаимодействует только при очень высоких температурах, образует Be3N2.
Суглеродом – Be2C (метанид) и BeC2 (ацетиленид):
Be2С + 4H2O → 2Be(OH)2 + CH4↑
BeС2 + 2H2O → Be(OH)2 + C2H2↑
Be не реагирует с Si и Ge, в отличие от Mg и щелочноземельных
металлов.
Соли и комплексные соединения
Be(NO3)2·4H2O или [Be(H2O)4](NO3)2; BeSO4·4H2O; BeCO3·4H2O
65

Двойные соли: MeI2SO4·BeSO4·2H2O
Be – практически единственный комплексообразователь из s-
элементов. [Be(OH)4]2-; [BeF4]2-
BeF2 – «кислотный» характер в Льюисовом смысле. С другими галогенидами не образует комплексов из-за размерного фактора.
Бериллий образует комплексы с к.ч. равным 4, например
[Be(NH3)4]2+, [Be(CN)4]2- и [Be(CNS)4]2-.
Be(OH)2 + CO2 + 3H2O = [Be(H2O)4]CO3
Be + 4NH4F + 2H2O = (NH4)2[BeF4] + 2NH3·H2O + H2↑
Рис. 35. Строение ионов: а – [Be(H2O)4]2+; б – [Be3(H2O)6(OH)3]3+
7.3. Химия магния
Особенности
-ОЭО (Mg) = 1,2;
-Наличие вакантного 3d-уровня обусловливает более высокие по сравнению с бериллием к.ч. = 4 и 6 (внешняя sp3d2 гибридизация), но как комплексообразователь Mg уступает Be;
-Шпинель MgAl2O4, или MgO·Al2O3 целый класс двойных оксидов-
шпинелей MeIIO·MeIII2O3 (Fe3O4 = FeO·Fe2O3);
-Много кристаллогидратов и двойных солей → некоторая склонность к комплексообразованию;
-K2SO4·MgSO4·6H2O – шенит.
Получение
Электролиз расплава хлорида или карботермическое восстановление обожженных до оксидов карбонатов. E° = –2,4 B;
Химические свойства
Mg взаимодействует с горячей H2O:
o
Mg + 2H2O →t, C Mg(OH)2 + H2↑
66
Растворяется с минеральных кислотах, но не растворяется в HF и в щелочах (MgF2 не растворим в H2O);
Сгорание на воздухе: MgO + Mg3N2 (Be – горит в O2, с N2 – выше
1000 °С);
Более энергично, чем Be, реагирует при нагревании с галогенами, халькогенами и пниктогенами.
Характеристические соединения
MgO – структурный тип NaCl.
Проявляет исключительно основные свойства, в H2O растворим пло-
хо.
Mg(OH)2 получают косвенным путем, плохо растворим в H2O, как и LiOH (диагональная аналогия).
MgHal2 - гигроскопичны (кроме MgF2).
MgF2 – структура рутила, галогениды щелочно-земельных металлов (CaF2) имеют структуру флюорита.
Mg + Hal2 → MgHal2
Растворимые в воде галогениды Mg образуют кристаллогидраты
MgHal2·6H2O, а также MgBr2·10H2O, MgCl2·12H2O и двойные соли: KCl·MgCl2·6H2O – карналлит
Соли магния
Сульфат MgSO4·7H2O – хорошо растворим в воде [Mg(H2O)6]SO4·H2O – сверхкомплексное соединение, к.ч. = 6 Образует двойные соли типа шенитов MeI2SO4·MgSO4·6H2O
Нитрат Mg(NO3)2·6H2O – хорошо растворим, MgCO3 – плохо, при их нагревании можно получить чистый MgO;
Существует основный карбонат Mg: 4MgCO3·Mg(OH)2·4H2O – продукт частичного гидролиза по катиону!
7.4. Щелочно-земельные металлы (Ca, Sr, Ba)
Особенности
•Они не только групповые и типовые, но и слоевые аналоги. ОЭО: 1,0; 0,9; 0,9;
•E° = –2,87; –2,89; –2,91 B;
•Для Сa, Sr, Ba характерно образование ионных связей и высокие координационные числа: 6, 7, 8 для Сa, Sr, Ba соответственно;
•Близость их свойств.
Нахождение в природе и получение
Основные минералы – сульфаты, карбонаты, фосфаты, нитраты, флюорит. Многие соединения являются изоморфными.
67
Ионный радиус от Ca к Ba меняется заметно (возрастает). Основным методом получения является алюмотермия в вакууме, для кальция применяют электролиз расплава хлорида.
Химические свойства
-Эти металлы энергично реагируют с водой, растворяются в минеральных неокисляющих кислотах;
-При обычных условиях реагируют с O2 и Hal, при умеренном нагревании – с халькогенами, пниктогенами, C, Si и т.д.
Характеристические соединения
-При сгорании в кислороде – оксиды ЭО; могут образовываться пероксиды ЭО2:
-Известны надпероксиды ЭIIО4, их устойчивость возрастает от Ca к Ba, сильные окислители;
-ЭО – структурный тип NaCl, они энергично взаимодействуют с
H2O:
CaO + H2O → Ca(OH)2 + 64 кДж
(гашение извести)
-Гидроксиды довольно хорошо растворимы в H2O, обладают свойствами щелочей. Особенно хорошо растворим Ba(OH)2;
Основные свойства возрастают с ростом порядкового номера.
-ЭHal2 растворимы в H2O, кроме фторидов, образуют кристаллогид-
раты CaHal2·6H2O
-Галогениды щелочных металлов вообще не образуют кристаллогидратов (здесь намек на комплексообразование);
-Солеобразные гидриды ЭH2 – прямой синтез при нагревании, халькогениды – структура NaCl, а MgS – вюрцит.
Пниктогениды Э3Hal2. Они разлагаются водой и разбавленными кислотами:
Ca3P2 + 6HCl = 3CaCl2 + 2PH3↑
- С углеродом – ацетилениды ЭС2, в своём составе сожержат ион [C ≡ C]2- (рис. 36). Они гидролизуются с выделением ацетилена.
68
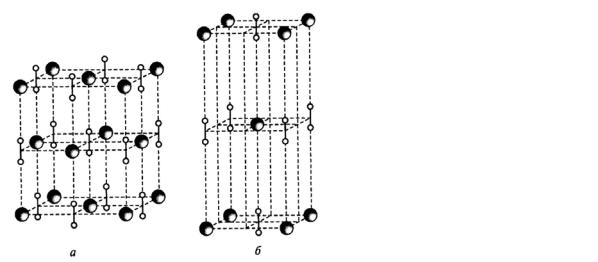
Рис. 36. Кристаллическая структура карбида кальция CaC2 (a) и пероксида бария BaO2 (б)
Соли кислородсодержащих кислот
Сульфаты и карбонаты плохо растворимы в H2O, нитраты – хорошо, но Ba(NO3)2 – плохо! Из водных растворов выделяются кристаллогидраты Ca(NO3)2·4H2O. Гидрокарбонаты, в отличие от средних солей, хорошо растворимы в H2O. Ca(HCO3)2 и Mg(HCO3)2 – обеспечивают временную жесткость воды, которая устраняется кипячением:
|
|
|
t, o C |
|
|
|
Ca(HCO3)2 → CaCO3↓ + CO2 + H2O |
||||||
|
|
|
t, |
o C |
|
|
Mg(HCO3)2 → Mg(OH)2↓ + 2CO2↑ |
||||||
CaSO ·2H |
|
|
100 o C |
|
160 o C |
|
2 |
O → CaSO ·½H O |
→ CaSO |
||||
4 |
|
← |
4 2 |
← |
4 |
|
гипс |
|
|
|
алебастр |
ангидрит |
|
CaSO4 |
←→ xCaSO4·yCaO ←→ |
CaO |
||||
|
|
|
900 o C |
|
1200 o C |
|
ангидрит |
гидравлический гипс |
|
|
|||
Малорастворимый в воде CaSO4 легко переходит в раствор при до-
бавлении (NH4)2SO4 или H2SO4(конц). Это объясняется образованием комплексной кислоты H2[Ca(SO4)2] или ее аммонийной соли.
Комплексные соединения
•Устойчивость комплексов Mg и щелочно-земельных металлов определяется природой лигандов;
•Константы устойчивости комплексов с анионными лигандами небольшого размера уменьшаются от Mg к Ba;
•В случае комплексов с анионами кислородсодержащих кислот константы устойчивости увеличиваются вниз по группе.
69
ГЛАВА 8. IIB-ГРУППА
8.1. Простые вещества
Особенности
•Характеризуются полностью укомплектованными (n-1)d10 слоями.
Поэтому d-электроны здесь в принципе не являются валентными, возможности к взаимодействию обусловлены ns2-электронами. Типичная степень окисления +2;
•Наличие заполненного d-подуровня усиливает ковалентный характер связи при движении вниз по группе. Особенно это характерно для Нg, ее галогениды – типичные ковалентные соединения. При движении вниз по группе возрастают атомные и ионные радиусы, особенно значительно при переходе от Zn к Сd;
•По химическим свойствам Cd ближе к Zn, для него характерна высокая химическая активность;
•Hg – химически инертна, эффект «инертной» 6s2-электронной пары; ион Hg2+ – сильный окислитель. Для нее типично образование линейных биядерных (Hg22+) кластеров, в которых ковалентные связи Hg–Hg формируются при участии sp-гибридных орбиталей атомов ртути;
•Ковалентность связи в соединениях с неметаллами возрастает в ряду Zn2+ < Cd2+ < Hg2+ по мере понижения энергии и увеличения размера валентных d-орбиталей;
•В водных растворах для Zn и Cd характерны к.ч. 4 и 6, для Cd – в основном 6. Для Hg – к.ч. 4, иногда даже 2 и 3.
Нахождение в природе
Характерно высокое сродство к сере, нахождение в природе преимущественно в виде сульфидов. Zn – 7,6 10-3 масс. %, Cd – на 3 порядка ниже, чем Zn, но в 2 раза превышает содержание Hg. Hg – 8,0 10-6 масс.%.
Получение
Обжиг серосодержащих руд:
2ZnS + 3O2 → 2ZnO + 2SO2
затем обработка серной кислотой, цинк выделяют электролизом. Также используется способ карботермии:
ZnO + C → Zn + CO
Так как кадмий – редкий и рассеянный элемент, основной источник его – цинковые руды. Ртуть образует минералы, из них возможно её получение следующим образом:
HgS + O2 → Hg + SO2
4HgS + 4CaO → 4Hg + CaSO4 + CaS
70
