
Периодический закон. 1 и 2 группы
.pdfAg + 2HNO3(конц) = AgNO3 + NO2 ↑ + H2O
4Ag + 2H2S + O2 = 2Ag2S + 2H2O (потемнение серебра) Au + HNO3 + 4HCl = H[AuCl4] + NO↑ + H2O
Золото и серебро не реагируют с водным раствором аммиака. Cu, Ag и Au не взаимодействуют со щелочами.
Взаимодействие с кислородом:
Cu + ½O2 → CuO
2Cu + O2 + H2O + CO2 = Cu2(OH)2CO3
4Cu + 5/2O2 + 3H2O + SO2 = Cu4(OH)6SO4
(при длительном хранении на меди образуется зелёный налёт). Серебро и золото не реагируют с кислородом.
С галогенами для меди характерны ди- и моногалогениды (за исключением не существующего CuF), для серебра – моногалогениды, для золота
– три- и моногалогениды. С фосфором – Cu3P, CuP2, CuP, AgP2, Ag3P11, AuP3, Au2P3. При нагревании: 2Ag + S = Ag2S. С H, N, C – не взаимодействуют. Соответствующие соединения получают косвенным путем:
4CuSO4 + 3H3PO2 + 6H2O = 4CuH↓ + 3H3PO4 + 4H2SO4
CuHх (x = 0,65–0,97) – красно-коричневый осадок, структура вюрци-
та. AuH3 неустойчив (Au2Cl6 + LiH при –120°C)
CuF2 + NH3 → Cu3N + HF
тёмно-зелёный
2Cu3N + 8HCl = 3CuCl2 + 3Cu + 3NH4Cl
Нитрид серебра Ag3N (гремучее серебро) - черный осадок, получающийся при взаимодействии концентрированного аммиачного раствора хлорида серебра AgCl со щелочью или влажного Ag2O с крепким раство-
ром NH3. Соли серебра следует с большой осторожностью вводить в ре-
акции с аммиаком и щелочами! Карбиды Me2C2 (ацетилениды) также взрывоопасны. С металлами Cu, Ag и Au образуют интерметаллилды (CuZn, Cu5Sn, Cu3Al).
6.2. Соединения элементов IB-группы
Оксиды
Особенности:
•В одинаковых степенях окисления имеют сходное строение;
•Кислотные свойства усиливаются с повышением степени окисления, однако кислотно-основные реакции часто осложнены окислительновосстановительными превращениями и образованием ацидокомплексов;
•Устойчивость связи Э – О максимальна в случае меди и резко понижается при переходе к Ag и Au.
51
Основные свойства оксидов элементов IB-группы представлены в таблице 4.
|
|
Оксиды элементов IB-группы*1 |
|
Таблица 4. |
|||
|
|
|
|
|
|||
Оксид |
Окраска |
Темпера- |
Кристаллическая струк- |
|
Продукты взаимодействия |
|
|
тура плав- |
тура |
|
с HCl |
с K2O |
|
||
|
|
ления, оС |
|
|
|||
Cu2O |
Красная |
1230 |
Тип антифлюорита |
|
CuCl |
K4Cu4O4 |
|
|
|
|
|
|
H[CuCl2] |
K3CuO2 |
|
Ag2O |
Тёмно- |
300*2 |
То же |
|
AgCl |
K4Ag4O4 |
|
|
коричневая |
|
|
|
|
K3AgO2 |
|
Au2O |
Серо- |
200*2 |
То же |
|
AuCl |
K4Au4O4 |
|
|
фиолетовая |
|
|
|
H[AuCl2] |
|
|
CuO |
Чёрная |
> 800*2 |
Искажённая типа PtS |
|
СuCl2 |
K2CuO2 |
|
|
|
|
(квадраты [CuO4] ) |
|
|
|
|
AgO |
Тёмно-серая |
> 100*2 |
Ag2+1Ag2+3O4 |
|
AgCl + Cl2 |
K4Ag4O4 + O2 |
|
|
|
|
(квадраты [AgO4] ) |
|
|
|
|
Ag3O4 |
Чёрная |
20*2 |
Ag2+3Ag+2O4 |
|
AgCl + Cl2 |
K4Ag4O4 + O2 |
|
|
|
|
(квадраты [AgO4] ) |
|
|
|
|
Cu2O3 |
Красная |
Нет свед. |
Нет свед. |
|
CuCl2 + Cl2 |
KCuO2 |
|
Ag2O3 |
Чёрная |
Нет свед. |
Сетка из квадратов |
|
AgCl + Cl2 |
K4Ag4O4 + O2 |
|
|
|
|
[AgO4] |
|
|
|
|
Au2O3 |
Бурая |
155*2 |
Сетка из квадратов |
|
AuCl3 |
KAuO2 |
|
|
|
|
[AuO4] |
|
H[AuCl4] |
|
|
*1 Известны также субоксиды меди Cu8O, Cu64O и смешанный оксид Cu4O3. *2 C разложением
Оксиды Me2O
Термическая устойчивость понижается вниз по группе, Au2O – эндотермическое соединение. Для оксидов характерны основные свойства:
Cu2O + 2HCl = 2CuCl + H2O
Cu2O + 4HCl(избыток) = 2H[CuCl2] + H2O
Возможен также переход в раствор:
Cu2O + 4NH3 + H2O = 2[Cu(NH3)2]OH Ag2O + 4KJ + H2O = 2K[AgI2] + 2KOH
Устойчивость степени окисления +1 у серебра и +2 у меди: Ag2O + 2HNO3 = 2AgNO3 + H2O
Cu2O + 6HNO3(конц) = 2Cu(NO3)2 + 2NO2↑ + 3H2O
Амфотерный характер оксидов проявляется при их сплавлении с оксидами щелочных металлов.
Способы получения:
52
4CuSO4 + 8NaOH + N2H4 = 2Cu2O↓ + N2↑ + 4Na2SO4 + 6H2O 2H[CuCl2] + 4NaOH = 2Cu2O↓ + 4NaCl + 3H2O
Оксиды Ag2O и Au2O получаются аналогичным образом.
Оксиды MeO
Наиболее устойчив CuO, его получают следующим образом: Cu2(OH)2CO3 →>200 o C 2CuO + CO2↑ + H2O
o
Cu(OH)2 →t C CuO + H2O
Данный оксид проявляет основный характер:
CuO + 2HCl = CuCl2 + H2O
Амфотерность:
o
2NaOH + CuO →ñï ë àâë åí è å, t C Na2CuO2 + H2O CuO + 4NH3 + 3H2O = [Cu(NH3)4(H2O)2](OH)2
тёмно-синий
Проявляет свойства окислителя:
o
CuO + H2 →t C Cu + 2H2O
o
3CuO + 2NH3 →t C 3Cu + N2↑ + 3H2O
Для серебра:
o
2AgNO3 + 4KOH + K2S2O8 →90 C 2AgO + 2K2SO4 + 2KNO3 + 2H2O
чёрный Диамагнетизм AgO свидетельствует об отсутствии ионов серебра
(II), поэтому формулу вещества правильнее записывать в виде Ag+1Ag+3O2 AgO является сильным окислителем (за счёт Ag3+)
4AgO + 4HNO3 = 4AgNO3 + O2↑ + 2H2O
Оксиды CuO и AgO, несмотря на различие в степенях окисления атомов металла и в свойствах, имеют структуры, топологически связанные друг с другом и со структурой оксида палладия (II), рис. 30. Так, поворотом каждого второго квадрата [MO4] на 90o структура CuO преобразуется в структуру AgO.
Другие оксиды
Оксиды Ag2O3 и Ag3O4 получают анодным окислением солей Ag(I). Для меди:
2Cu(OH)2 + K2S2O8 + 2KOH = Cu2O3↓ + 2K2SO4 + 3H2O
гранатовокрасный
53
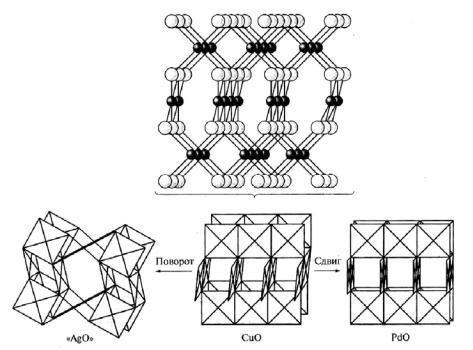
Рис. 30. Топологическая связь между структурами оксидов CuO, AgO, PdO
Оксид Au2O3 имеет коричневую окраску. Его получают путём обезвоживания Au(OH)3 при 100 °С. При более высокой температуре происходит разложение оксида:
Au2O3 → 2Au + 3/2O2
Устойчивость оксидов типа Me2O3 возрастает в ряду Cu – Ag – Au.
Гидроксиды, кислоты, кислородсодержащие соли и комплексы
Степень окисления +1
Гидроксиды ЭОН – неустойчивые, нерастворимые в воде соединения, проявляющие основные свойства. За счёт комплексообразования гидроксиды способны растворятся в концентрированных растворах щелочей и в водных растворах аммиака.
CuOH – жёлтого цвета, является промежуточным продуктом при синтезе Cu2O восстановлением производных меди (II). Можно получить также действием щелочи на раствор комплекса H[CuCl2]:
H[CuCl2] + 2NaOH = CuOH↓ + 2NaCl + H2O
AgOH - довольно сильное основание, проявляет слабый амфотерный характер. Это проявляется в образовании аргентатов (Ag2O + Me2O), которые нацело гидролизуются водой. Комплексы преимущественно линей-
ные [Ag(CN)2]-, [Ag(NH3)2]2SO4, [AgI3]2-, [Ag2I4]2-. Твёрдый AgOH (белого цвета) удаётся получить путём взаимодействия AgNO3 и KOH только при низкой температуре (-50 оС).
AuOH (или Au2O·xH2O) – тёмно-фиолетового цвета образуется при слабом нагревании суспензии AuBr в растворе KOH.
54
Медь (I) из солей кислородсодержащих кислот образует сульфат
Cu2SO4, сульфит Cu2SO3·Н2О и ацетат CuCH3COO.
Сульфат устойчив в атмосфере сухого воздуха. При нагревании или под действием воды диспропорционирует:
Cu2SO4 = Cu↓ + CuSO4
Получение:
o
2Cu + 2H2SO4 конц. →200 C Cu2SO4 + 2H2O↑ + SO2↑
o
Cu2O + (CH3)2SO4 →160 C Cu2SO4 + (CH3)2O↑
Соли серебра (I).
Для Ag степень окисления +1 наиболее устойчива в водных растворах. Большинство солей малорастворимы в воде, исключение – нитрат, ацетат, хлорат, перхлорат и фторид. Ион Ag+ - окислитель, соединения серебра под действием восстановителей чернеют, выделяется серебро в свободном виде. При нагревании многие соединения серебра разлагаются:
AgClO4 → AgCl + 2О2 2AgClO3 → 2AgCl + 3О2
Ag2SO4 → 2Ag + SO2 + O2
2AgNO3 + 2NaOH = Ag2O↓ + 2NaNO3 + H2O
Соли Ag (I) получают растворением металла или оксида серебра (I) в кислотах (азотной, серной, хлорной) или по реакциям обмена:
Ag2O + 2HClO4 = 2AgClO4 + H2O
AgNO3 + NaClO3 = AgClO3↓ + NaNO3
Соли золота (I) с кислородсодержащими кислотами неизвестны. Известны преимущественно анионные комплексы K[Au(CN)2], Na3[S2O3]2,
[AuI2]- + I2 = [AuI4]-
Степень окисления +2
Соединения серебра и золота в степени окисления +2 немногочисленны и легко диспропорционируют.
Соединения меди (II)
Гидроксид меди (II) Cu(OH)2:
Cu(OH)2 + 2HCl = CuCl2 +2H2O
Cu(OH)2 + 2NaOH(конц) = Na2[Cu(OH)4]
ярко-синий
Амфотерные свойства с преобладание основных. Гидроксиды серебра (II) и золота (II) неизвестны.
Соли меди (II) известны для большинства кислородсодержащих кислот. Как правило, выделяются из растворов в виде кристаллогидратов. Соли меди в водных растворах гидролизованы, присутствуют полиядерные катионы [Cun(OH)2n-2(H2O)m]2+. [Cu(H2O)6]2+ – входит в состав многих кристаллогидратов, придает соединениям меди синий цвет.
55
При кипячении растворов:
o
4CuSO4 + 6H2O →t C Cu4(OH)6SO4 + 3H2SO4
зелёный или бирюзовый
Известны оксокупраты: Sr2CuO3, Ba2CuO3. Cu(NO3)2·6H2O (ниже 24,5 °С), выше – устойчив Cu(NO3)2·3H2О. Существует большое число фосфатов Cu(II), силикаты, оксалаты, основные карбонаты, среди которых наиболее известен малахит:
2CuSO4 + 4NaHCO3 = Cu2(OH)2CO3 + 2Na2SO4 + 3CO2↑ + H2O
малахит
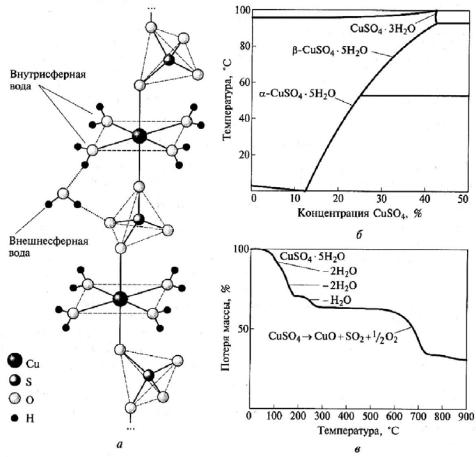
Медный купорос CuSO4·5H2O, [Cu(H2O)4]2+, [Cu(H2O)4]SO4·H2O –
сверхкомплексное соединение.
Рис. 31. Медный купорос: а – строение; б – растворимость сульфата меди (II) в воде; в – кривая термического разложения на воздухе.
Окислительные свойства ионов Cu2+:
Fe + CuSO4 = FeSO4 + Cu
Образование комплексных соединений в щелочной среде: Cu2+ + 4NH3 + 2H2O = [Cu(NH3)4(H2O)2]2+
лазурно-синий
Соединения серебра (II). В водных растворах существует ион [Ag(H2O)4]2+, который получается окислением ионов Ag(I) в хлорной или
56
азотной кислоте озоном. Соли малочисленны. Бесцветный фосфат Ag3(PO4)2 хорошо растворим в воде. Соли серебра Ag(II) – сильные окис-
лители:
4Ag2+ + 2H2O = 4Ag+ + O2 + 4H+
Стабилизация Ag(II) может быть достигнута в комплексных соединениях с азот-донорными лигандами, такими как, пиридин. Описаны также
MeIAgF3, Me2IAgF4.
Для золота (II) известны только некоторые комплексы.
Степень окисления +3
Конфигурация d8 наиболее устойчива для золота. Соединения меди и серебра в этой степени окисления малочисленны и являются сильными окислителями. Известны ортокупраты Li3CuO3, а также гидроксокомплексы:
2Cu(OH)2 + KOCl + H2O = 2K[Cu(OH)4] + KCl
красный
и фторокомплекс:
o
CuCl + 3KCl + 3F2 →t C K3[CuF6] + 2Cl2
светло-зелёный
Стабилизации степени окисления +3 для меди удается достичь в комплексных соединениях с лигандами, создающими октаэдрическое окружение – периодаты [Cu(HIO6)2]5- и ортотеллураты [Cu(H2TeO6)2]5-. Для серебра оксосоединения возможно получить анодным окислением на платиновом электроде:
7AgNO3 + 8H2O →ýë . òî ê Ag7O8NO3 + 5H2 + 6HNO3
оксонитрат
Оксонитраты содержат в своём составе группировку [Ag63+O8]. Они проявляют окислительные свойства:
Ag7O8NO3 + 17HCl = 7AgCl + 5Cl2 + 8H2O + HNO3
При нагревании:
o
Ag7O8NO3 →Í 2Î , t C 6AgO + AgNO3 + O2
Анодным окислением серебра в сильнощелочных средах получают желтые растворы аргентатов, содержащие ионы [Ag(OH)4]-.
Для золота степень окисления +3 наиболее характерна. H[AuCl4] (светло-желтые кристаллы, расплываются на воздухе) – исходное вещество для многих синтезов. В водном растворе:
[AuCl4]- + H2O → [AuCl3(H2O)] + Cl-
[AuCl3(H2O)] + H2O → [AuCl3(OH)]- + H3O+
Добавление щелочи вызывает выпадение желто-коричневого осадка гидроксида Au2O3·xH2O, растворимого в растворах щелочи:
Au(OH)3 + KOH = K[Au(OH)4]
Кислотные свойства Au(OH)3 преобладают над основными, это соединение носит тривиальное название – «золотая кислота».
57

Au(OH)3 + 4HNO3 = H[Au(NO3)4] + 3H2O
Соли кислородсодержащих кислот золота в водных растворах не могут быть получены. Au(III) не образует устойчивых аквакомплексов, но может образовывать многочисленные комплексные фториды, нитраты, сульфаты, ацетаты, роданиды и т.д.
Na[AuCl4] + 4NaCN = Na[Au(CN)4] + 4NaCl H[AuCl4] + 5NH3 →NH4Cl [Au(NH3)4]Cl3 + NH4Cl
Известны соединения золота с координационными числами 5 и 6. Соединения Au+3 – сильные окислители
H[AuCl4] + 3FeSO4 = Au + Fe2(SO4)3 + FeCl3 + HCl
H[AuCl4] + 3KI = AuI↓ + I2 + HCl + 3KCl
Золото растворяется в селеновой кислоте:
2Au + 3H2SeO4 = Au2O(SeO3)2 + H2SeO3 + 2H2O
полимерный
оксоселенит
Галогениды элементов IВ-группы
Основные галогениды элементов IB-групп приведены в таблице 5. В таблице 6 представлены свойства некоторых галогенидов элементов подгруппы меди.
Таблица 5. Галогениды элементов подгруппы меди.
Степень окисления |
Cu |
Ag |
Au |
+1 |
CuCl, CuBr, CuI |
AgF, AgCl, AgBr, AgI |
AuF, AuCl, AuBr, AuI |
+2 |
CuF2, CuCl2, CuBr2 |
AgF2 |
AuF2 |
+3 |
CuF3 (?) |
AgF3 |
AuF3, Au2Cl6, Au2Br6 |
+5 |
- |
- |
AuF5 |
+7 |
- |
- |
AuF7 |
Галогениды (I)
Способы получения:
CuCl2 + Cu →N2 , HCl 2CuCl 2CuSO4 + 4KI = 2CuI↓ + I2 + 2K2SO4 AgNO3 + HX = AgX↓ + HNO3
Моногалогениды имеют структуру типа NaCl. На свету темнеют, так как разлагаются на простые вещества.
In + 2AgCl = InCl2 + 2Ag
Таблица 6. Свойства некоторых галогенидов
Соединение |
Окраска |
Температура |
Кристаллическая |
Раствори- |
|
|
плавления, оС |
структура |
мость в воде* |
СuCl |
Бесцветная |
430 |
Типа сфалерита |
5,92 |
CuBr |
» |
489 |
» |
8,28 |
58

CuI |
» |
600 |
» |
11,96 |
AgF |
» |
435 |
Типа NaCl |
Растворим |
AgCl |
» |
457 |
» |
9,75 |
AgBr |
Бледно-жёлтая |
434 |
» |
12,28 |
AgI |
Жёлтая |
560** |
Типа сфалерита*** |
16,08 |
AuI |
Жёлто-коричневая |
120** |
Полимерные цепи |
22,80 |
CuF2 |
Бесцветная |
770 |
Типа рутила |
Растворим |
CuCl2 |
Тёмно-коричневая |
596 |
Слоистая |
» |
CuBr2 |
Чёрная |
498 |
Слоистая |
» |
AgF2 |
Тёмно-коричневая |
690 |
Цепи из квадратов |
Водой разлагается |
|
Красная |
150** |
[AgF4] |
Растворим |
Au2Cl6 |
Молекулярная |
|||
Au2Br6 |
Красно-коричневая |
200** |
» |
» |
Au2F10 |
» |
75 |
» |
Водой разлагается |
AuF7 |
Жёлтая |
100** |
Нет сведений |
То же |
*Для плохорастовримых галогенидов приведено значение –lg(ПР) при температуре 20 оС
**С разложением
***γ-AgI
Галогениды золота Au(I) разлагаются при нагревании или взаимодействии с H2O, имеют полимерную структуру. Связь Au–X носит преимущественно ковалентный характер:
3AuCl + H2O = 2Au↓ + H[Au(OH)Cl3]
6AuCl = 4Au + Au2Cl6
AgCl – AgBr – AgI
увеличение ковалентности, углубление окраски
Сu – Ag – Au
связь M – X ослабевает, устойчивость соединений уменьшается
Для галогенидов MeX сверху вниз по группе растворимость падает, для иодида серебра AgI растворимость минимальна. В IA группе наблюдается обратная закономерность, ионный характер связи.
Реакции для галогенидов элементов IВ группы в степени окисления
+1:
AgI + 2Na2S2O3 = Na3[Ag(S2O3)2] + NaI
CuCl + HCl = H[CuCl2]
AgI + KI = K[AgI2]
AgI + 2NaCN = Na[Ag(CN)2] + NaI
Галогениды (II)
Наиболее устойчивые соединения в данной степени окисления образует медь. CuF2 – структура рутила; CuCl2 и CuBr2 – слоистые структуры.
Cu + X2 = CuX2
3CuCl2 + 2BBr3 = 3CuBr2 + 2BCl3↑
Хорошо растворимы в воде, спиртах, ацетоне. [CuF2(H2O)2)]; [CuCl2(H2O)2]; [CuBr2(H2O)2]·2H2O. При действии щелочей на галогениды
59
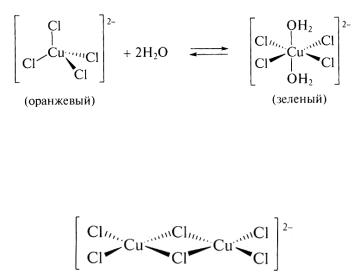
Cu(II) могут быть выделены основные соли: Cu(OH)Cl, Cu2(OH)3Cl, Cu2(OH)3Br
[CuX4]2- с галогенами.
Изменение геометрии иона сказывается на окраске: плоскоквадратные комплексы окрашены в зеленый цвет, тетраэдрические – в оранжевый. В водном растворе существует равновесие:
При добавлении хлорида щелочного металла в водный раствор хлорида меди (II) могут быть выделены красные комплексы состава Me[CuCl3], в которых плоские анионы состоят из двух квадратов [CuCl4] с общей стороной:
красный
Галогениды серебра (II)
o
2AgF + ClF3 →t C 2AgF2 + ClF
Дифторид серебра – сильный окислитель, разлагается водой:
6AgF2 + 3H2O = 6AgF + 6HF + O3↑
Продукты взаимодействия с фторидами щелочных металлов – фто-
роаргентаты (II): K[AgF3], K2[AgF4].
Для золота (II) существует хлорид AuCl2.
Галогениды (III)
Из тригалогенидов меди и серебра известны только трифториды: медь (III) и серебро (III) – слишком сильные окислители, чтобы сосуществовать с ионами хлора, брома, йода. Даже фториды очень неустойчивы. Пример: трифторид серебра AgF3 – диамагнитное соединение, уже при слабом нагревании переходит в дифторид:
o
2AgF3 →200 C 2AgF2 + F2↑
Тригалогениды золота AuX3 – кристаллические вещества, хорошо растворимые в воде (за исключением йодида). При нагревании они распадаются, причём их температура разложения понижается к трийодиду, который неустойчив уже при комнатной температуре:
o
AuХ3 →t C AuX + X2↑
60
