
Периодический закон. 1 и 2 группы
.pdf
ствия. Кислотный характер очевиден при взаимодействии с соединениями, обладающими основной функцией, и наоборот. Поэтому амфотерность – универсальное свойство гидроксидов. Например, гидроксиды меди (II) и марганца (II) проявляют преимущественно основный характер, но в жёстких условиях могут проявлять кислотную функцию:
Cu(OH)2 + 2NaOH = Na2[Cu(OH)4]
Mn(OH)2 + 2OH– = [Mn(OH)6]4–
С другой стороны, даже для безводной азотной кислоты возможны два типа диссоциации:
H3O+ + NO3– + N2O5 R 3HNO3 R H3O+ + 2NO3– + NO2+
кислотная основная
Основная функция проявляет при взаимодействии с HClO4 и H2SO4:
HNO3 + 2HClO4 = H3O+ + NO2+ + 2ClO4–
HNO3 + 2H2SO4 = H3O+ + NO2+ + 2HSO4–
При это образуются перхлорат нитроила NO2ClO4 и гидросульфат нитроила NO2HSO4.
Оксиды типичных неметаллов с водой образуют сильные кислоты, диссоциирующих с образованием оксоанионов:
SO3 + H2O R SO42– + 2H+
SO2 + H2O R HSO32– + 2H+
Амфотерные с преобладанием кислотных свойств легко образуют с
водой гидроксоанионы в щелочной среде:
GeO2 + 2H2O + 2OH– = [Ge(OH)6]2–
Напротив, диссоциация амфотерных гидроксидов с преобладанием основных свойств приводит к образованию гидроксокатионов (основных солей) в кислой среде:
Zn(OH)2 + H+ = Zn(OH)+ + H2O
Если кислотные и основные свойства выражены примерно в одинаковой степени, то возможно взаимодействие по обоим схемам:
3OH– [Ga(OH)6]3–
Ga(OH)3 →
H+ Ga(OH)2+ + H2O
Диссоциация слабоосновных гидроксидов протекает с образованием гидроксо-катионов и гидроксид-ионов:
Fe(OH)2 R Fe(OH)+ + OH–
Гидроксиды типичных металлов обладают сильно основным характером, в водных растворах образуют гидратированные простые катионы (аквакомплексы) и анионы ОН-:
NaOH + aq R Na+·aq + OH–
41
Для многих переходных металлов в высоких степенях окисления характерно образование не только гидроксокатионов, но и оксо-катионов:
ZrO(OH)2 + 2H+ = ZrO2+ + 2H2O
«Ил-катионы»: TiO2+ (титанил), UO2+ (уранил), SO2+ (тионил), SO22+ (сульфурил), SbO+ (антимонил). Отсюда видно, что такие соединения образуют также и р-элементы.
4.5. Окислительно-восстановительные свойства гидрокисдов
На примере гидроксидов можно оценить относительную стабильность различных степеней окисления элемента, взаимные переходы между ними, т.е. рассмотреть окислительно-восстановительную активность в различных степенях окисления. Специфика обусловлена тем, что взаимодействия протекают в водных растворах. Вода является активным участником окислительно-восстановительного процесса, она может окисляться до кислорода и восстанавливаться до водорода. Потенциал водородного электрода:
2H+ + 2e R H2↑
равен нулю только в стандартных условиях, т.е. при активности ионов водорода, равной 1 моль/л, что соответствует рН=0. В общем случае E = 0,059 lg aH + = –0,059pH. С увеличение рН потенциал смещается в отрица-
тельную сторону. Устойчивость окислителей и восстановителей в водной среде зависит от их редокс-потенциала. Очень сильные восстановители восстанавливают воду, поэтому реакции с участием, например, гидридов проводят в неводных средах. Сильные окислители способны окислить воду:
H2O + F2 = 2HF + O
Окислительно-восстановителная активность гидроксидов зависит от степени окисления элемента. В общем случае с увеличением степени окисления растёт способность к окислительному действию (редокс потенциал становится более положительным).
Характерной особенностью некоторых соединений в промежуточных степенях окисления элемента является способность к реакциям диспропорционирования:
+1 |
|
−1 |
+5 |
3HOCl |
→2HCl+ HClO3 |
||
+5 |
|
+7 |
−1 |
4HClO3 |
→3HClO4 |
+ HCl |
|
Соли, хотя и более стабильны, чем кислоты, тоже подвержены диспропорционированию. Склонность к реакциям диспропорционирования – важный классификационный признак, т.к. свидетельствует о нестабильно-
42
сти соответствующих степеней окисления и повышенной склонности их к окислительно-восстановительному распаду.
I ГРУППАПЕРИОДИЧЕСКОЙСИСТЕМЫ
Глава 5. IA-ГРУППА
43

5.1. Особенности химии лития
Химия лития отлична от других щелочных металлов (малый размер атома лития → высокая поверхностная плотность заряда). По многим свойствам химия лития оказывается гораздо ближе химии магния (диагональная аналогия).
1.Литий образует устойчивый гидрид LiH, tразл = 850 °С (NaH разлага-
ется при 420 °С, КН - при 400 °С, RbH - при 360 °С, CsH - при 390 °С).
2.Литий — единственный из щелочных металлов, дающий устойчивый нитрид Li3N.
3.Литий реагирует с углем, образуя карбиды Li2C2, Li4C3.
4.Гидроксид лития при температуре выше 600 °С начинает разлагаться на оксид и воду (гидроксиды щелочных металлов не разлагаются при нагревании).
5.При сгорании на воздухе литий образует оксид Li2О.
6.Литий не образует квасцов.
7.Карбонат лития при нагревании ( >800°С) разлагается.
8.Гидроксид, карбонат, ортофосфат и
фторид малорастворимы в воде.
9.Хлорид, бромид, иодид и перхлорат лития растворимы в этаноле.
10.Литий образует более устойчивые комплексы, чем остальные металлы IA группы.
Во многих соединениях лития химическая связь носит частично ковалентный
характер. LiOH·H2O – в твёрдом виде состоит из димеров Li2(OH)2. Сходные диме-
ры преобладают и в парах LiOH при 800
оС.
Рис. 26. Строение
LiOH·H2O
5.2. Щелочные металлы
Нахождение в природе
Содержание Na (2,27 масс. %) и К (1,84 масс. %). Из минералов наиболее распространены: каменная соль (NaCl), мирабилит Na2SO4·10H2O,
сильвин KCl, сильвинит KCl·NaCl, карналлит KCl·MgCl2·6H2O.
Li (1,8·10-3 масс. %), Rb (7,8·10-3 масс.%), Cs (2,6·10-4 масс. %) – ред-
кие и рассеянные элементы. Rb в минералах сопутствует K. Li и Cs входят в состав силикатов и алюмосиликатов, важнейший минерал Li – сподумен
44
LiAl(SiO3)2 (образует самые большие в мире кристаллы, до нескольких метров). Для Cs известен минерал поллуцит CsAl[Si2O6].
Получение
Li – электролиз расплава LiCl, образующегося при переработке сподумена;
Na – электролиз расплава NaCl, c добавлением CaCl2;
K – действие паров Na на расплав KOH или KCl, образуется сплав Na-K → разделяют перегонкой;
Метод Грейсхейма (сплавление)
î
2KF + CaC2 →1000 Ñ CaF2 + 2C + 2K 2RbCl + Ca →700−800 î Ñ CaCl2 + 2Rb↑
î
2Cs2CO3 + Zr →650 Ñ ZrO2 + 2CO2↑ + 4Cs
Очистка щелочных металлов – возгонка в вакууме.
Химические свойства
Разлагают H2O и C2H5OH:
Na + H2O = NaOH + H2↑
Li с H2O реагирует спокойно, Na – с разогревом, K – с воспламенением, Cs и Rb воспламеняется даже при взаимодействии со льдом:
Na + C2H5OH = C2H5O- + Na+ + H2↑
С водородом образуют гидриды:
o
2Na + H2 →t C 2NaH
Гидриды щелочных металлов солеобразны, имеют ионный характер связи и структуру типа NaCl. Взаимодействуют с водой с выделением водорода:
MeH + H2O → MeOH + H2↑
H-1 + H+1 → H2↑
конпропорционирование
-Легко окисляются кислородом, галогенами;
-Галогениды имеют ионные решетки, структуры типа NaCl и KCl;
-При непосредственном взаимодействии компонентов в вакууме образуются сульфиды Me2S. Также образуют полисульфиды.
-Фосфиды получают прямым синтезом из элементов или действием белого фосфора на раствор металла в жидком аммиаке. Для Na и К – фосфиды Me3P, Me2P5. Для Rb и Cs наиболее характерны Me2P5;
-Взаимодействие с ацетиленом при нагревании – Me2C2 – ацетилениды. Термическая стойкость растёт в ряду: Li2C2 → Na2C2 → Cs2C2 →
Rb2C2 → K2C2;
- С азотом легко реагирует лишь литий. Щелочные металлы взаимодействуют с азотом в виде паров под действием тихого электрического разряда.
45
- Щелочные металлы со ртутью образуют сплавы – амальгамы. Амальгама натрия – удобный восстановитель при проведении синтеза в водном растворе, т.к. она довольно медленно и спокойно разлагается водой:
2NaNO2 + 4Na(Hg) + 2H2O = Na2N2O2 + 4NaOH
гипонитрит натрия
- Щелочные металлы как восстановители:
o
AlCl3 + 3Na t C→ Al + 3NaCl
Кислородные соединения щелочных металлов
При сгорании на воздухе или в кислороде образуются: Li2O (оксид), Na2O2 (пероксид), KO2, RbO2, CsO2 – супероксиды. Они имеют ионные решётки, пероксиды содержат диамагнитный ион [O2]2-, супероксиды – парамагнитный [O2]-.
Оксиды можно получить следующими способами:
o
10K + 2KNO3 t C→ 6K2O + N2↑
o
5NaN3 + NaNO3 t C→ 3Na2O + 8N2↑
o
2NaOH + 2Na t C→ 2Na2O + H2↑
Na2O2 + 2Na → 2Na2O
Получение пероксида лития:
2LiOH + 2H2O2 → 2LiOOH·3H2O
o
2LiOOH·3H2O 300 C→ 2Li2O2 + 4H2O + ½O2↑
Щелочные металлы образуют озониды общей формулой MeO3, в состав которых входит парамагнитный ион [O3]-. Способы получения:
3KOH(тв) + 2O3 → 2KO3 + KOH·H2O + ½O2↑
KO2 + O3 → KO3 + O2↑
Пероксиды, супероксиды и озониды при нагревании разлагаются:
Me2O2(тв) → Me2O(тв) + ½ O2(г)↑
Термическая устойчивость увеличивается с ростом радиуса катиона. С CO2 взаимодействуют с выделением кислорода:
KO2 + СO2 → K2СO3 + 3/2O2↑
(регенерация кислорода в замкнутых помещениях) Пероксиды, супероксиды и озониды – сильные окислители:
4Na2O2 + PbS + 4H2SO4 = PbSO4↓ + Na2SO4 + 4H2O
Na2O2 + CO = Na2CO3
Разлагаются водой:
Me2O2 + H2O = 2MeOH + H2O2
2MeO2 + 2H2O = 2MeOH + H2O2 + O2↑ 4MeO3 + 2H2O = 4MeOH + 5O2↑
46

Субоксиды Rb6O, Rb9O2, Cs7O, Cs11O3 получают при частичном окислении при пониженных температурах.
Рис. 27. Структуры субоксидов:а – RbO6; б – Rb9O2; в – Cs11O3
Гидроксиды
Они являются сильными основаниями, растворимость в воде значительно возрастает от LiOH к CsOH. Плавятся без разложения, LiOH при прокаливании выделяет воду:
2LiOH →>600 o C Li2O + H2O
Гидроксиды рубидия и цезия можно получить из солей обменными реакциями:
Rb2SO4 + Ba(OH)2 → BaSO4↓ + 2RbOH
Взаимодействие с кислотами и кислотными оксидами ведет к образованию солей:
2КОН + SO3 = K2SO4 + H2O
NaOH + HCl = NaCl + H2O
Практически важна реакция: NaOH + CO = HCOONa (поглощает угарный газ)
При нагревании со щелочами многие неметаллы диспропорциони-
руют:
0 |
−2 |
+4 |
|
3S+ 6NaOH |
=2Na2 S+ Na2 S O3 |
+3H2O |
|
Неметаллы (Si, As), не образующие устойчивых гидридов, и некоторые металлы (Zn, Be, Al) реагируют с растворами щелочей с выделением водорода:
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑
Соли
Большинство растворимы в воде. Малая растворимость — соли Li+ с небольшими анионами (LiF, Li2CO3), а также соли K+, Rb+ и Cs+ с крупными анионами: MeClO3, MeClO4, Me[PtCl6] и т.д. Термическая устойчивость
47
солей кислородных кислот возрастает сверху вниз по группе. Особое практическое значение имеет карбонат натрия (кальцинированная сода). Её получают по методу Сольве
NaCl + H2O + CO2 + NH3 = NaHCO3 + NH4Cl
> 100 o C |
+ H2O + CO2↑ |
2NaHCO3 → Na2CO3 |
кальцинирование
Следует отметить, что процесс называется калицинированием, а сам карбонат натрия имеет тривиальное название «калицинированная сода», несмотря на то, что кальция в этом соединении нет.
Комплексные соединения
Мирабилит Na2SO4·10H2O: [Na(H2O)4]2SO4·2H2O.
Устойчивость аммиачных комплексов падает от Li к Na: [Li(NH3)4]+
и [Na(NH3)4]+
С полидентатными лигандами (например, [P2O7]4-) устойчивость
комплексов также уменьшается в ряду:
Li+ > Na+ > K+ > Rb+ > Cs+
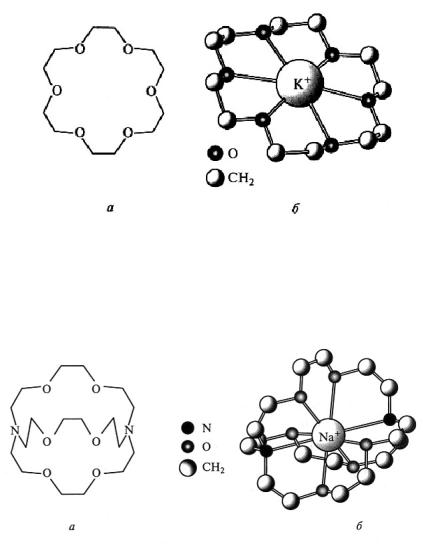
Большое число комплексных соединений с краун-эфирами – циклическими полиэфирами:
Рис. 28. Строение макроциклического полиэфира 18-краун-6 (а) и катиона [K(18-краун-6)]+ (б)
Криптаты – комплексы щелочных металлов c N1-O1-донорными полициклическими лигандами (криптандами). По сравнению с краунэфирами криптанды более эффективно окружают катион металла
48
Рис. 29. Строение криптанда-222 (а)
и катиона в структуре алкалида [Na(криптанд-222)]+Na– (б)
ГЛАВА 6. IВ-ГРУППА
6.1. Простые вещества
Общая характеристика элементов
Электронная конфигурация (n-1)d10ns1. Заполненные d-орбитали в атомах Cu, Ag, Au гораздо слабее экранируют внешние s-электроны, чем p- орбитали, это приводит к тому, что у меди и её аналогов внешний s- электрон сильно связан с ядром. Это, в свою очередь, приводит к высоким значениям первых энергий ионизации, уменьшению атомных радиусов по сравнению с элементами IA группы (Cu+ – 0,096 нм, K+ – 0,133 нм, Na+ – 0,097 нм) и резкому снижению химической активности. Вторые же энергии ионизации атомов IA группы существенно выше, чем у атомов элементов IB группы из-за высокой устойчивости ns2np6 оболочки. Металлический радиус растет от меди к серебру, затем остается практически неизменным (лантанидная контракция). Серебро наследует свойства палладия (двойной проскок, 4d105s0 вместо 4d8s2). У серебра конфигурация d10 как бы более стабильна.
Для элементов IB-группы характерны следующие особенности: вопервых, это разнообразие степеней окисления. Также здесь максимальная степень окисления превышает номер группы (гипервалентные состояния). В водных растворах характерны степени окисления: для Cu +2, для Ag +1, для Au +3. Это согласуется с последовательностью изменения значений энергий ионизации в группе (Ei): Ei1 минимальна у серебра (Ei2 максимальна), для меди минимальна (Ei1 + Ei2), для золота минимальна сумма (Ei1 + Ei2 + Ei3). Также следует отметить высокую склонность к комплексообразованию.
К элементам IB-группы также относят и рентгений Rg (№111) - искусственно синтезированный химический элемент. Наиболее долгоживущий изотоп имеет атомную массу 280 и период полураспада 3,6 секунд. Синтезирован 8 декабря 1994 г. в Дармштадте (Германия). Помимо немецких физиков в международную группу входили трое ученых (Попеко, Еремин, Андреев) из российского Объединённого Института Ядерных Исследований. Рентгений — переходный металл, аналог золота, структура электронной оболочки: [Rn]5f146d107s1.
Нахождение в природе
Элементы IB-группы сравнительно мало распространены в земной коре. Cu (6,8·10-2 мас. %), Ag (8·10-4 мас. %), Au (4·10-5 мас. %). Cu и Ag –
49
халькофильные элементы: Cu2S (медный блеск или халькозин), Ag2S (серебряный блеск или аргентит), CuFeS2 – халькопирит, Cu2O (куприт), Cu2(OH)2CO3 (малахит). Медь и серебро встречаются также в самородном виде, золото – преимущественно в самородном, есть минералы: AuTe2 – кавалерит.
Способы получения
Медь:
2CuFeS2 + O2 → Cu2S + 2FeS + SO2
2Cu2S + 3O2 → 2Cu2O + 2SO2
2Cu2O + Cu2S → 6Cu + 2SO2
Дальше используется электролитическая очистка.
Серебро: получают как побочный продукт переработки медных и свинцово-цинковых сульфидных руд, из шламов электролитического рафинирования меди:
4Ag + 8NaCN + O2 + H2O = 4Na[Ag(CN)2] + 4NaOH
Ag2S + 4NaCN = 2Na[Ag(CN)2] + Na2S
2Na[Ag(CN)2] + Zn(пыль) = Na[Zn(CN)4] + 2Ag↓
Золото: получают промывкой водой (в случае самородного золота). Цианидным методом получают чистый металл (аналогично серебру).
Особенности структуры
Все металлы IB группы кристаллизуются в ГЦК-решетке. Ковалентная составляющая ослаблена (d10), уменьшаются энергии атомизации по сравнению с VIIIB группой.
Химические свойства
Медь, серебро и золото располагаются в ряду напряжений правее водорода и не вытесняют водород из воды и кислот-неокислителей. Химическая активность понижается вниз по группе:
Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2↑ + 2H2O
3Cu + 8HNO3(30%)= 3Cu(NO3)2 + 2NO↑ + 4H2O 6Cu + 12HClO3 = 5Cu(ClO3)2 + CuCl2 + 6H2O
Cu + 2H2SO4(конц) → CuSO4 + SO2↑ + 2H2O
5Cu + 4H2SO4(конц) → 3CuSO4 + Cu2S↓ + 4H2O
2Cu + 6KCN + 2H2O = 2K2[Cu(CN)3] + 2KOH + H2↑ 5Cu + 4NH3 + ½O2 + 3H2O = [Cu(NH3)4(H2O)2](OH)2 5Cu + 4NH4NO3 + 5/2О2 + H2O =
[Cu(NH3)4(NO3)2](OH)2 + 2Cu2(OH)3NO3 ↓
ярко-синее окрашивание |
зелёный осадок |
6Ag + 6HClO3 = AgCl↓ + 5AgClO3 + 3H2O
2Ag + 2H2SO4(конц) = Ag2SO4↓ + SO2↑ + 2H2O
50
