
Периодический закон. 1 и 2 группы
.pdfHgS + Fe → FeS + Hg
Физические свойства
Для цинка и кадмия характерна ГЦК-структура. Полностью заполненные d-орбитали не способны вносить ковалентный вклад в металлическую связь, поэтому она обеспечивается только внешними электронами и ослаблена. Следовательно, характерна небольшая энергия кристаллической решетки, низкая температура плавления, которая понижается вниз по группе. Необычайно низкая температура плавления Hg объясняется наличием 6s2-инертной электронной пары и ее неспособностью участвовать в формировании металлической связи. Следовательно, исключительно высокое сопротивление среди металлов. Hg кристаллизуется при –39 °С, образуя ромбоэдрические кристаллы, при –194 °С образуется тетрагональная модификация с ОЦК-структурой.
Химические свойства
В ряду напряжений цинк и кадмий стоят до водорода, ртуть – после, соответственно активность металлов убывает вниз по группе. Zn на воздухе покрывается тонким слоем ZnO, Cd и Hg – устойчивы, в реакцию с О2 с образованием MeO они вступают при 350 °С. При повышенной температуре Zn и Cd реагируют с галогенами, серой, фосфором. Ртуть образует HgHal2 и HgS уже при комнатной температуре, с фосфором не взаимодействует.
Металлы IIВ группы напрямую не реагируют с H2, гидриды получают косвенным путем:
LiH + ZnBr2 = ZnH2 + 2LiBr
CdI2 + 2LiAlH4 = CdH2 + 2AlH3 + 2LiH
Цинк образует также комплексные гидриды: LiZnH3, Li2ZnH4, Li3ZnH5. CdH2 и HgH2 чрезвычайно неустойчивы.
Характерно взаимодействие с кислотами – неокислителями:
Cd + H2SO4(20 %) = CdSO4 + H2↑
При температуре красного каления цинк взаимодействует с водяным паром:
Zn + H2O → ZnO + H2
С кислотами – окислителями состав продуктов определяется концентрацией раствора:
Zn + 4HNO3(конц.) = Zn(NO3)2 + 2NO2↑ + 2H2O 3Zn + 8HNO3(40 %) = 3Zn(NO3)2 + 2NO↑ + 4H2O 4Zn + 10HNO3(20 %) = 4Zn(NO3)2 + N2O↑ + 5H2O 5Zn + 12HNO3(6 %) = 5Zn(NO3)2 + N2↑ + 6H2O 4Zn + 10HNO3(0,5 %) = 4Zn(NO3)2 + NH4NO3 + 3H2O
Нg стоит в ряду напряжений правее водорода и не восстанавливает H+. С серной кислотой реагирует при нагревании:
71
Hg + 2H2SO4(конц.) → HgSO4 + SO2↑ + 2H2O
Hg + 4HNO3(конц.) = Hg(NO3) 2 + 2NO2↑ + H2O 6Hg(губ) + 8HNO3(30%) = 3Hg2(NO3)2 + 2NO↑ + 4H2O
3Hg + 6HCl(конц.) + 2HNO3(конц.) → 3HgCl2 + 2NO↑ + 4H2O
С растворами щелочей взаимодействует только цинк: Zn + 2NaOH + 2H2O = Na2[Zn(OH) 4] + H2↑
В щелочной среде Zn – очень сильный восстановитель:
4Zn + NaNO3 + 7NaOH + 6H2O = 4Na2[Zn(OH) 4] + NH3
В растворах аммиака:
Zn + 4NH3 H2O = [Zn(NH3) 4](OH)2 + H2↑ + 2H2O
8.2. Соединения элементов IIB-группы
Оксиды
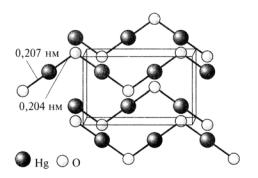
Оксиды состава MeO. ZnO образуется при прокаливании Zn на воздухе и при термическом разложении его солей. При нагревании желтеет из-за образования нестехиометрической фазы ZnO1-х. При прокаливании CdO также окраска становится более интенсивной. ZnO имеет решетку типа вюрцита, CdO – типа NaCl, HgO – зигзагообразные цепи Hg–O···Hg–O···.
Получение оксидов:
ZnCO3 → ZnO + CO2
Cd(OH)2 → CdO + H2O
2Hg + O2 = 2HgO
HgCl2 + 2NaOH = HgO↓ + 2NaCl + H2O HgO термически неустойчив, разлагается выше 400 ºС
HgO – красная и желтая модификации, они отличаются лишь размером частиц. Известна еще красная ромбоэдрическая форма.
Оксиды Zn, Cd, Hg практически нерастворимы в H2O и не взаимодействуют с ней, реагируют с кислотами:
HgO + 2HCl = HgCl2 + H2O
ZnO амфотерен, легко растворяется в растворах щелочей: [Zn(OH)3]-
и [Zn(OH) 4]2-.
Оксид кадмия образует гидроксокомплексы лишь в очень крепких щелочных растворах [Cd(OH)4]2-. HgO c растворами щелочей не взаимо-
72
действует. Таким образом, основные свойства усиливаются вниз по группе.
Окислительные свойства оксидов усиливаются вниз по группе: HgO выше 400 ºС разлагается даже без участия восстановителя. В кислородных
соединениях Zn и Cd проявляют степень окисления +2, для ртути известны катионы Hg22+, Hg32+, Hg42+, входящие в состав солей.
Пероксиды
Меркураты Me2IHgO2 получают нагреванием HgO с пероксидами и надпероксидами щелочных металлов. Цинкаты и кадматы – сплавлением оксидов и карбонатов: Na2MeO2, Na2Me2O3, Na6MeO4. Пероксиды образуются при действии H2O2 на соли металлов IIВ группы, при нагревании или при ударе разлагаются со взрывом.
Гидроксиды
В водных растворах солей Zn и Сd преобладают [M(H2O)6]2+. Слабокислая среда возникает вследствие гидролиза:
[M(H2O) 6]2+ R [M(H2O)5(OH)]+ + H+
MeSO4 + 2NaOH = Me(OH)2↓ + Na2SO4 (Me = Zn, Cd)
Процесс проходит через стадию образования основных солей. В избытке щелочи:
Zn(OH)2 + NaOH + H2O = Na[Zn(OH)3(H2O)]
Cd(OH)2 – лишь в очень концентрированных растворах. Соединения ртути в водных растворах сильно гидролизованы:
[Hg(H2O) 6]2+ R [Hg(H2O)5(OH)]+ + H+
Гидроксид ртути (II) не известен, гидролиз солей сопровождается образованием полиядерных гидроксо- и оксокатионов: [Hg2(OH)(H2O)2]3+, [Hg3O(H2O)3]4+, [Hg4O(OH)(H2O)3]5+. Конечный продукт гидролиза –
HgO. Степень окисления +1 для ртути представлена соединениями, содержащими кластерные группировки, наиболее стабильны биядерные Hg22+. Их образование обусловлено высокой устойчивостью 6s2 электронной пары и стремлением атома Hg сохранить эту пару хотя бы в виде ковалент-
ной связи, принадлежащей одновременно обоим атомам: Hg22+ + 2OH- = Hg↓ + HgO↓ + H2O
Ион диртути (I) в форме аквакомплекса [H2O–Hg–Hg–OH2]2+ только при стандартных условиях устойчив к диспропорционированию.
Соли и комплексы
Соединения Hg(I)
Соли Hg(I) устойчивы лишь с анионами кислородсодержащих кислот, хлоридами и бромидами. Hg2(NO3)2(H2O)2 кристаллизуется из растворов, полученных взаимодействием избытка Hg с разбавленной HNO3 –
73
на холоду, медленно. При высокой температуре разлагается на HgO, NO2 и
H2O:
Hg2(NO3)2 + 4HNO3(конц.) = 2Hg(NO3)2 + 2NO2↑ + 2H2O Существуют также Hg2CO3 (Hg2(NO3)2 + Na2CO3) и Hg2CrO4
(Na2CrO4 + Hg2(NO3)2). Комплексы Hg(I) получены лишь с азотдонорными лигандами типа пиридина. Существуют соединения ртути с катионами Hgn2+ c дробными степенями окисления:
3Hg + 3AsF5 = Hg3(AsF6)2 + AsF3
4Hg + 3AsF5 = Hg4(AsF6)2 + AsF3
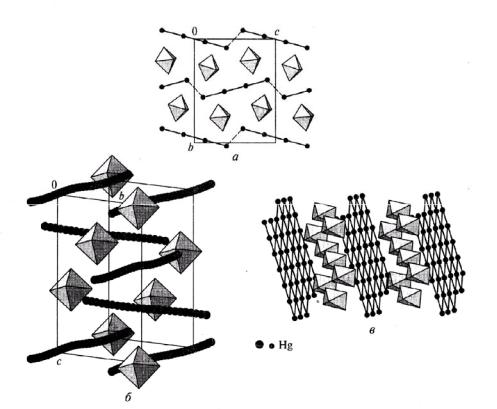
В сильнокислых неводных растворителях в присутствии ряда анионов образуются линейные катионы Hgn2+ из связанных между собой атомов ртути, находящихся в дробных степенях окисления (рис. 38).
Рис. 38. Соединения ртути в низких степенях окисления: а – линейные катионы Hg42+ в структуре Hg4(AsF6)2; б – бесконечные разупорядоченные цепочки из атомов ртути в Hg3-xAsF6; в – гексагональные слои Hgn в структуре Hg3NbF6
Степень окисления +1 для Zn и Сd не характерна, однако есть сведения, например, о Cd2(AlCl4)2.
Степень окисления +2
Соединения в степени окисления +2 характерны для всех элементов IIB группы. Эта степень окисления соответствует конфигурации d10. Соли Zn и Cd c анионами кислородсодержащих кислот, как правило, изоморфны солям Mg, но менее устойчивы. Малорастворимы сульфиды, фосфаты,
74
карбонаты, оксалаты, силикаты и сульфиты. Безводные карбонаты, сульфаты, нитраты термически разлагаются до оксидов. ZnSO4·7H2O – цинковый купорос, выделяется из растворов, полученных взаимодействием Zn с Н2SO4. Оксиды рутути и кадмия – это основные оксиды, оксид цинка амфотерен.
ZnO + Na2S2O7 → Na2[Zn(SO4)2]
При растворении карбонатов или гидроксидов в HNO3 образуются
Zn(NO3)2·6H2O; Cd(NO3)2·4H2O. Соединения Zn(II) в гораздо большей сте-
пени ковалентны, чем Cd(II) из-за меньшего ионного радиуса Zn2+ при одном и том же типе оболочки. Поэтому комплексные соединения Zn более устойчивы, чем Cd.
Zn(OH)2 + 4NH3 = [Zn(NH3)4](OH)2 Ку = 5,6·1012 Сd(OH)2 + 6NH3 = [Cd(NH3)6](OH)2 Ку = 3,6·104
При кипячении и разбавлении водой разрушается лишь кадмиевый комплекс и выпадает Cd(OH)2.
Zn и Cd, подобно Mg, образуют двойные соли типа шёнитов: Me2ISO4·ZnSO4·6H2O.
Соли Hg(II) в водных растворах сильно гидролизованы: [Hg(H2O)6]2+ R [Hg(H2O)5(OH)]+ + H+
Гидролиз сопровождается образованием полиядерных гидроксо- и оксокатионов.
Соединения ртути (II)
Известны соли ртути (II) с сильными кислородсодержащими кислотами, например, Hg(NO3)2·H2O получается растворением Hg в избытке концентрированной HNO3. Аналогично получают HgSO4. Соли слабых кислот – Н2СО3, Н2SiО3, Н2SО3 – малоустойчивы или неизвестны. Более, чем сульфит, устойчива комплексная соль Na2[Hg(SO3)2]. Известны фосфаты: Hg(PO4)2, HgHPO4, Hg2P2O7. Соединения Hg(II) проявляют окислительные свойства:
HgSO4 + 2FeSO4 = Fe2(SO4)3 + Hg↓
Hg(NO3)2 + Cu = Cu(NO3)2 + Hg↓
Hg(NO3)2 + Hg = Hg2(NO3)2
Комплексообразование
HgCl2 + 2NH3 → [Hg(NH3)2]Cl2↓
В отсутствие ионов NH4+:
HgCl2 + 2NH3 → [HgNH2]Cl↓ + NH4Cl
HgCl2 + NH3 + HgO → [HgNH]Cl2↓+ H2O
Hg2+ + C6H6 ↔ [HgC6H6]2+
Вообще имеется большое число ртутьорганических соединений.
Галогениды и галогенидные комплексы
75
Для всех трёх металлов известен полный набор дигалогенидов, низшие известны только для Hg. При переходе от Zn к Cd степень ионности связи Me–Hal возрастает, что приводит к росту Тпл и Ткип, увеличению устойчивости к гидролизу. Галогениды ртути все, за исключением фторида, ковалентны (инертность 6s2-пары, эффективное перекрывание 5d- орбиталей Hg с валентными МО лигандов). Ковалентность связи Me–Hal возрастает также с ростом атомного номера Hal по мере уменьшения его электроотрицательности и в этом же ряду – усиление π-взаимодействия металл-лиганд, что приводит к резкому возрастанию устойчивости галогенидных комплексов при переходе от фторидов к иодидам.
Хлориды, бромиды и иодиды Zn и Cd очень хорошо растворимы в воде, безводные – гигроскопичны, кристаллизуются из водных растворов в виде кристаллогидратов. В разбавленных растворах наряду с [Zn(H2O)6]2+ присутствуют [ZnCl4]2-, [ZnCl3(H2O)]-, [ZnCl2(H2O)4]. Для кадмия известны
Cd2OCl2, Cd(OH)Cl, Cd(OH)3Cl. Образует и автокомплекс: 2CdI2 + 6H2O R [Cd(H2O)6]2+ + [CdI4]2-
Галогениды Zn и Cd легко образуют комплексы, к.ч. в основном 4: K[ZnCl3(H2O)], K2[ZnCl4], но бывает и 6: K4[CdCl6].
HgSO4 + 2NaCl → HgCl2 + Na2SO4
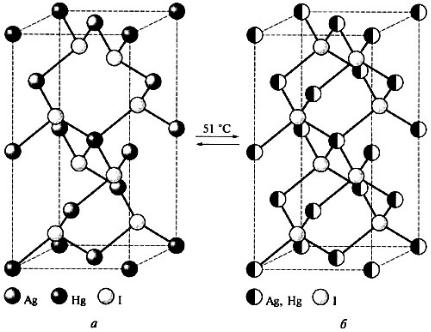
Бромид и иодид ртути слабо диссоциированы в водных растворах: HgI2 + 2I- = [HgI4]2- – устойчив, не разрушается при добавлении щелочи. Для некоторых солей переходных металлов характерен полиморфизм, сопровождающийся изменением окраски. Низкотемпературная β- модификация Ag2[HgI4] имеет жёлтую окраску, при нагревании до 51 оС атомы серебра перемещаются в тетраэдрические пустоты и образуется оранжево-карасная α-модификация (рисунок 39).
76
Рис. 39. Взаимные превращения жёлтой β (а) и красной α (б) модификаций
Ag2[HgI4].
В твердых галогенидах (кроме фторидов) содержатся тетраэдры [HgX4], во фторидах – октаэдры [HgF6]:
Hg2X2 R HgX2 + Hg
Склонность к диспропорционированию возрастает вниз по группе. Иодид при комнатной температуре:
Hg2I2 + 2KI = K2[HgI4] + Hg
Все галогениды имеют молекулярное строение и состоят из линейных молекул HgX2 со связью Hg–Hg.
HgCl2 + Hg = Hg2Cl2↓
Hg2Cl2 + KCl → K[HgCl3] + Hg
Хлориды ртути имеют тривиальные названия. Так, HgCl2 – это сулема, а дихлорид диртути, Hg2Cl2 – каломель. Каломель легко окисляется:
Hg2Cl2 + Cl2 = 2HgCl2
и восстанавливается:
Hg2Cl2 + SnCl2 + 2HCl = Hg↓ + H2[SnCl6]
При действии аммиака чернеет:
Hg2Cl2 + 2NH3 = [HgNH2]Cl↓ + Hg↓ + NH4Cl
Сульфиды
Известны лишь MeS, все они нерастворимы в воде, поэтому осаждаются из водных растворов сероводородом или сульфидами, могут быть получены прямым синтезом из простых веществ. Устойчивость к действию кислот возрастает вниз по группе: ZnS легко реагирует с разбавленными кислотами, CdS растворяется в концентрированной HCl, а HgS – в царской водке. Получение:
ZnS(крист.) :
3ZnO + 4S + NH3 + H2O → 3ZnS↓ + (NH4)2SO4
CdS:
2CdO + 3S → 2CdS↓ + SO2
Это кристаллический, аморфный – из водных растворов. При осаждении сероводородом:
3HgCl2 + 2H2S = Hg3S2Cl2↓ + 4HCl
Hg3S2Cl2 + H2S = 3HgS↓ + 2HCl
После обработки полисульфидами щелочных металлов или возгонки
– красная модификация HgS - киноварь. Она необычайно инертна к кислотам и щелочам, растворяется лишь в царской водке. Черная модификация имеет структурный тип сфалерита, каркас из тетраэдров [HgS4], соединенных вершинами. Киноварь построена из спиралевидных цепей –Hg–S–
77
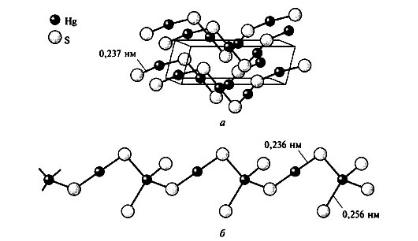
Hg–S– , в которых атомы серы из соседних цепей дополняют координацию атомов Hg до искаженной октаэдрической (рисунок 40).
Сульфиды Zn, Cd, Hg при сплавлении с сульфидами щелочных металлов образуют тиосоли.
Рис. 40. Структура киновари HgS (а) ; фрагмент цепи полианиона в структуре тиомеркурата натрия Na2[Hg3S4]·2H2O (б)
Список литературы
1.Неорганическая химия. Химия элементов : в 2 т. : учебник / Ю.Д. Третьяков, Л.И. Мартыненко, А.Н. Григорьев, А.Ю. Цивадзе. – 2-е изд., перераб. и доп. – М. : Изд-во МГУ; Академкнига, 2007.
2.Неорганическая химия : в 3 т. : учебник для студ. вузов, обуч. по направлению 510500 «Химия» и специальности 011000 «Химия» / под ред.
Ю.Д. Третьякова. – М. : Academia, 2004.
3.Угай Я.А. Неорганическая химия : учеб. для хим. спец. вузов /
Я.А. Угай. – М. : Высш. шк., 1989. – 463 с.
4.Угай Я.А. Общая и неорганическая химия : учебник для студ. вузов, обуч. по направлению и специальности «Химия» / Я.А. Угай. – 5-е изд.,
стер. – М. : Высш. шк., 2007. – 526, [1] с.
78
5.Шрайвер Д. Неорганическая химия : в 2 т. / Д. Шрайвер, П. Эткинс. – М. : Мир, 2004. – (Лучший зарубежный учебник).
6.Гринвуд Н. Химия элементов : в 2 т. : [учебник для вузов] / Н. Гринвуд, А. Эрншо. – М. : БИНОМ. Лаб. знаний, 2008. – (Лучший зарубежный учебник).
7.Льюис М. Химия в диаграммах / М. Люис ; пер. с англ. С.П. Торшина. – М. : АСТ ; Астрель, 2004. – 159, [1] с. – (Оксфордские учебные пособия).
8.Химические свойства неорганических веществ : учеб. пособие для вузов / Р.А. Лидин, В.А. Молочко, Л.Л. Андреева ; под ред. Р.А. Лидина. – 4-е изд., стер. – М. : КолосС, 2003. – 480 с.
|
Оглавление |
|
Периодический закон как основа химической систематики.......................... |
3 |
|
Глава 1. |
Виды аналогий...................................................................................... |
3 |
1.1. Групповая и типовая аналогии. Электронная аналогия |
|
|
и кайносимметрия........................................................................................ |
3 |
|
1.2. Переходные элементы. Контракционная аналогия. |
|
|
Вторичная периодичность.......................................................................... |
5 |
|
1.3. Атомные орбитальные радиусы элементов. |
|
|
Внутренняя периодичность........................................................................ |
6 |
|
Глава 2. Простые вещества................................................................................. |
9 |
|
2.1. Общая характеристика......................................................................... |
9 |
|
2.2. Физические свойства простых веществ........................................... |
11 |
|
2.3. Химические свойства простых веществ........................................... |
15 |
|
79
2.4. Нахождение в природе и общие принципы получения |
|
|
простых веществ........................................................................................ |
16 |
|
Глава 3. |
Бинарные соединения........................................................................ |
18 |
3.1. Важнейшие структурные типы, характерные |
|
|
для бинарных соединений........................................................................ |
18 |
|
3.2. Основные классы бинарных соединений......................................... |
23 |
|
Глава 4. |
Сложные соединения......................................................................... |
36 |
4.1. Генетическая связь сложных соединений с более простыми........ |
37 |
|
4.2. Гидроксиды как характеристические соединения.......................... |
37 |
|
4.3. Кислотно-основные свойства и амфотерность гидроксидов......... |
38 |
|
4.4. Проявление кислотно-основных свойств гидроксидов |
|
|
при химическом взаимодействии............................................................ |
40 |
|
4.5. Окислительно-восстановительные свойства гидроксидов ............ |
41 |
|
I группа Периодической системы.................................................................... |
42 |
|
Глава 5. |
IA-группа............................................................................................. |
42 |
5.1. |
Особенности химии лития................................................................. |
42 |
5.2. |
Щелочные металлы............................................................................ |
43 |
Глава 6. |
IВ-группа............................................................................................. |
47 |
6.1. Простые вещества............................................................................... |
47 |
|
6.2. Соединения элементов IB-группы.................................................... |
50 |
|
II группа Периодической системы .................................................................. |
61 |
|
Глава 7. |
IIA-группа............................................................................................ |
61 |
7.1. |
Общая характеристика....................................................................... |
61 |
7.2. |
Химия бериллия.................................................................................. |
62 |
7.3. |
Химия магния...................................................................................... |
65 |
7.4. |
Щелочно-земельные металлы (Ca, Sr, Ba)....................................... |
66 |
Глава 8. |
IIB-группа............................................................................................ |
69 |
8.1. Простые вещества............................................................................... |
69 |
|
8.2. Соединения элементов IIB-группы .................................................. |
71 |
|
Список литературы ........................................................................................... |
78 |
|
|
Учебное издание |
|
ПЕРИОДИЧЕСКИЙ ЗАКОН КАК ОСНОВА ХИМИЧЕСКОЙ СИСТЕМАТИКИ. ХИМИЯ ЭЛЕМЕНТОВ I И II ГРУПП ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
Учебное пособие для вузов
Составители:
80
