
Периодический закон. 1 и 2 группы
.pdfФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ
УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«ВОРОНЕЖСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
ПЕРИОДИЧЕСКИЙ ЗАКОН КАК ОСНОВА ХИМИЧЕСКОЙ СИСТЕМАТИКИ. ХИМИЯ ЭЛЕМЕНТОВ I И II ГРУПП ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
Учебное пособие для вузов
И.Я. Миттова, Е.В. Томина, Б.В. Сладкопевцев
Издательско-полиграфический центр Воронежского государственного университета
2009
Утверждено научно-методическим советом химического факультета 25 декабря 2008 г., протокол № 6
Рецензент д-р хим. наук, проф. кафедры общей химии В.Н. Семенов
Учебное пособие подготовлено на кафедре неорганической химии химического факультета Воронежского государственного университета.
Рекомендуется для студентов I курса химического факультета дневного и вечернего отделений.
Для направлений: 020900 – Химия, физика и механика материалов, 0201010 – Химия
2
ПЕРИОДИЧЕСКИЙ ЗАКОН КАК ОСНОВА ХИМИЧЕСКОЙ СИСТЕМАТИКИ
Периодический закон – один из фундаментальных законов в современном естествознании. Он является руководящим принципом, обеспечивающим систематическое, целенаправленное и осознанное изучение огромного фактического материала современной неорганической химии. Периодическая система элементов Д.И. Менделеева представляет собой графическое выражение Периодического закона.
Периодический закон в своём развитии прошёл три этапа:
1.Менделеевский этап – создание закона и системы Д.И. Менделеевым. Основа систематики – атомная масса. Формулировка закона на тот момент выглядит следующим образом: «Свойства элементов, а также формы и свойства образуемых ими простых и сложных тел находятся в периодической зависимости от атомных масс».
2.Открытие закона Мозли. Новая формулировка: «Свойства элементов,
атакже образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядра».
3.Современный этап. Периодичность обусловлена периодическим повторением строения электронных оболочек.
Периодическая система – таблица с горизонтальными строками (периодами) и вертикальными столбцами (группами). Можно рассматривать её как своеобразную матрицу, в которой положение элемента определяется пересечением строки и столбца – инвариантность положения элемента.
Инвариантность может нарушаться в некоторых случаях (как пример – положение водорода). Номер периода отвечает номеру внешнего слоя, который не завершён и заполняется электронами. Номер группы определяется числом электронов на заселяющихся внешних и предвнешних подуровнях, независимо от типа заполняемых орбиталей. Номер группы также определяет высшую положительную степень окисления. Далее рассмотрим виды аналогий, которые можно обнаружить в Периодической системе.
ГЛАВА 1. ВИДЫ АНАЛОГИЙ
1.1. Групповая и типовая аналогии. Электронная аналогия и кайносимметрия
Первый тип аналогий – групповая аналогия – объединение в группы элементов, у которых наблюдается аналогия в высшей степени окисления, отвечающей номеру группы. Пример: главные и побочные группы (группы А и группы В) объединяются в одну группу. Однако имеются исключения: среди элементов VIIIB-группы только для рутения и осмия известна степень окисления +8, другие же элементы проявляют более низкие степени
3
окисления, это так называемые гиповалентные состояния. Напротив, среди элементов IB-группы только серебро проявляет характерную степень окисления +1, а для меди наиболее типична степень окисления +2, для золота +3. Таким образом, для меди и золота характерны гипервалентные состояния.
Групповая аналогия – наиболее общий вид аналогии. Он формируется по наиболее общему признаку. В пределах каждой группы можно выделить элементы, которые обладают более глубоким сходством между собой не только в высшей характеристической степени окисления, но и во всех промежуточных, а также в нулевой степени окисления. Это типовая аналогия. Она определяется не только общим числом валентных электронов, но и типом заселяемых орбиталей. Именно по этому признаку группы разбиваются на подгруппы – главные и побочные.
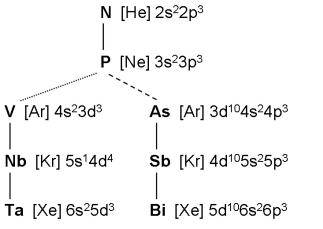
Помимо уже упомянутых выше видов аналогий, существует более тонкий вид – электронная аналогия. Рассмотреть её можно на примере элементов V группы. (рис. 1)
Для азота и фосфора одинакова не только конфигурация, но и тип заселяемых орбиталей. Поэтому азот и фосфор являются полными элек-
тронными аналогами. Мышь-
як, сурьма и висмут, с одной стороны, и ванадий, ниобий и тантал, с другой, по тем же причинам также являются полными электронными аналога-
ми. Полная электронная анналогия проявляется в сходстве электронных конфи-гураций не только для нейтра-льных атомов, но и во всех степенях окисления без исключения.
Следует отметить, что элементы малых периодов в каждой группе называются типическими (определение дано Д.И. Менделеевым). Они как бы определяют химический облик группы в целом.
С одной стороны, азот и фосфор, а с другой – элементы подгруппы мышьяка являются неполными аналогами. Однако это более глубокая аналогия, чем для элементов подгруппы ванадия (например, элементы подгруппы ванадия не проявляют отрицательную степень окисления).
Подобным образом можно представить характер аналогии практически во всех группах Периодической системы. Однако имеются некоторые особенности. В I и II группах типические элементы дают сквозную полную
4
аналогию с остальными элементами главной подгруппы, поскольку здесь ещё не происходит заполнения d-уровня у последних. С другой стороны, в VIII группе также имеются свои особенности. Во-первых, здесь типические элементы не определяют облик группы в силу полной инертности, а во-вторых, VIIIB-группа по структуре отличается от остальных.
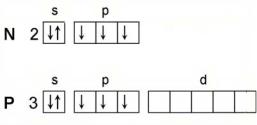
Сравнивая типические элементы II и III периодов, можно отметить, что они в электронном отношении также отличаются между собой. С одной стороны, у элементов III периода имеется вакантный 3d-уровень, отсутствующий у элементов II периода (рис. 2). Поэтому у элементов второго периода ковалентность не может превышать четырёх с учётом донорно-акцепторного взаимодействия. С другой стороны, р-элементы
II периода отличаются от своих аналогов из III периода тем, что у них р- орбитали появляются впервые. Такие орбитали обладают рядом особенностей по сравнению с другими аналогичными орбиталями: на кривой радиального распределения для таких орбиталей существует единственный максимум электронной плотности. Кроме того, под этими орбиталями отсутствуют орбитали той же симметрии, что существенно ослабляет эффект экранирования и увеличивает прочность связи этих электронов с ядром, следствием чего является возрастание энергии ионизации и ослабление металлических свойств. Такие орбитали были названы кайносимметричными (ими являются 1s-, 2p-, 3d- и 4f-орбитали). Поэтому можно ввести понятие о более тонкой аналогии – слоевой. Слоевые аналоги – такие типовые аналоги, которые не имеют внешних или предвнешних кайносимметричных орбиталей (пример – во IIA группе элементы Ca, Sr, Ba – полные электронные аналоги).
1.2. Переходные элементы. Контракционная аналогия. Вторичная периодичность
В больших периодах между s- и р-элементами появляются вставки из 10 d-элементов, которые называют вставными декадами или переходными металлами. В VI и VII периодах между IIIB- и IVB-группами появляются вставки из 14 f-элементов, у которых заполняется (n – 2)f-уровень. Существуют две особенности d-элементов. Во-первых, большое разнообразие промежуточных степеней окисления. Во-вторых, менее резкое, плавное изменение свойств в пределах одного периода. Все d-металлы – металлы средней и малой активности. f-элементы ещё более близки по свойствам между собой, т. к. заселяется третий снаружи слой.
5
Для атомов переходных элементов отмечаются две тенденции, существенно влияющие на их химические свойства. С одной стороны, увеличение числа электронов на предвнешнем уровне способствует увеличению экранирования внешних s-электронов, что должно приводить к усилению металлических свойств. С другой стороны, увеличение заселённости внутренних орбиталей приводит к уменьшению атомного радиуса, что должно ослаблять металлические свойства. Это явление получило название лантанидной контракции. Для d-элементов это называется d-сжатием. В результате наложения двух тенденций оказывается, что хотя d-элементы и являются металлами, но металлические свойства у них выражаются менее ярко, чем у s- и р-металлов.
Следует также отметить, что у d-элементов IV периода заполняющаяся 3d-оболочка является кайносимметричной. Также кайносимметричной оболочкой является 4f-оболочка у лантанидов, которой они отличаются от актинидов. В то же время на d-элементах VI периода, начиная с IVBгруппы, сказывается лантанидная контракция, приводящая к тому, что их атомные радиусы такие же, как и у их аналогов из V периода. А близость атомных радиусов определяет близость энергий ионизации и сходство свойств элементов V и VI периода в целом. На этом основана ещё одна тонкая аналогия, которая называется контракционной. Она наблюдается у d-элементов V и VI периодов, начиная с IVВ-группы, весьма похожих по свойствам, и особенно это заметно у циркония и гафния.
Совместное действие кайносимметричности и лантанидной контракции приводит к своеобразному явлению, называемому вторичной периодичностью. Она наблюдается у d-элементов (кроме IIIB-группы) и проявляется в том, что 3d-элемент IV периода «отлетает» по свойствам от своего аналога в V периоде, а элемент VI периода к нему подтягивается по свойствам.
1.3. Атомные орбитальные радиусы элементов. Внутренняя периодичность
На рис. 3 приведены атомные орбитальные радиусы элементов. Общая закономерность состоит в том, что чем на меньшем промежутке заполняется соответствующий подуровень, тем резче уменьшается радиус в пределах одного периода. s-подуровень заполняется на промежутке из двух элементов, поэтому в пределах периода орбитальный радиус резко уменьшается. У р-элементов заполнение на промежутке из шести элементов, поэтому в пределах периода радиус меняется более плавно. У d- элементов радиус меняется ещё более плавно.
6
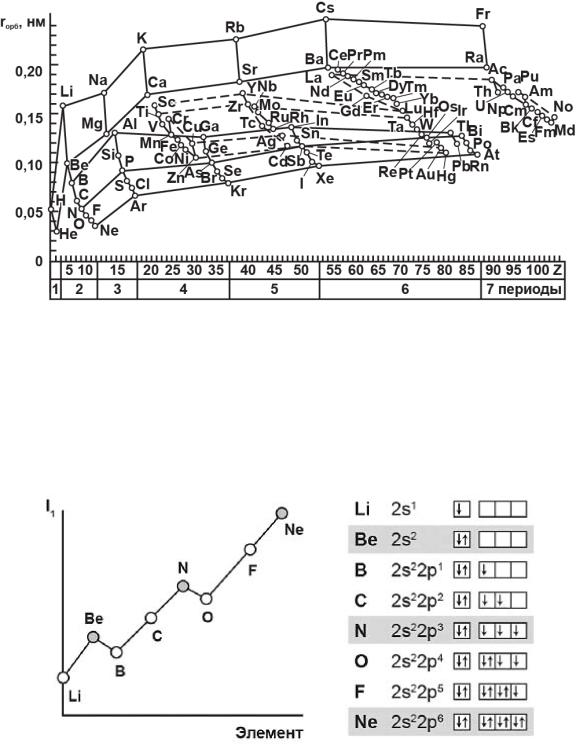
Рис. 3. Атомные орбитальные радиусы элементов
Наряду с упомянутой вторичной периодичностью, существует так называемая внутренняя периодичность (внутри периода, по горизонтали). Она обусловлена тем, что вырожденные орбитали в соответствии с правилом Гунда заселяются сначала по одному электрону, а затем повторно. Благодаря этому р-элементы разбиваются на две тройки, d-элементы – на две пятёрки, f-элементы – на две семёрки.
Рис. 4. Изменение первого потенциала ионизации для элементов второго периода. I1 максимален у элементов с полностью заполненными валентными оболочками (у благородных газов), при переходе к следующему периоду. I1 резко понижается –
он минимален у щелочных металлов
Наибольшей стабильностью обладают полностью вакантные подуровни, полностью завершённые, а также наполовину завершённые в соответствии с правилом Гунда (рис. 4). Аналогичная картина наблюдается для
7
d- и f-элементов, только необходимо смотреть третий потенциал ионизации. При этом наблюдается известная закономерность: элементы второй пятёрки или элементы второй семёрки особенно близки по свойствам – это так называемая горизонтальная аналогия. Этим, в частности, можно объяснить особое строение VIIIB-группы, состоящей из триад, здесь проявляет-
ся данный вид аналогии: Fe – Co – Ni, Ru – Ph – Pd, Os – Ir – Pt. Такую же аналогию можно проследить для элементов 2-й семёрки лантанидов (Tb – Lu), Ho – Er – Tm. Другими примерами являются аналогия элементов 2-й семёрки актинидов (кюриды) и аналогия p-элементов больших периодов
(Ge – As, Pb – Bi).
Наконец, существует ещё один вид аналогии, которая называется диагональной. Наиболее известна диагональная аналогия в парах элементов II и III периода: Li – Mg, Be – Al, B – Si. Это так называемая диагональная аналогия в широком смысле, т. е. сходство общего химического характера элементов. Например, литий в отличие от щелочных металлов при сгорании на воздухе даёт оксид, а не пероксид, и так же, как и магний, образует не только оксид, но и нитрид:
2Li + ½ O2 = Li2O |
Mg + ½ O2 = MgO, |
3Li + ½ N2 = Li3N |
3Mg + N2 = Mg3N2. |
Гидроксид лития так же, как и гидроксид магния, довольно трудно растворим в воде, хотя и является сильным основанием.
Бериллий так же, как и алюминий, амфотерный элемент, склонен к образованию гидроксобериллатов [Be(OH)4]2–, подобно гидроксоалюминатам [Al(OH)4]– и [Al(OH)6]–. Их гидриды не солеобразны, BeH2 – полимерен, AlH3 представляет собой димер. Также данный вид аналогии можно проследить для бора и кремния: B2H6, SiH4, B2O3, SiO2. Здесь проявляется кислотный характер оксидов и гидроксидов, также характерно для обоих элементов стеклообразование оксидов и образование полимерных структур.
Объясняется диагональная аналогия существенным изменением электроотрицательности по периоду (возрастание) и по группе (уменьшение) (рис. 5).
При этом оказывается, что для элементов по диагонали электроотрицательности оказываются очень близкими, хотя сами по себе орбитальные радиусы для диагональных пар не столь близки.
8
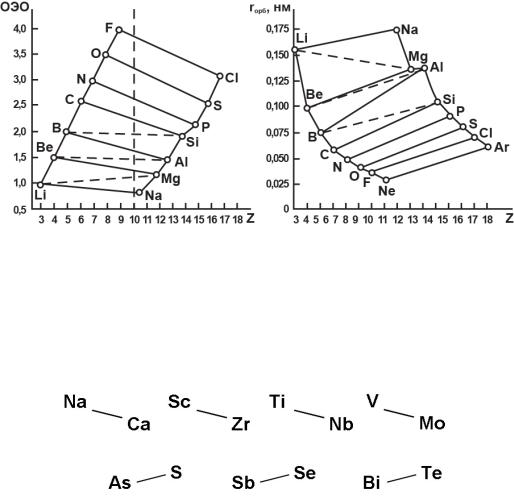
Рис. 5. Зависимость электроотрицательности (а) и орбитальных радиусов (б) элементов 2-го и 3-го периодов от порядкового номера
Также существует диагональная аналогия в узком смысле, она определяется близостью атомных радиусов и проявляется в изоморфном замещении, особенно в природных минералах. Эту аналогию можно назвать прямой или нисходящей: слева сверху, вправо вниз:
Известна и обратная, восходящая аналогия:
Она наблюдается, например, в полиметаллических рудах (сульфарсенидные минералы). Как пример, минералы: FeS2 (пирит), FeAs2 (лелленгит), FeAsS (арсенопирит), которые можно рассматривать как продукт изоморфного замещения.
ГЛАВА 2. ПРОСТЫЕ ВЕЩЕСТВА
2.1. Общая характеристика
Простые вещества – это следующий этап в изучении химической организации вещества. Простые вещества принципиально отличаются от более сложных классов химических объектов в двух аспектах:
–отсутствуют эффекты, связанные с разностью электроотрицательностей
→реализациялибометаллических, либонеполярныхковалентныхсвязей;
–отсутствует понятие «состав» и связанные с ним проблемы постоянства и переменности состава.
Также простое вещество отличается от элемента в том плане, что здесь впервые появляется само понятие «химическая связь». Следующая особенность в том, что один и тот же элемент может образовывать несколько простых веществ. Свойства простого вещества часто радикально
9
отличаются от свойств элемента, например, элемент азот – один из наиболее активных неметаллов, а простое вещество азот – весьма инертный газ. Рассмотрим другие примеры:
Элемент |
Простое вещество |
кислород – O |
кислород – O2 |
углерод – С |
алмаз – С, графит – С |
железо – Fe |
железо – Fe |
В первом примере элемент и простое вещество одинаково называются, но по-разному обозначаются; различить элемент и простое вещество достаточно просто. Во втором примере, наоборот, элемент и простое вещество одинаково обозначаются, но по-разному называются. В третьем примере элемент и простое вещество и называются, и обозначаются одинаково, что вызывает определённые затруднения, и различать такие понятия следует по контексту, в котором употребляется название или обозначение.
Для того чтобы различать понятия «элемент» и «простое вещество», удобно рассматривать простые вещества как гомоатомные химические соединения.
Простые вещества разделяются на два класса: металлы и неметаллы. Подразделение в данном случае основано на резком различии физических и химических свойств. Когда элемент образует простое вещество, то в принципе реализуется две возможности: образование молекул (газы, жидкий Br2 и молекулярные кристаллы I2) и координационных кристаллов. Соответственно, различают химическое строение простых веществ (для молекул) и кристаллохимическое строение – для кристаллов.
Для реализации ковалентных связей атом должен иметь достаточное число валентных электронов – не меньше четырёх. На этом основании в Периодической системе можно провести вертикальную границу между IIIA- и IVAгруппами, слева от которой располагаются элементы с дефицитом валентных электронов, а справа – с избытком. Эта вертикаль называется границей Цинтля. Для элементов, располагающихся справа от границы Цинтля, существует кристаллохимическое правило Юм-Розери 8 — N, где N – номер группы.
Применение правила 8-N
IVА-группа
С – структура типа алмаза,
к. ч. = 8 – 4 = 4, sp3-гибридизация.
VА-группа
As, Sb, Bi – слоистая структура, гофрированные слои, к. ч. = 8 – 5 = 3, sp2-гибридизация.
VIА-группа
S, Se, Te – цепные структуры, к. ч. = 8 – 6 = 2, sp-гибридизация.
VIIА-группа
10
