
5 и 6 группы
.pdfВажнейший промышленный минерал хрома – хромистый железняк FeCr2O4. Реже встречаются другие минералы – крокоит PbCrO4, хромовая охра Cr2O3. Основная форма нахождения молибдена и вольфрама в природе – полевые шпаты, пироксены. Из минералов молибдена наибольшее значение имеет молибденит MoS2, в основном благодаря тому, что не содержит значительных количеств других металлов, что существенно облегчает переработку руды. Продуктами его окиcления в природных условиях являются вульфенит PbМоO4 и повеллит СаМоO4. Важнейшие минералы вольфрама – шеелит CaWO4 и вольфрамит (Fe, Mn)WO4, однако среднее содержание вольфрама в рудах крайне низко – не более 0,5 мас. %. Благодаря близости свойств молибдена и вольфрама существуют полные твердые растворы СаМоO4 – CaWO4 и РbМоO4 – PbWO4.
Чистый хромобразуется при восстановлении оксида Cr2O3 алюминием:
Cr2O3 + 2Аl → 2Cr + Аl2O3
или кремнием:
2Cr2O3 + 3Si → 4Cr + 3SiO2.
Для получения оксида хромистый железняк подвергают окислительному плавлению в щелочной среде:
4FeCr2O4 + 8Na2CO3 + 7O2 → 8Na2CrO4 + 2Fe2O3 + 8СO2↑,
образующийся при этом хромат Na2CrO4 обрабатывают серной кислотой:
2Na2CrO4 + 2H2SO4 → Na2Cr2O7 + 2NaHSO4 + H2O.
Затем выкристаллизовавшийся бихромат натрия Na2Cr2O7 · 2Н2O обезвоживают и восстанавливают серой или углем:
Na2Cr2O7 + 2С → Cr2O3 + Na2CO3 + СО↑.
Наиболее чистый хром в промышленности получают электролизом концентрированного водного раствора хромового ангидрида CrO3 в серной кислоте, раствора сульфата хрома (III) Cr2(SO4)3 или хромоаммонийных квасцов. Полная очистка металла от примесей азота или кислорода достигается выдерживанием металла в атмосфере водорода при температуре 1500 оС или перегонкой в высоком вакууме.
Для получения молибдена руду, обогащенную методом флотации, обжигают:
2MoS2 + 7O2 → 2MoO3↑ + 4SO2.
Образующийся оксид при температуре реакции отгоняют. Затем его дополнительно очищают возгонкой. Порошок металла получают восстановлением оксида водородом:
МоO3 + 3Н2 → Мо + ЗН2О↑.
Исходным веществом для производства вольфрама служит оксид WO3. Для его получения руду (шеелит CaWO4 или вольфрамит FeWO4), предварительно обогащенную флотацией в растворах поверхностно-активных веществ, подвергают щелочному или кислотному вскрытию. Щелочное вскрытие проводят, разлагая концентрат в автоклавах раствором соды:
81
CaWO4 + Na2CO3 → Na2WO4 + CaCO3↓.
Равновесие смещается вправо за счет использования трехкратного избытка соды и выпадения в осадок карбоната кальция. Затем вольфрамат натрия выщелачивают водой. Образовавшийся раствор подкисляют и осаждают кислоту:
Na2WO4 + 2НСl → H2WO4↓ + 2NaCl.
Выделившийся осадок отфильтровывают и обезвоживают:
H2WO4 → WO3 + Н2O.
Образующийся при этом оксид восстанавливают водородом:
WO3 + 3H2 → W + 3H2O.
Оксид, идущий на производство вольфрама высокой чистоты, предварительно очишают растворением в аммиаке, кристаллизацией паравольфрамата аммония и последующим его разложением.
4.2. Соединения элементов VIВ-группы
4.2.1. Соединения с кислородом
Соединения хрома часто значительно отличаются по свойствам от молибдена и вольфрама, имеющих тенденцию в низших степенях окисления к образованию кластеров, а в высшей степени окисления – изополи- и гетерополианионов.
С ростом степени окисления основные свойства оксидов и гидроксидов постепенно сменяются кислотными, восстановительная способность соединений убывает, а окислительная – возрастает.
Для элементов шестой группы известны бинарные кислородные соединения со степенями окисления +6 (CrO3, МоO3, WO3), +4 (CrO2, МоO2, WO2), +3 (только Сr2O3), а также оксиды со смешанными степенями окисления, образующие гомологические ряды.
Низший оксид состава МеО получен только для хрома. Он представляет собой черный тугоплавкий порошок, не растворимый в воде. Проявляет основные свойства и медленно переходит в раствор под действием кислот:
CrО + 2НСl → CrСl2 + Н2O.
Является сильным восстановителем. При растирании на воздухе или нагревании оксид хрома(II) воспламеняется, сгорая до оксида хрома(III), а при температуре белого каления даже способен отнимать кислород у углекислого газа.
Оксид хрома(III) Cr2O3, или хромовая охра, представляет собой твердый грязно-зеленый тугоплавкий (tпл = 2 275 °С) порошок со структурой корунда (α-Аl2O3).
Мелкий порошок оксида хрома(III) образуется при сжигании тонко раздробленного металла, дегидратации гидроксида, нагревании хромового ангидрида или хлористого хромила CrO2Cl2, сплавлении дихроматов с серой или углем:
К2Cr2O7 + S → Cr2O3 + K2SO4,
82
Na2Cr2O7 + 2С → Cr2O3 + Na2CO3 + СО↑.
Удобным способом получения оксида хрома(III) служит термическое разложение дихромата аммония:
(NH4)2Cr2O7 → Cr2O3 + N2↑ + 4Н2О↑.
Оксид хрома (III) – это самое устойчивое соединение хрома. Он амфотерен, но благодаря высокой энергии кристаллической решетки не реагирует не только с водой, но и с растворами кислот и щелочей. Для перевода его в растворимое состояние без изменения степени окисления используют хлорирование в смеси с углем:
Cr2O3 + 3С + 3Сl2 → 2CrСl3 + 3СО↑,
сплавление с пиросульфатами:
Cr2O3 + 3K2S2O7 → 3K2SO4 + Cr2(SO4)3,
карбонатами или гидроксидами щелочных металлов: Cr2O3 + Na2CO3 → 2NaCrO2 + CO2↑.
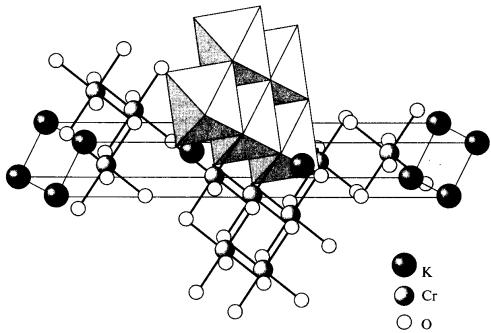
Сплавлением оксида хрома (III) с щелочами, карбонатами или оксидами получают хромиты, или оксохроматы (III), представляющие собой сложные или смешанные оксиды. Хромиты щелочных металлов МСrO2 состоят из октаэдров [СrO6], объединенных общими ребрами в единый каркас, в пустотах которого расположены ионы щелочного металла (рис. 27). Многие хромиты двухвалентных металлов МII(СrO2)2 имеют структуру шпинели. В них атомы М(II) находятся в тетраэдрическом, а атомы Cr(III) – в октаэдрическом окружении атомов кислорода. Такое строение имеет и природный минерал хрома – хромистый железняк FeCr2O4.
Рис. 27. Строение хромита КCrO2 (атомы кислорода расположены в вершинах октаэдров) [1]
83
Диоксиды МeO2 имеют структуру рутила. Они химически инертны по отношению к воде и щелочам, но кислоты-окислители переводят их в соединения высшей степени окисления. Черный оксид хрома(IV) обладает металлической проводимостью и ферромагнитными свойствами. Диоксиды образуются как промежуточные продукты при разложении в отсутствие кислорода или восстановлении соединений M(VI) в мягких условиях:
3(NH4)2Cr2O7 → 6CrO2 + 2N2 + 9Н2O + 2NH3,
МоO3 + Н2 → МоO2 + Н2O,
WO3 + H2 → WO2 + Н2O.
Оксид хрома(VI) CrO3, или хромовый ангидрид, по свойствам значительно отличается от высших оксидов молибдена и вольфрама (табл. 11).
Оксид CrO3 представляет собой темно-красные призматические кристаллы, состоящие из тетраэдров [CrO4], связанных вершинами в цепи. При температуре 197 °С вещество плавится, превращаясь в летучую темную жидкость, пары которой окрашены в красный цвет. Термическая устойчивость хромового ангидрида зависит, по-видимому, от способа его получения и чистоты – разложение происходит в интервале 200–550 °С и заканчивается образованием оксида хрома (III):
4CrO3 → 2CrO2O3 + 3O2↑
|
|
|
|
|
Таблица 11 |
|
|
Свойства высших оксидов элементов VIB группы |
|
||||
Оксид |
Окраска |
Gf, |
Структура |
Температура, °С |
Плотность, |
|
кДж/моль |
плавления |
кипения |
г/см3 |
|||
|
|
|
|
|
|
|
CrO3 |
Темно- |
586 |
Ромбическая |
197 |
– |
2,70 |
красная |
||||||
α-МоО3 |
Белая |
-678 |
» |
795 |
1 155 |
4,69 |
α-WO3 |
Желтая |
-774 |
Моноклинная |
1 473 |
1 850-2 000 |
7,28 |
|
|
|
|
|
|
|
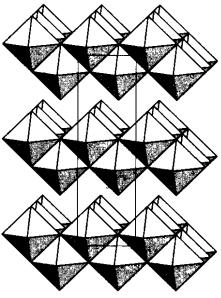
Белые кристаллы высшего оксида молибдена МоO3 имеют слоистую структуру, в которой октаэдры [МоO6], сильно искаженные из-за неравноценности связей Мо–О, соединяются и вершинами, и ребрами (рис. 28). При нагревании вещество желтеет, а при температуре 795 °С плавится, превращаясь в подвижную жидкость.
Оксид вольфрама (VI) WO3 представляет собой желтый кристаллический порошок. Его структура образована октаэдрами [WO6], связанными между собой всеми вершинами. Такой структурный тип получил название «структура типа ReO3» по первому исследованному веществу аналогичного строения. Известны несколько модификаций WO3, в которых атом вольфрама смещен из центра октаэдра, и возникающая деформация ведет к понижению симметрии.
84
Высшие оксиды хрома, молибдена и вольфрама имеют преимущественно кислотный характер, который наиболее ярко выражен в случае оксида хрома (VI). Это вещество прекрасно растворимо в воде (при температуре 20 °С в 100 г раствора растворяется 62,5 г CrO3); водный раствор проявляет кислотные свойства – он со-
держит хромовую Н2CrO4 и двухромо-
вую Н2Cr2O7 кислоты. Хотя ни одна из этих кислот не выделена в свободном виде, их соли – хроматы и дихроматы – хорошо изучены. переходы между ними регулируются изменением кислотности среды. В кислых растворах устойчивы ди-
Рис. 28. Строение оксида MoO3 хроматы, а в щелочных – хроматы. О взаимных превращениях этих солей легко судить по изменению окраски: при подкислении желтого раствора К2CrO4
образуется оранжево-красный дихромат К2Cr2O7.
2К2CrO4 + 2H2SO4 → K2Cr2O7 + 2KHSO4 + Н2O.
Вводе растворимы лишь хроматы и дихроматы щелочных металлов
иаммония, а также магния, кальция и стронция.
Дихромат-ионы, образующиеся при действии кислоты на хроматы, при более сильном подкислении превращаются в трихроматы Cr3О102– и тетрахроматы Cr4O132–, продукты углубляющейся поликонденсации хро- мат-ионов. С катионами щелочных металлов три- и тетрахромат-ионы образуют соли, напоминающие дихроматы и окрашенные в темно-красный цвет. Подобно дихроматам они состоят из тетраэдров [CrO4], соединенных общими вершинами в цепи.
При дальнейшем подкислении процесс поликонденсации протекает еще глубже. Конечным его продуктом является темно-красный осадок гидратированного хромового ангидрида, фактически представляющий собой полихромовую кислоту – длинные цепи из тетраэдров [CrO4], на концах которых находятся гидроксильные группы. При нагревании до 100 °С происходит дегидратация полихромовой кислоты, приводящая к образованию оксида хрома(VI).
В ряду хромат – дихромат – трихромат – тетрахромат температура разложения солей существенно убывает. Так, хромат калия плавится без разложения при температуре 968 °С, дихромат калия плавится при 398 °С и разлагается при 500 °С, а трихромат и тетрахромат калия плавятся с разложением при 243 и 210 °С соответственно:
4К2Cr2O7 → 4К2CrO4 + 2Cr2O3 + 3O2↑, 4К2Cr4O13 → 2К2Cr2O7 + 4КCr(CrO4)2 + 3O2↑.
85
Термическая устойчивость солей возрастает с увеличением размера катиона щелочного металла вследствие роста энергии кристаллической решетки, о чем свидетельствует и понижение растворимости в этом ряду.
Окислительная способность соединений хрома в высшей степени окисления существенно выше, чем соединений молибдена и вольфрама. Хроматы – очень сильные окислители, хотя и уступают перманганатам. Наибольшая окислительная активность хроматов проявляется в кислой среде, где они присутствуют в виде дихромат-ионов.
К2Cr2O7 + 3SO2 + H2SO4 → K2SO4 + Cr2(SO4)3 + H2O
K2Cr2O7+ 3H2S + 4H2SO4 → K2SO4 + Cr2(SO4)3 + 3S↓ + 7H2O K2Cr2O7 + 6FeSO4 + 7H2SO4 → K2SO4 + Cr2(SO4)3 + 3Fe2(SO4)3 + 7H2O
В нейтральной и слабощелочной средах хромат-ионы восстанавливаются до гидроксида хрома(III):
2К2CrO4 + 3(NH4)2S + 8Н2O → 2Cr(OH)3↓ + 3S↓ + 4КОН + 6NH3 · Н2O
в сильнощелочной – до гидроксохроматов(III) [Cr(ОН)6]3–.
Хромовый ангидрид в отличие от триоксидов молибдена и вольфрама является сильным окислителем. Он поджигает этанол
4CrO3 + С2Н5ОН → 2Cr2O3 + 2СO2↑ + 3Н2O,
будучи помещенным на бумагу, иногда вызывает ее воспламенение. Оксиды молибдена и вольфрама растворимы в воде значительно ху-
же. Их кислотный характер проявляется при растворении в щелочах:
2КОН + МeO3 → К2МeO4 + Н2O.
Из растворов оксиды выделяются в форме гидратов. При подкислении растворов молибдатов постепенно образуется желтый кристаллический осадок дигидрата МоO3 · 2Н2O. Он состоит из октаэдров [МоO5(Н2O)], соединенных общими вершинами в слои, между которыми располагаются внешнесферные молекулы воды (рис. 29, а). Строение этого вещества, таким образом, точнее передает формула [МоO3(Н2O)] · Н2O. При нагревании до 80 °С молекулы воды, расположенные между слоями, удаляются, и образуется белый моногидрат (рис. 29, б), который при температуре 150 °С превращается в оксид. Моногидрат кристаллизуется также при подкислении горячих растворов молибдатов.
Вольфрам образует гидраты оксидов, аналогичные молибдену, с той лишь разницей, что дигидрат WO3 · 2Н2O имеет белую окраску, а моногидрат WO3 · H2O – желтую. Водные растворы гидратов молибдена и вольфрама являются амфотерными основаниями, хотя кислотные свойства преобладают. «Молибденовая» и «вольфрамовая» кислоты оказываются гораздо более слабыми, чем хромовая, а молибдаты и вольфраматы в растворах – подверженными гидролизу.
Ослабление кислотных свойств гидроксидов металлов (VI) при движении вниз по группе связано, по-видимому, с усилением ионности связи Мe–О и ростом энергии кристаллической решетки триоксидов.
86
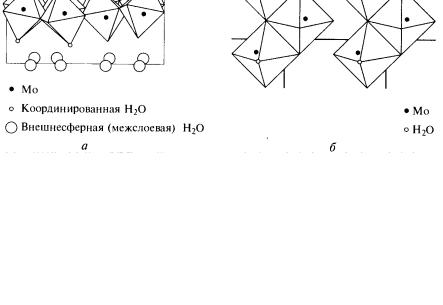
Рис. 29. Строение оксидов: а – МоO3 · 2Н2O; б – МоO3 · Н2O (атомы кислорода расположены в вершинах октаэдров) [1]
При взаимодействии гидратированных оксидов молибдена и вольфрама с щелочами образуются растворы, содержащие различные оксоанионы. В сильнощелочной среде устойчивы тетраэдрические анионы МО42–. Им соответствуют простые молибдаты и вольфраматы, например, Na2MoO4, K2WO4, кристаллизующиеся из водных растворов при рН > 7. При подкислении растворов тетраэдры МО42– перестраиваются в искаженные октаэдры [МO6] и полимеризуются, последовательно превращаясь в различные изополианионы.
При восстановлении растворов молибдатов в кислой среде возникает интенсивное синее окрашивание, названное «молибденовой синью». «Сини» представляют собой нейтральные или анионные гигантские циклические изополисоединения, составленные из октаэдров [МоO6], связанных ребрами и вершинами в замкнутую тороидальную структуру, напоминающую по форме автомобильную шину, например, Мo176O496(Н2O)8(OН)32
(соответствует формуле Мо5O14,5 · 0,7Н2O), Na26[Mo142O4l8(H2O)58(OH)14], Nal4[Mol54O448(H2O)70(OH)l4]. Часть атомов молибдена в них находится в высшей степени окисления, часть восстановлена до +5. Отдельные «коль-
ца» соединены друг с другом в параллельные цепи связями Мо–О–Мо
(рис. 30).
Среди кислородных соединений элементов шестой группы интерес представляют вольфрамовые бронзы, названные так из-за металлического блеска и специфической окраски. Они образуются при восстановлении метавольфрамата натрия водородом при температуре красного каления:
2Na6H2Wl2O40 + 6Н2 = 24Na0,5WO3 + 8Н2O
или при нагревании смеси оксида вольфрама(VI) со щелочным металлом: WO3 + 0,3Na = NaO3WO3.
87
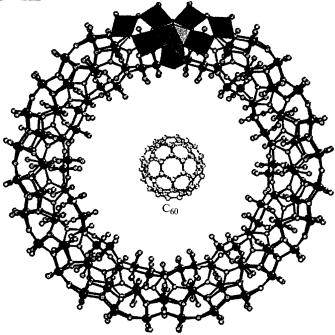
Рис. 30. Строение гетерополианиона молибденовой сини (в центре для сравнения – фуллерен С60) [1]
Состав их в общем виде описывается формулой MexWO3, где Мe – щелочной металл; х < 1; степень окисления вольфрама промежуточная между +5 и +6. Окраска вольфрамовых бронз зависит от содержания щелочного металла: при х – 0,9 они золотисто-желтые; при х – 0,4–0,6 – красные; при 0,26–0,4 – фиолетово-серые. Бронзы с высоким содержанием щелочного металла (х > 0,3) обладают металлической проводимостью и имеют характерный металлический блеск; при более низком содержании металла бронзы являются полупроводниками. Металлические бронзы химически инертны — они не растворимы в воде и не взаимодействуют даже с концентрированными растворами кислот, за исключением плавиковой.
Для молибдена образование бронз не столь характерно. Они менее устойчивы и получены восстановлением молибдатов при высоких (> 60 кбар) давлениях. Взаимодействие оксида молибдена(VI) с дитионитом или боргидридом натрия в этиловом спирте приводит к образованию гидратированных бронз, в которых катионы щелочного металла интеркалированы между слоями в структуре МоO3 (рис. 31):
2МоO3 + xNa2S2O4 + 2nН2O → 2Nax(H2O)nMoO3 +2xSO2↑.
Они представляют собой темно-синие порошки, не растворимые в спирте и ацетоне; при температуре 350–500 °С обезвоживаются, превращаясь в вещества состава МexМоO3. Невысокая стабильность молибденовых бронз по сравнению с вольфрамовыми может быть связана с большей склонностью молибдена (V) к диспропорционированию. Для хрома бронзы не обнаружены.
88
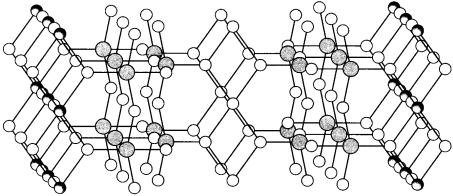
Рис. 31. Строение гидратированной молибденовой бронзы [1]
4.2.2. Соединения с галогенами
Для элементов шестой группы известно большое число соединений с галогенами (табл. 12). По мере роста степени окисления, а также с уменьшением порядкового номера металла возрастает ковалентность связи, а, следовательно, и кислотный характер галогенида.
Дигалогениды. Дигалогениды хрома представляют собой твердые вещества с центральным атомом, расположенным в центре искаженного октаэдра. Синтез этих соединений проводят либо восстановлением безводных тригалогенидов водородом, либо взаимодействием хрома с галогеноводородами при температуре 1000 оС. Иодид (единственный из дигалогенидов) может быть получен прямым синтезом. Все дигалогениды хрома растворимы в воде, где они присутствуют в виде гексаакваионов. Их водные растворы на воздухе мгновенно окисляются, изменяя яркосинюю окраску на грязно-зеленую. Соединения хрома (II) являются сильными восстановителями, в противоположность дигалогенидам молибдена, довольно устойчивым к действию окислителей.
|
|
|
Таблица 12 |
|
Галогениды металлов шестой группы |
||
СО |
CrХn |
MoXn |
WXn |
|
|
|
|
+2 |
CrСl2, CrВr2, CrI2 |
MoCl2, MoBr2, MoI2 |
WCl2, WI2 |
+3 |
CrF3, CrСl3, CrВr3, CrI3 |
MoF3, MoCl3, MoBr3, MoI3 |
WCl3, WBr3, WI3 |
+4 |
CrF4, CrCl4, CrBr4 |
MoF4, MoCl4, MoBr4, MoI4 |
WF4, WCl4, WBr4, WI4 |
+5 |
CrF5 |
MoF5, MoCl5, MoBr5, MoI5 |
WF5, WCl5, WBr5 |
+6 |
CrF6 |
MoF6, MoCl6 |
WF6, WCl6, WBr6 |
Тригалогениды. Наиболее известен хлорид хрома (III) CrСl3, образующийся в виде фиолетовых чешуйчатых кристаллов при хлорировании хрома или смеси его оксида с углем. Это вещество может быть сублимировано в токе хлора при температуре 600 оС, но при нагревании до этой
89
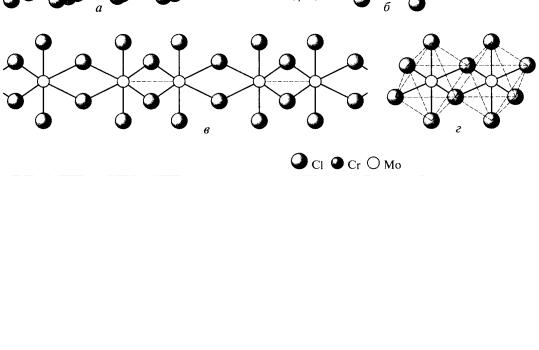
температуры в инертной атмосфере или в вакууме частично разлагается на дихлорид и хлор.
Строение хлорида хрома (III) можно представить как кубическую плотнейшую упаковку из атомов хлора, октаэдрические пустоты в которой на две трети заполнены атомами хрома таким образом, что вакантные пустоты образуют слои, параллельные слоям октаэдров [CrСl6] (рис. 32, а).
Благодаря электронной конфигурации d3 соединения хрома химически инертны. Именно этим объясняется тот факт, что безводные галогениды хрома(III) не растворяются в воде: попав в воду, чешуйки хлорного хрома плавают по ее поверхности, не переходя в раствор.
Рис. 32. Галогениды металлов шестой группы:
а – CrСl3; б – α-МоСl4; в – β-МоСl4; г – МоСl5 [1]
Тетрагалогениды. Из тетрагалогенидов наиболее устойчивы фториды, известные для всех трех элементов. Хлорид и бромид хрома(IV) существуют в газовой фазе в равновесии 2CrГ3 + Г2 ↔ 2CrГ4. В виде индивидуального вещества они не выделены, хотя тетраэдрические молекулы CrСl4 стабилизированы в аргоновой матрице.
Тетрахлорид молибдена МоСl4 – черное нелетучее вещество, разлагающееся при температуре выше 130 °С. Он существует в виде нескольких модификаций. В α-форме имеются линейные цепи октаэдров [МоСl6], объединенные через противоположные ребра и попарно связанные взаимодействием Мо–Мо (рис. 32, б). Сходное строение имеет и тетрахлорид вольфрама, в нем длина наиболее коротких связей W–W (0,269 нм) приближается
90
