
5 и 6 группы
.pdf
образующееся при обезвоживании ортотеллуровой кислоты Н6ТеO6 при 350 °С. Твердый триоксид теллура построен из октаэдров ТеO6, объединенных общими вершинами в цепи. В противоположность SO3 и SeO3 оксид ТеO3 водой практически не гидратируется, но быстро растворяется в щелочах, давая теллураты. Окислительные свойства триоксида теллура выражены гораздо слабее, чем SeO3, – он вытесняет хлор из соляной кислоты только при нагревании.
Высшие оксокислоты халькогенов: серную H2SO4, селеновую H2SeO4 и ортотеллуровую Н6ТеO6 – синтезируют окислением их диоксидов или соответствующих им кислот. Промышленное производство серной кислоты осуществляется контактным способом, в основе которого лежит окисление сернистого газа в серный ангидрид на ванадиевом катализаторе (оксид ванадия(V), промотированный сульфатом калия) с последующим поглощением серного ангидрида концентрированной серной кислотой:
SO2 + ½ O2 → SO3 → H2S2O7 → 2H2SO4.
Селеновую кислоту получают окислением селенистой кислоты концентрированным раствором пероксида водорода:
H2SeO3 + Н2O2(30 %) → H2SeO4 + Н2O.
Теллуровую кислоту синтезируют окислением диоксида:
5ТеO2 + 2КМnO4 + 6HNO3 + 12Н2O → 5Н6ТеO6 + 2KNO3 + 2Mn(NO3)2
или простого вещества сильными окислителями:
5Те + 6НСlO3 + 12Н2O → 5Н6ТеO6 + 3Cl2↑.
В молекуле H2SO4 сера тетраэдрически окружена четырьмя атомами кислорода, два из которых входят в состав гидроксильных групп. Длины связей в молекуле H2SO4 таковы, что связи S–О можно считать двойными, а связи S–ОН – одинарными. Бесцветные, похожие на лед кристаллы H2SO4 имеют слоистую структуру: каждая молекула H2SO4 соединена с четырьмя соседними молекулами прочными водородными связями, образуя единый пространственный каркас (рис. 23). Структура жидкой H2SO4 такая же, как твердой, только целостность пространственного каркаса нарушена, и его можно представить как совокупность микрокристалликов, постоянно меняющих свою форму.
Рис. 23. Строение твердой серной кислоты [1]
71
Серная кислота смешивается с водой в любых соотношениях, процесс сопровождается образованием различных гидратов H2SO4 · nН2O. Теплота гидратации настолько велика (приблизительно 880 кДж/моль), что смесь может даже вскипеть, разбрызгаться и вызвать ожоги кожи и разрушение одежды. Высокое сродство серной кислоты к воде позволяет использовать ее как водоотнимающее средство.
По структурным особенностям и аномалиям жидкая H2SO4 похожа на воду. Здесь та же система сильных водородных связей, что и в воде, почти такой же прочный пространственный каркас, такие же аномально высокие вязкость, поверхностное натяжение (24,740 ·10-3 Па · с), температуры плавления (10,31 о С) и кипения (279,6 оС).
Безводная H2SeO4 – бесцветное неустойчивое кристаллическое вещество, построенное из слоев искаженных тетраэдров SeO4 и плавящееся при 57 °С с разложением:
2H2SeO4 → 2H2SeO3 + O2↑.
H2SO4 и H2SeO4 – сильные двухосновные кислоты. Они близки по структуре и свойствам. Их соли – сульфаты и селенаты – изоморфны и образуют квасцы состава МIАl(ЭO4)3 · 12Н2O, где МI – щелочной металл;
Э = S, Se.
Ортотеллуровая кислота Н6ТеO6 – бесцветное гигроскопичное вещество (tпл = 136 °С), хорошо растворимое в воде (19,7 г в 100 г воды при температуре 0 °С). Ее структура отличается от структуры H2SO4 и H2SeO4 и построена из правильных октаэдров ТеO6, сохраняющихся и в растворах. Такое строение обусловливает отличие свойств Н6ТеО6 от свойств H2SO4 и H2SeO4. Отсутствие концевых атомов кислорода, которые могли бы оттягивать электронную плотность от атома Те и поляризовать связь Н–О, объясняет тот факт, что Н6ТеO6 слабее даже угольной кислоты. Раствором щелочи Н6ТеO6 титруется как двухосновная с образованием солей МIТеО(ОН)5 и МI2ТеO2(OН)4. Окислением расплавов теллуритов металлов кислородом или KNO3 получены теллураты МI6ТеO6, МI4ТеO5 и МI2ТеO4, имеющие сложную полимерную структуру. Теллураты не изоморфны с сульфатами и селенатами.
Селеновая кислота выделяет хлор из концентрированной НСl:
H2SeO4 + 2НСl → Cl2↑ + H2SeO3 + H2O.
Растворяет без нагревания медь и даже золото:
2Au + 6H2SeO4 → Au2(SeO4)3 + 3H2SeO3 + 3H2O,
окисляет ионы галогенидов (кроме фторида) до свободных галогенов, бурно реагирует с органическими веществами (воспламеняет целлюлозу). В сходных условиях ортотеллуровая кислота по окислительной способности также превосходит серную, хотя и существенно уступает селеновой. Селен и теллур, входящие в состав H2SeO4 и Н6ТеO6, чаще всего восстанавливаются до простых веществ.
72
Серная кислота обладает сильными окислительными свойствами только в концентрированном растворе и при нагревании:
2H2SO4(конц) + Cu → CuSO4 + SO2↑ + 2H2O.
С серной кислотой реагируют многие простые вещества – металлы и неметаллы. На холоде H2SO4 инертна по отношению к таким металлам, как железо, алюминий и даже барий. Продуктами ее восстановления в зависимости от условий проведения реакций (природы металла, температуры, концентрации) могут быть SO2, H2S, S, политионаты.
Помимо H2SO3 и H2SO4 сера образует ряд других кислородсодержащих кислот. При дегидратации H2SO4 или при насыщении водного раствора серной кислоты серным ангидридом два тетраэдра SO4 связываются общим атомом кислорода в вершине тетраэдра в дисерную (пиросерную) кислоту H2S2O7
H2SO4 + SO3 → H2S2O7.
При замещении одного концевого атома кислорода на атом серы можно получить тиосерную кислоту. В присутствии воды распадается, поэтому выделить её из водных растворов невозможно. Получают
взаимодействием безводных сероводорода и хлорсульфоновой кислоты при –78 оС:
HSO3Cl + H2S → H2S2O3 + НCl.
При замещении мостикового кислорода в дисерной кислоте на один атом серы или на цепочку атомов серы возникают дитионовая H2S2O, тритионовая и другие политионовые кислоты H2SnO6 (n = 3 – 22). Соли (дитионаты) синтезируют окислением водных растворов SO2 суспензиями порошков оксидов марганца MnO2 или железа Fe2O3:
2SO2 + MnO2 → MnS2O6
При n > 3 в политионовых кислотах H2SnO6 появляются сульфидные мостики, состоящие из атомов серы в отрицательной степени окисления
(K2S3O6, K2S4O6, K2S5O6, K2S6O6). Политионаты можно получить взаимодействием тиосульфатов с хлоридами серы, например:
2Na2S2O3 + SC12 → Na2S5O6 + 2NaCl
Удобным методом синтеза тритионатов является взаимодействие тиосульфата с 30%-м раствором пероксида водорода:
2Na2S2O3 + 4Н2O2 → Na2S3O6 + Na2SO4 + 4Н2O.
При нагревании политионаты разлагаются на сульфат, сернистый газ и (если n > 3) серу. При замене мостикового кислорода дисерной кислоты на пероксидную группу –О–О– образуется пероксодисерная кислота H2S2О8, ее синтезируют электролизом водного раствора серной кислоты:
2H2SO4 → H2S2O8 + Н2↑,
а ее соли – пероксодисульфаты (персульфаты) – анодным окислением сульфатов:
2KHSO4 → K2S2O8 + H2↑.
73
Ион S2O82- построен из двух тетраэдров SO4, соединенных между собой пероксидной группой –О–О–.
Соли пероксодисерной кислоты — сильнейшие окислители:
S2O82- + 2e- + 2Н+ → 2HSO4-, Е° = 2,12 В, S2O82- + 2e- → 2SO42-, Е° = 2,01 В.
Ион S2O82- в присутствии катализатора (Ag+) окисляет ион Mn2+ в перманганат:
5K2S2O8 + 2MnSO4 + 8Н2O → 2KMnO4 + 8H2SO4 + 4K2SO4.
Галогенсульфоновые кислоты HSO3X можно рассматривать как продукт замещения гидроксильной группы серной кислоты на атом галогена (X = F, С1, Вг). Их синтезируют взаимодействием галогеноводорода с жидким SO3. Устойчивость HSO3X понижается в ряду F > С1 > Br. Иодсульфоновая кислота неизвестна.
3.2.3. Галогениды
Фториды кислорода
Кислород образует несколько бинарных фторидов, из которых наиболее устойчив OF2. В настоящее время его получают реакцией газообразного F2 с 2%-мводным раствором NaOH:
2F2 + 2NaOH → OF2 + 2NaF + H2O.
Условия процесса необходимо контролировать, чтобы сделать
минимальными потери продукта из-за вторичной реакции: OF2 + 2OН– → O2 + 2F + Н2O.
Фторид кислорода − бесцветный газ с очень сильным неприятным запахом, который конденсируется в светло-желтую жидкость (–223,8 °С, –145,3 °С). В чистом виде он устойчив до 200 °С в стеклянных сосудах, но выше этой температуры разлагается по радикальному механизму на фтор и кислород.
Дифторид кислорода OF2 сильный окислитель и фторирующий агент, хотя и уступающий в этом отношении F2. Многие металлы, реагируя с ним, дают оксиды и фториды, фосфор превращается в PF5 И POF3, сера − в SO2 и SF4, а ксенон дает XeF4 и оксофториды; H2O в смеси с OF2 взрывопасна
OF2 + H2O → 2HF + O2
Формально OF2 является ангидридом фторноватистой кислоты HOF, но он не реагирует с водой с образованием такого соединения. Действительно, HOF пытались получить в течение многих десятилетий, но лишь относительно недавно это соединение удалось синтезировать и изучить. Первыми идентифицировали HOF в 1968 г. П. Нобл и Дж. Пиментел; они использовали метод матричной изоляции: смесь F2 и Н2O замораживали в твердом азоте и подвергали фотолизу при 14–20 К:
74
F2 + Н2O ↔ HOF + HF.
Дифторид дикислорода O2F2 лучше всего получать пропусканием тихого электрического разряда через смесь газообразных F2 и O2 при низком давлении; состав продуктов сильно зависит от условий процесса, максимальный выход O2F2 достигается при использовании смеси газов в соотношении 1:1, давлении 7–17 мм рт. ст., силе тока 25–30 мА и напряжении 2,1–2,4 кВ. O2F2 − вещество желтого цвета как в твердом, так и в жидком состоянии (–154 °С, –57 °С). Он значительно менее устойчив, чем OF2, и даже при –160 °С разлагается со скоростью 4 % в сутки. Разложение по радикальному механизму при температуре выше –100 °С идет быстро. По строению молекула O2F2 напоминает Н2O2, но расстояние О–О значительно меньше (ср. с 0,1207 нм для O2(г)). Напротив, расстояние O–F необычно велико по сравнению с OF2 И HOF. Эти особенности коррелируют с энергиями диссоциации:
D( FO–OF) = 430 кДж · моль–1,
D(F–OOF) ≈ 75 кДж · моль–1.
Дифторид дикислорода, разумеется, очень сильный окислитель и фторирующий реагент даже при очень низких температурах (–150 °С). Он превращает ClF в ClF3, BrF3 в BrF5, SF4 в SF6; те же продукты получаются из НС1, НВг и H2S, например:
H2S + 4O2F2 → SF6 + 2HF + 4O2.
Рис. 24. Сравнение геометрических параметров молекул различных газообразных соединений со связями O-F и О-Н
Галогениды S, Se, Te
Все галогениды можно разделить на несколько групп: низшие (например, SnC12 и SnBr2 (n = 3 – 8), Те3С12, Те2Br), дигалогениды (ЭХ2), тетрагалогениды (ЭХ4) и высшие (ЭF6). С увеличением размера атома
75
галогена прочность химических связей сера–галоген понижается от F к I, поэтому бинарные иодиды серы и селена не образуются.
Низшие галогениды халькогенов синтезируют взаимодействием простых веществ в требуемых соотношениях:
2Те + ½Вr2 → Те2Вr,
восстановлением высших галогенидов самими халькогенами: SeX4 + 3Se → 2Se2X2 (X = Cl, Br).
Цепи атомов серы в дихлор- и дибромсульфанах стабилизированы концевыми связями S–Сl и S–Вr. Первые восемь членов семейства SnC12 выделены в индивидуальном виде. Это желтые или красные вязкие жидкости с раздражающим запахом, дымящие на воздухе, термически неустойчивые, разлагающиеся водой. В смесях присутствуют соединения
вплоть до S100Cl2. Из них наиболее известен хлорид S2Cl2 (tпл = 82 °С, tкип = = 137 °С (с разложением)), используемый в качестве вулканизатора
резины и хлорирующего реагента при переработке некоторых минералов. При его гидролизе образуются сероводород, НСl и сернистый газ, а также некоторое количество политионовых кислот и серы.
Водород восстанавливает пары S2Cl2 до серы:
S2Cl2 + Н2 → 2S + 2НСl.
Наиболее многочисленны тетрагалогениды, их синтезируют галогенированием простых веществ или оксидов:
ЭO2 + 2Х2 + 2С → ЭХ4 + 2CO↑.
Тетрафториды SF4 (tкип = –38 °С), SeF4 (tпл = –10 °С) и TeF4 (tпл = –129 °С)
получают контролируемым фторированием простых веществ или низших галогенидовфтором, фторидамиидругимифторирующимиагентами:
3SCl2 + 4NaF → SF4 + S2Cl2 + 4NaCl,
SF4 + SeO2 → SeF4 + SO2.
Тетрафторид SF4 – бесцветный ядовитый газ, хорошо растворимый в бензоле, но мгновенно разлагающийся водой до HF и SO2. Он проявляет свойства акцептора и донора электронной пары, т. е. является как кислотой, так и основанием Льюиса. Это вещество используется в качестве фторирующего агента при получении неорганических и органических фторидов:
4ВСl3 + 3SF4 → 4BF3 + 3SCl2 + ЗСl2.
Тетрафториды селена и теллура имеют полимерное строение. Они также используются как фторирующие агенты, причем TeF4 действует намного эффективнее: он легко фторирует SiO2 и взаимодействует с Cu, Ag, Au, Ni, образуя фториды и теллуриды металлов. Остальные галогениды по строению и свойствам сильно отличаются от фторидов.
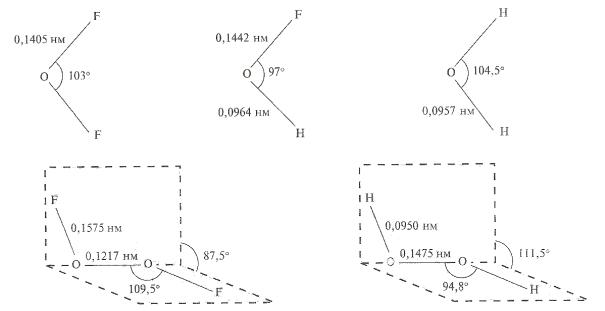
Твердые тетрагалогениды селена и теллура являются тетрамерами Э4Х16. Они имеют структуру куба, в углах которого чередуются атомы халькогена и галогена (рис. 25).
76
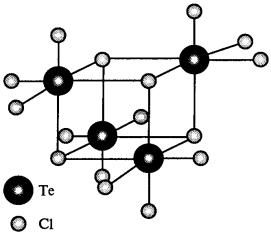
Рис. 25. Строение TeCl4 [1]
Все тетрагалогениды сравнительно легко гидролизуются до соответствующих кислот:
SeCl4 + 3Н2O → H2SeO3 + 4НСl
и взаимодействуют с галогенидами металлов с образованием комплексных соединений:
TeF4 + 2KF → K2[TeF6].
Геометрическая форма комплексных ионов [SeCl6]2– и [TeF6]2– соответствует правильному октаэдру.
Для халькогенов в высшей степени окисления известны гексафториды SF6, SeF6 и TeF6 и смешанные галогениды SClF5, SBrF5, TeClF5 и TeBrF5. Высший фторид серы SF6 отличается устойчивостью и химиической инертностью. Это газ без запаха и вкуса, не гидролизуется водой. Он не горит и не поддерживает горение, выдерживает нагревание до температуры 500 °С, не взаимодействует с большинством металлов и неметаллов даже при нагревании. С кипящим натрием SF6 взаимодействует по уравнению
SF6 + 8Na → Na2S + 6NaF.
Высокая устойчивость SF6 по сравнению с другими фторидами обусловлена кинетическими факторами. Шесть атомов фтора экранируют атом серы и мешают приближению возможных атакующих групп.
3.2.4. Соединения с металлами
Для получения халькогенидов металлов используют прямое взаимодействие простых веществ при нагревании в инертной атмосфере:
Fe + S → FeS,
действие газообразного сероводорода на металлы:
2Аl + 3H2S → Al2S3 + 3Н2,
восстановление твердых солей оксокислот: BaSO4 + 4C → BaS + 4CO↑,
77
SrSeO3 + 2NH3 → SrSe + N2 +
+3H2O,
Вводе хорошо растворимы
лишь сульфиды щелочных металлов, аммония и бария. Их водные растворы вследствие гидролиза имеют щелочную реакцию.
Ионные халькогениды щелочных металлов имеют структуру типа антифлюо-рита Me2S (М = Li, Na, К, Rb, Cs), где каж-
дый атом S окружен кубом из 8 атомов Мe и каждый атом Мe – тетраэдром из 4 атомов S, а халь-
когениды MeS (Мe = Mg, Са, Sr,
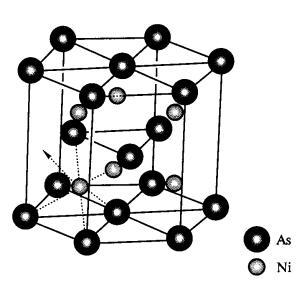
Ва, Mn, РЬ, лантаниды) – структуру типа NaCl, где каждый атом Мe или S окружен октаэдром из атомов другого сорта. При усилении ковалент-ного ха-рактера связи металл-халь-коген в сульфидах MS реалиизуются структуры с меньшими коорди-национными числами. Для большинства монохалькогенидов (например, FeS, TiS) характерна структура типа NiAs, в которой каждый атом халькогена окружен тригональной призмой из шести атомов Мe, а окружение каждого атома Мe состоит из 8 (6 + 2) атомов халькогенов (рис. 26). Структура многих дихалькогенидов MeS2 (Мe = Mn, Fe, Со, Ni, Ru) построена в виде трехмерного каркаса из атомов Мe и дискретных ионов S, имеющих форму «гантелей» (структурные типы пирита и марказита).
Сульфиды (особенно, растворимые в воде) являются сильными восстановителями:
2КМnO4 + 3K2S + 4Н2O = 3S↓ + 2MnO2↓ + 8КОН.
Сульфиды щелочных и щелочно-земельных металлов при нагревании на воздухе превращаются в сульфаты.
3.3. Применение элементов VIA-группы и их соединений
Кислород используется в процессе выплавки стали, для повышения выхода железа в доменном процессе, а также для производства стекла; для резки стали, газокислородной сварки и резки «кислородным копьём» (сверление бетона). В химической промышленности кислород в больших количествах применяется для синтеза TiO2, для прямого окисления этилена до этиленоксида, в производстве синтез-газа, пропиленоксида, винилхлорида, винилацетата и т.д. Экологическое и биомедицинское применения – обработка сточных вод, возрождение рек, отбеливание бумажной массы, рыборазведение, создание искусственной атмосферы при погружении в воду и работе подводных аппаратов, кислородные боксы в клиниках и т.д. Большое количество жидкого кислорода расходуется в каче-
78
стве окислителя ракетного топлива при запуске космических аппаратов, спутников Земли и космических кораблей многоразового использования.
Сера применяется для вулканизации резины, входит в состав инсектицидов, фунгицидов, лекарств. Диоксид серы – хладагент, неводный растворитель, отбеливатель, исходное вещество для получения сернистой кислоты и триоксида серы; применяют при производстве бумаги, сахара.
Серная кислота – важнейший продукт химической промышленности, используется в производстве удобрений, очистке нефти, в производстве красоке, для травления стали и т.д.
Сульфиты в основном потребляет целлюлозно-бумажная промышленность, другие области применения – удаление примеси кислорода при обработке воды для котлов, восстановитель в фотографии. SF6 используется в качестве газообразного изолятора для высоковольтных генераторов и переключателей, S2Cl2 – для парофазной вулканизации некоторых видов резины, в качестве хлорирующего агента при получении моно- и дихлоргидринов, а также для вскрытия некоторых минералов в гидрометаллургии. OSF2 – удобный низкотемпературный фторирующий агент в органической химии, OSCl2 – реагент для введения хлора в органические соединения.
Селен используется в производстве окрашенных стекол; сульфоселениды кадмия – термостойкие красные пигменты в пластмассах, красках, чернилах и эмалях. Другое важное применение – ксерография. На основе селена делают фотоэлементы и выпрямители в полупроводниковых устройствах. Ферроселен применяется для улучшения качества литья, ковкости и способности к обработке нержавеющих сталей.
Теллур находит применение в производстве железа и стали, а также цветных металлов и сплавов, 25 % его расходуется на получение химических реактивов. TeO2 – для тонирования стекол, соединения теллура – как катализаторы и реагенты вулканизации в резиновой промышленности.
Полоний является почти чистым α-излучателем, он удобный и лёгкий источник тепла или термоэлектрической энергии для космических спутников и лунных станций, не включающий никаких движущих частей. Ограниченное применение находит в качестве генератора нейтронов.
ГЛАВА 4. VIВ-ГРУППА
4.1. Простые вещества
Хром, молибден и вольфрам – светло-серые твердые металлы, имеющие объемно-центрированную кубическую структуру (ОЦК). В ряду Cr – Mo – W наблюдается рост плотности (вольфрам принадлежит к числу самых тяжелых и высокоплавких металлов), энтальпий атомизации, температур плавления и кипения и энтальпий фазовых переходов (см. табл. 10). Все металлы парамагнитны, хорошо проводят электрический ток, отличаются высокой твердостью, царапают стекло. На их механические свойства сильно
79

влияет наличие примесей. Чистые металлы пластичные, а содержащие даже небольшую долю примесей азота и кислорода – хрупкие и ломкие. Хром технической чистоты легко раскалывается и растирается в порошок.
Свойства простых веществ VI-B группы |
Таблица 10 |
||
|
|||
Свойство |
Cr |
Мо |
W |
|
|
|
|
Температура плавления, °С |
1 860 |
2 620 |
3410 |
Температура кипения, °С |
2 680 |
4 630 |
5 700 |
Энтальпия плавления, кДж/моль |
15,3 |
27,6 |
35,2 |
Энтальпия испарения, кДж/моль |
348,8 |
594,1 |
799,1 |
Энтальпия атомизации, кДж/моль |
396,6 |
658,1 |
849,4 |
Кристаллическая структура |
ОЦК |
ОЦК |
ОЦК |
Плотность, г/см3 (20 °С) |
7,23 |
10,22 |
19,30 |
Стандартный электродный потенциал |
–0,74 |
–0,20 |
–0,11 |
E0(М3+/М0), В |
|||
4.1.1. Химические свойства
При умеренных температурах все три металла устойчивы на воздухе. На воздухе хромированные изделия не тускнеют, так как тонкая и прозрачная пленка оксида надежно защищает их от окисления. С кислотамиокислителями – концентрированной серной и азотной – при комнатной температуре хром не взаимодействует, не растворяется в царской водке, очень чистый хром не реагирует даже с разбавленной серной кислотой, хотя причина этого до сих пор не установлена. При выдерживании в концентрированной азотной кислоте хром пассивируется, т.е. утрачивает способность взаимодействовать с разбавленными кислотами.
Несмотря на то, что молибден и вольфрам в ряду напряжений стоят левее водорода, они подобно другим тяжелым переходным металлам не взаимодействуют с кислотами-неокислителями. Однако смесь концентрированных азотной и плавиковой кислот переводит их в раствор, например:
W+ 8HF + 2HNO3 → H2WF8 + 2NO↑ + 4Н2O
Вотличие от вольфрама молибден хорошо растворим и в горячих
концентрированных растворах азотной или серной кислоты, а также в царской водке.
При нагревании металлы шестой группы вступают в реакции с неметаллами, при этом сохраняется общая тенденция: в большинстве случаев молибден и вольфрам окисляются до степени окисления +6, хром – до +3.
4.1.2. Нахождение в природе и получение
Из элементов VI-B группы наиболее распространен в природе хром. Его содержание в земной коре составляет 0,012 мас. %. Молибден и вольфрам (3 · 10-4 мас. % и 1 · 10-4 мас. % соответственно) относятся к редким и рассеянным металлам.
80
