
5 и 6 группы
.pdfМИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «ВОРОНЕЖСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
ХИМИЯ ЭЛЕМЕНТОВ V И VI ГРУПП ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
Учебное пособие для вузов
Составители: И.Я. Миттова, Е.В. Томина, Б.В. Сладкопевцев
Издательско-полиграфический центр Воронежского государственного университета
2012
1
Утверждено научно-методическим советом химического факультета 20 декабря 2011 г., протокол № 10
Рецензент д-р хим. наук, профессор В.Н. Семенов
Учебное пособие подготовлено на кафедре материаловедения и индустрии наносистем химического факультета Воронежского государственного университета.
Рекомендуется для студентов I курса химического факультета дневного отделения.
Для направлений: 020300 – Химия, физика и механика материалов, 020100 – Химия
2
ПРЕДИСЛОВИЕ
Данное учебное пособие является продолжением первых двух частей, в которых были рассмотрены Периодический закон как основа неорганической химии и химия элементов I–IV групп Периодической системы. В третьей части рассматривается химия элементов V и VI групп Периодической системы химических элементов Д.И. Менделеева.
Пособие призвано помочь студенту-первокурснику в изучении курса «Неорганическая химия», по сути дела являясь конспектом лекционного курса, где отображены все основные ключевые моменты, которые необходимо учесть при изучении курса.
Являясь продолжением цикла пособий по курсу «Неорганическая химия», данное издание в целом сохраняет структуру и последовательность изложения материала. Описание начинается с общей характеристики группы, рассмотрения электронного строения атомов, возможных степеней окисления, общих закономерностей и особенностей свойств элементов группы. Далее следует общая характеристика простых веществ, распространённости, способов получения и химических свойств, в отдельных подразделах рассматриваются свойства соединений элементов группы. Отдельное внимание уделено применению химических элементов и их соединений в качестве разнообразных современных материалов.
Для реализации принципа наглядности в пособии приведено большое количество иллюстративного материала и таблиц, которые позволяют в компактном виде представить обширные объёмы материала и отразить основные закономерности в изменении свойств химических элементов и их соединений.
При написании использованы современные литературные источники, список которых приведён в конце пособия. Иллюстративный материал большей частью взят из учебников «Неорганическая химия» и «Химия элементов. Для иллюстрации структур некоторых веществ были использованы Интернет-ресурсы (например, ресурс www.3dchem.com).
Настоящее пособие в первую очередь предназначено для студентов первого курса химического факультета, однако, оно может быть полезным и для студентов старших курсов, в частности для магистрантов, изучающих курсы «Современная неорганическая химия» и «Современные проблемы неорганической химии» для актуализации полученных ранее знаний.
3
V ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
ГЛАВА 1. VA-ГРУППА
В состав VА-группы ПС входят азот 7N (Nitrogenium), фосфор
15P(Phosphorus), мышьяк 33As (Arsenicum), сурьма 51Sb (Stibium) и висмут
83Bi (Bismuthum). Для них предложено название – пниктогены. N и P – эле- менты-неметаллы, As и Sb сочетают неметаллические и металлические свойства, а Bi – металл.
В основном состоянии атомы имеют электронную конфигурацию ns2np3 с тремя неспаренными р-электронами. As, Sb и Bi – полные электронные аналоги (одинаковая электронная конфигурация внешнего n слоя и предыдущей (n–1)d оболочки). Р, As, Sb и проявляют валентности III (в основном состоянии) и V (в валентно-возбуждённом состояниях). Благодаря ns2-электронной паре и вакантному nd-подуровню валентность элементов может быть также IV и VI.
Атом азота из-за отсутствия вакантного 3d-подуровня может образовывать не более четырёх ковалентных связей, в том числе одну по донор- но-акцепторному механизму, образуя гибридные sp3-, sp2- и sp-орбитали с высокой электронной плотностью.
Основные свойства элементов VА-группы представлены в таблице 1.
|
Свойства элементов VA группы [1] |
Таблица 1 |
||||
|
|
|||||
Свойство |
N |
P |
As |
Sb |
Bi |
|
Заряд ядра Z |
7 |
15 |
33 |
51 |
83 |
|
|
|
|
|
|
|
|
Электроннаякон- |
[He]2s22p3 |
[Ne]3s2 3p3 |
[Ar]3d104s2 4p3 |
[Kr]4d105s25p3 |
[Xe]4f145d10 |
|
фигурациявос- |
|
|
|
|
6s26p3 |
|
новномсостоянии |
|
|
|
|
|
|
Энергия |
|
|
|
|
|
|
ионизации, |
|
|
|
|
|
|
кДж/моль: |
|
|
|
|
|
|
I1 |
1402 |
1012 |
947 |
834 |
702 |
|
I2 |
2856 |
1903 |
1798 |
1595 |
1610 |
|
I3 |
4577 |
2910 |
2736 |
2443 |
2466 |
|
I1+I2+I3 |
8835 |
5825 |
5481 |
4872 |
4779 |
|
I4+I5 |
16920 |
11220 |
10880 |
9636 |
9776 |
|
Энергия сродства |
|
|
|
|
|
|
к электрону, |
–7 |
44 |
78 |
101 |
91 |
|
кДж/моль |
|
|
|
|
|
|
Электроотрица- |
|
|
|
|
|
|
тельность: |
|
|
|
|
|
|
По Полингу |
3,01 |
2,1 |
2,0 |
1,9 |
1,9 |
|
По Оллреду- |
|
|
|
|
|
|
Рохову |
3,1 |
2,1 |
2,2 |
1,8 |
1,7 |
|
Ковалентный |
0,7 |
1,1 |
1,2 |
1,4 |
1,5 |
|
радиус, нм |
||||||
|
|
|
|
|
||
Ионный радиус |
|
|
|
|
|
|
(для КЧ 6), нм |
|
|
|
|
|
|
Э3+ |
0,16 |
0,44 |
0,58 |
0,76 |
1,03 |
|
Э5+ |
0,13 |
0,38 |
0,46 |
0,60 |
0,76 |
|
4
1.1. Простые вещества
1.1.1. Физические свойства
Азот (диазот) N2 – бесцветный газ (tкип = −195,8 °С, tпл. = −210 °С), без запаха и вкуса, малорастворимый в воде (23 мл в 1 л холодной воды). Как
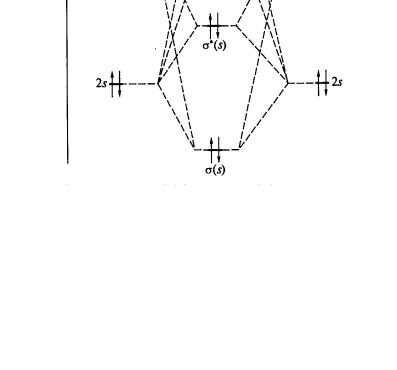
видно из рис. 1, кратность связи в молекуле N2 равна (6–2)/2=3. Энтальпия тройной связи составляет −940,5 кДж/моль. Это одна из самых прочных молекул. Жидкий и твёрдый азот также построен из молекул N2, связанных силами Ван-дер-Ваальса.
Рис. 1. Энергетическая диаграмма молекулярных орбиталей молекулы N2 [1]
Наличие вакантных π-разрыхляющих орбиталей определяет π- акцепторную способность азота, проявляющуюся в образовании комплекс-
ных соединений, например, [Ru(N2)(NH3)5]2+, [Ru2(μ-N2)(NH3)10]4+. В этих комплексах молекула N2 является лигандом. Неподелённая пара электронов азота образует донорно-акцепторную σ-связь, а заполненные d-орбитали иона металла участвуют в образовании π-дативной связи с вовлечением π- разрыхляющих орбиталей молекулы азота. Таким образом, кратность связи металла с N2 может быть равной 2 и даже 3.
Фосфор существует в виде нескольких аллотропных модификаций, из них важнейшие – белый, красный и чёрный фосфор.
Белый фосфор − воскоподобное вещество (tпл. = 44 °С) с чесночным запахом, нерастворимое в воде, но хорошо растворимое в CS2. Молекулы белого фосфора Р4 представляют собой тетраэдры с атомами фосфора в
5
вершинах и валентными углами Р–Р–Р, равными 60° (рис. 2). Валентный угол 60° можно объяснить образованием изогнутых связей, что должно приводить к уменьшению перекрывания р-орбиталей и, следовательно, к уменьшению энергии связывания. По этой причине молекула фосфора Р4 очень реакционноспособна. Белый фосфор легко реагирует с кислородом воздуха (самовоспламеняется):
Р4 + 3О2 = Р4О6, Р4 + 5О2 = Р4О10.
Белый фосфор очень токсичен, имеет высокую склонность при освещении или нагревании переходить в более стабильные полимерные модификации.
Красный фосфор образуется при нагревании белого до температуры
320 °С в инертной атмосфере ( Н°обр = −16,7 кДж/моль). Это твёрдое вещество (tпл. = 600 °С) красного или фиолетового цвета, нерастворимое в
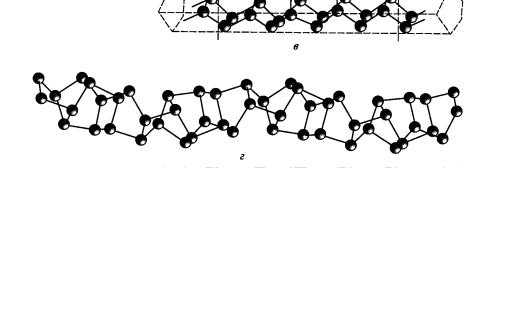
CS2, но растворимое в расплавленном свинце или висмуте. Цвет модификации определяется величиной кристаллов. Отдельные кристаллы красного фосфора состоят из циклических группировок Р8 и Р9, которые связаны мостиками −Р−Р− в трубки. Валентные углы между атомами фосфора равны примерно 100°. Такая полимерная структура красного фосфора приводит к повышению его температуры плавления, к снижению растворимости и реакционной способности по сравнению с белым фосфором.
Рис. 2. Строение белого (а) и красного фосфора: расположение трубок (б)
истроение одной из трубок (в); фрагмент структуры красного фосфора
вфосфиде (CuI)3P12 (г) [1]
6
Фиолетовый фосфор, или фосфор Гитторфа (моноклинная моди-
фикация) образуется при медленном охлаждении Рбел в расплаве свинца (с последующим электрохимическим удалением свинца) или висмута. Установлено, что Рфиол – клеточные фрагменты Р9 и Р8, связанные между собой в очень сложную трехмерную структуру.
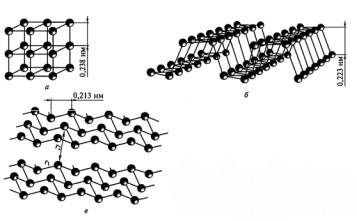
Черный фосфор образуется при нагревании красного фосфора в присутствии катализатора (Hg) или давлении 12 000 атм. Чёрный фосфор термодинамически устойчив при обычных условиях и существует в виде нескольких кристаллических модификаций (кубическая, ромбическая и гексагональная) (рис. 3). Например, структура гексагональной модификации похожа на слоистую структуру графита, с той разницей, что слои не плоские, а гофрированные. Более упорядоченная структура черного фосфора определяет его низкую химическую активность в сравнении с красным фосфором. При температуре 570 °С чёрный фосфор превращается в красный.
Рис. 3. Полиморфные модификации черного фосфора: а – кубическая, б – ромбическая, в – гексагональная [1]
При нагревании красного и чёрного фосфора без доступа воздуха образуется пар, состоящий из молекул Р4, которые при температурах выше 1200 °С диссоциируют на двухатомные молекулы Р2:
Р4 (газ) 2Р2 (газ); Н° = 229 кДж.
При охлаждении пар конденсируется в виде белого фосфора.
У мышьяка и сурьмы имеются «неметаллические модификации» – «жёлтый мышьяк» и «жёлтая сурьма», которые по строению подобны белому фосфору и состоят из молекул As4 и Sb4. Эти модификации неустойчивы и самопроизвольно превращаются соответственно в «серый мышьяк» и «серую сурьму», которые обладают металлическим блеском и электропроводностью. Слоистая структура, аналогичная чёрному фосфору, придаёт им значительную хрупкость. У висмута существуют только металлические модификации. В обычных условиях висмут − хрупкий, с
7
красноватым оттенком металл. При температурах выше 120 °С висмут приобретает ковкость и пластичность.
1.1.2. Нахождение в природе и получение
Основная масса азота в природе находится в земной атмосфере (78 об. %) в виде простого вещества N2. В связанном виде азот входит в состав белков всех растительных и животных организмов. Редко встречаются минералы азота: чилийская селитра − NaNO3 и индийская селитра − KNO3, которые имеют биогенное происхождение. Содержание азота в земной коре – 2,5 · 10-3 мас. %.
Содержание фосфора в земной коре составляет 0,1 мас. %, в свободном состоянии в природе не встречается. Основные минералы фосфора: фосфорит − Ca3(PO4)2 и апатиты − Ca5(PO4)3X, где Х = F , Cl, OH. Фосфор входит в состав животных организмов и составляет минеральную часть костных тканей, а его органические производные участвуют в процессах обмена веществ и накопления энергии.
Мышьяк (1,5 · 10-4 мас. %), сурьма (2 · 10-5 мас. %.) и висмут (5 · 10-6 мас. %) в природе находятся в виде сульфидных минералов: As2S3 – аурипигмент, As4S4 – реальгар, Sb2S3 – антимонит (сурьмяный блеск), Bi2S3 – висмутовый блеск, FeAsS – арсенопирит и др. Крайне редко эти элементы встречаются в самородном виде.
В промышленности азот получают фракционной перегонкой жидкого воздуха, а в лаборатории по следующим реакциям:
NH4NO2 = N2 + 2H2O,
NaNO2 + NH4Cl = N2 + NaCl + 2H2O.
Особо чистый азот получают разложением азида натрия или лития при 275 °C:
2NaN3 = 2Na + 3N2.
Другие способы получения азота:
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O,
8NH3 + 3Br2(aq) = N2 + 6NH4Br(aq),
2NH3 + 3CuO = N2 + 3Cu + 3H2O.
Фосфор получают восстановлением фосфорита или апатитов коксом в присутствии песка в электропечах при 1500 °С:
2Ca3(PO4)2 + 6SiO2 + 10C = 6CaSiO3 + 10CO↑ + P4↑;
G = −1153 кДж/моль.
Образующиеся пары фосфора конденсируются в виде белого фосфора и собираются под слоем воды. Красный фосфор получают нагреванием белого без доступа воздуха в течение нескольких часов при температуре
300÷400 °С.
Мышьяк, сурьму и висмут получают обжигом природных сульфидов с последующим восстановлением образующихся оксидов коксом:
8
2As2S3 + 9O2 = 2As2O3 + 6SO2, 2As2O3 + 2C = As4↑+ 3CO.
1.1.3. Химические свойства
Прочность и неполярность молекулы N2, близость энтальпии ионизации молекулы (1402 кДж/моль) к энтальпии ионизации аргона объясняют её химическую инертность по отношению ко многим веществам. В обычных условиях азот используют для создания инертной атмосферы вместо более дорогих благородных газов. Молекулярный азот проявляет очень слабые восстановительные и окислительные свойства (энергия сродства к электрону −3,6 эВ). При комнатной температуре он реагирует только с литием. В случае инициирования реакций нагреванием, электрическим разрядом или ионизирующими излучениями, а также в присутствии катализаторов, азот взаимодействует с сильными окислителями и восстановителями:
N2 |
+ O2 = 2NO |
(в электрическом разряде), |
N2 |
+ 6Li = 2Li3N |
(при обычной температуре), |
N2 |
+ 2Ti = 2TiN |
(при t = 1200 °С), |
N2 |
+ 3H2 2NH3 |
(при 400−500 °С, катализатор). |
Полимерные модификации фосфора, в отличие от белого фосфора, обладают меньшей реакционной способностью, красный фосфор менее ядовит, а чёрный фосфор не токсичен. Из-за высокой химической активности белый фосфор хранят под слоем воды, а образцы красного фосфора следует оберегать от ударов и трения.
В обычных условиях все модификации фосфора энергично реагируют с галогенами:
2P + 5Cl2 = 2PCl5,
а при нагревании окисляются серой:
4P + 3S = P4S3.
В последней реакции образуются также другие сульфиды с общей формулой − P4Sx, где х = 3, 5, 7, 9, 10).
Проявляя окислительно-восстановительную двойственность, фосфор диспропорционирует в горячих растворах щелочей:
P4 + 3KOH + 3H2O = PH3↑+ 3K[H2PO2];
( E0реакц.= E0(P4/PH3) − E0(H2PO2−/P4) = −0,063−(−2,05) = +1,987 B).
При комнатной температуре As, Sb и Bi реагируют только с галогенами, образуя тригалогениды, а в случае сурьмы − и пентагалогениды. При нагревании на воздухе они сгорают с образованием оксидов Э2О3, а с расплавленной серой дают сульфиды Э2S3. Все простые вещества с металлами образуют сплавы, а также стехиометрические и нестехиометрические соединения:
Ga + As = GaAs, 2Co + As = Co2As.
9
При сплавлении мышьяка, сурьмы, висмута с металлами могут получаться сплавы с эвтектиками, имеющими низкие температуры плавления. Например, широко применяемый сплав Вуда, с температурой плавления всего 60,5 °С, содержит 50 % Bi, 25 % Pb, 12,5 % Sn и 12,5 % Cd.
Имея стандартные окислительно-восстановительные потенциалы положительнее потенциала водорода, мышьяк, сурьма и висмут не растворяются в кислотах-неокислителях и не реагируют с растворами щелочей. Кислоты-окислители окисляют мышьяк и сурьму до мышьяковой и сурьмяной кислот:
3As + 5HNO3 + 2H2O = 3H3AsO4 + 5NO,
3Sb + 5HNO3 = 5NO + H2O + 3HSbO3 (β-сурьмяная кислота).
Висмут в концентрированной азотной кислоте пассивируется, но в разбавленной кислоте растворяется с образованием нитрата висмута(III):
Bi + 4HNO3 = Bi(NO3)3 + NO + 2H2O.
Сурьма и висмут могут реагировать с концентрированной соляной кислотой в присутствии окислителя, например, пероксида водорода:
2Sb + 12HCl + 3H2O2 = 2H3[SbCl6] + 6H2O.
1.2. Соединения элементов VA-группы
1.2.1. Водородные соединения
Все элементы группы образуют соединения с водородом состава ЭН3, но устойчивость их различна. Стибин SbH3 и висмутин BiH3 являются крайне нестабильными соединениями. Азот, кроме аммиака с азотом в степени окисления –3, образует также и другие соединения с водородом: гидразин N2H4 (ст. ок. азота –2), гидроксиламин NH2OH (ст. ок. азота –1) и их многочисленные неорганические и органические производные.
|
|
|
Свойства ЭН3 [1] |
|
|
Таблица 2 |
||
|
|
|
|
|
|
|||
|
|
Угол |
|
|
|
0 |
|
|
Соеди- |
Длина свя- |
НЭН, |
Дипольный |
tпл, °С |
tкип, °С |
Hf |
, |
Энергия связи |
нение |
зи Э–Н, нм |
град |
момент, D |
|
|
кДж/моль |
Э–Н, кДж/моль |
|
|
|
|
|
|
|
|
|
|
NH3 |
0,102 |
107,3 |
1,48 |
–78 |
–33 |
–46,2 |
380 |
|
PH3 |
0,144 |
93,3 |
0,55 |
–134 |
–88 |
5,4 |
|
323 |
AsH3 |
0,152 |
92,1 |
0,17 |
–116 |
–62 |
66,4 |
281 |
|
SbH3 |
0,171 |
91,6 |
0,04 |
–88 |
–17 |
145,0 |
250 |
|
Водородные соединения азота В указанных соединениях атомные орбитали атома азота, с учётом
электронной пары на 2s-орбитали, находятся в sp3-гибридном состоянии, что определяет геометрическое строение молекул, их полярность и донорные свойства:
10
