
5 и 6 группы
.pdf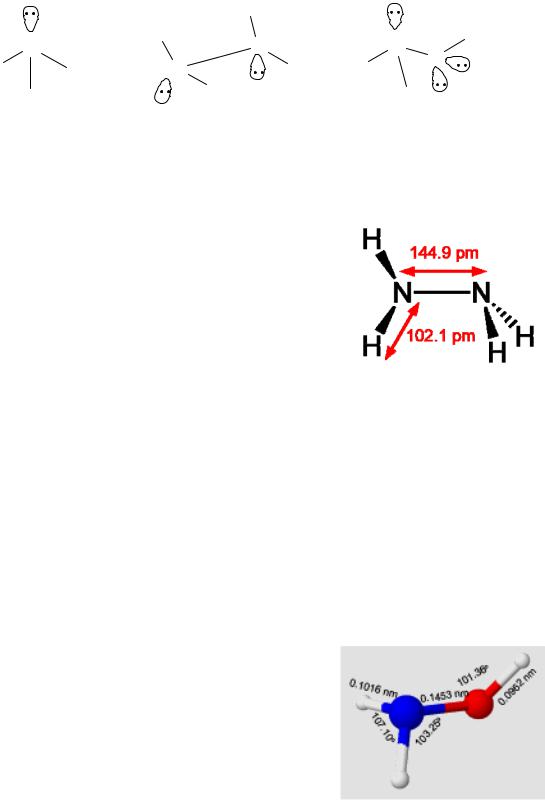
|
|
|
H |
|
|
|
|
N |
H |
N |
|
N |
H |
|
N |
H |
O |
|||
H |
H |
H |
|
|||
|
H |
|||||
|
H |
H |
|
|
|
|
|
|
|
|
|
|
|
|
a |
|
b |
|
|
c |
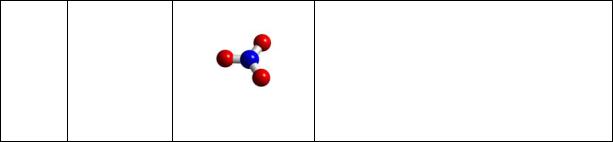
Рис. 4. Геометрическая форма молекул: a – аммиак, b – гидразин, с – гидроксиламин
Пирамидальная молекула аммиака (рис. 4а) обладает высокой полярностью (μ = 1,46 D). Несвязывающая электронная пара и полярность связи N-H обусловливают образование между молекулами водородных связей. Поэтому, ввиду малой молекулярной массы (17 а.е.м.), аммиак при обычных условиях − газ, но он имеет сравнитель-
но высокие температуры плавления (−77,75 °С) и кипения (−33,35 °С), а также легко сжижается. Аммиак имеет характерный резкий запах.
Строение молекулы гидразина (рис. 4b) сходно со строением молекулы пероксида водорода. По аналогии с H2O2, N2H4 называют пернитридом. За счёт вращения NH2-групп вокруг связи N–N возможно существование конформационных изомеров. Однако высокое значение дипольного момента (μ = 1,85 D) для молекулы N2H4 свидетельствует в пользу цисформы (рис. 4b). Между сильно полярными молекулами возникают прочные водородные связи. В обычных условиях гидразин − бесцветная мас-
лянистая жидкость (tпл. = 1,5 °С, tкип. = 113,5 °С), с запахом, напоминающим запах аммиака. При нагреве может взрываться, так как имеет поло-
жительную энтальпию образования (+55 кДж/моль). Гидроксиламин можно рассматривать как продукт замещения атома водорода в молекуле аммиака на ОН-группу. Из-за наличия в молекулах атома кислорода между ними возникают водородные связи ещё более прочные, чем в аммиаке и гидразине, поэтому NH2OH при обычных условиях − белое кристаллическое вещество
(tпл. = 33 °С, tкип. = 58 °С при 22 мм рт. ст.). Гид-
роксиламин очень гигроскопичен, при нагревании взрывается.
Аммиак, гидразин и гидроксиламин очень хорошо растворимы в воде − 700 л NH3 растворяются в 1 л воды при 20 °С, а N2H4 и NH2OH смешиваются с водой неограниченно. Столь высокая растворимость объясня-
11
ется образованием водородных связей между молекулами веществ и молекулами воды, вплоть до образования гидратов. За счёт неподелённых электронных пар на атомах азота NH3, N2H4 и NH2OH проявляют основные свойства, причём гидразин является двукислотным основанием:
NH3 + H2O NH3 H2O OH− + NH4+ (аммоний) Kb = 1,8 10−5, N2H4 + H2O N2H4 H2O OH− + N2H5+ (гидразиний(+1)) Kb1 = 8,5 10−7,
N2H5+ + H2O OH− + N2H62+ (гидразиний(+2)) Kb2 = 8,9 10−16,
NH2OH + H2O NH2OH H2O OH− + NH3OH+ (гидроксиламиний) Kb = 7 10−9.
Гидразин можно рассматривать как производное аммиака, в котором атом водорода замещён на группу NH2. Поскольку электроотрицательность этой группы выше, чем у водорода, основные свойства гидразина по сравнению с аммиаком ниже. У гидроксиламина основные свойства ниже, чем у гидразина, так как электроотрицательность группы ОН больше, чем группы NH2.
Аммиак, гидразин и гидроксиламин реагируют с кислотами, образуя
соли: |
|
|
NH3 + HCl = NH4Cl |
(хлорид аммония), |
|
N2H4 |
+ HCl = N2H5Cl |
(хлорид гидразиния(+1)), |
N2H4 |
+ 2HCl = [N2H6]Cl2 |
(хлорид гидразиния(+2)), |
NH2OH + HCl = [NH3OH]Cl |
(хлорид гидроксиламмония). |
|
Почти все соли растворимы в воде, а ионы NH4+, N2H5+, NH3OH+ подвергаются гидролизу, создавая кислую среду:
NH4+ + H2O NH3 + H3O+,
N2H5+ + H2O N2H4 + H3O+,
[NH3OH]+ + H2O NH2OH + H3O+.
Неподеленные электронные пары на атомах азота в аммиаке, гидразине и гидроксиламине объясняют их лигандные свойства при образовании ком-
плексных соединений: [Ag(NH3)2]+, [Pt(NH3)2Cl2], [Rh2(μ-N2H4)2(CN)5], [Pt(NH2OH)4]2+. Гидразин, имея два донорных атома азота, часто выступает в роли мостикового лиганда. Гидроксиламин, хотя и имеет неподелённые пары на атоме кислорода, является монодентатным лигандом за счёт донорного атома азота.
При координации к ионам металлов у молекул NH3, N2H4 и NH2OH ослабевают основные свойства и усиливаются кислотные, например, амминокомплекс платины(+4) при взаимодействии со щелочами превращается в амидокомплекс:
[Pt(NH3)5Cl]Cl3 + NaOH [Pt(NH3)4(NH2)Cl]Cl2 + NaCl + H2O.
NH3 теряет основные свойства, т.к электронная пара азота вовлекается в химическую связь с ионом металла. Проявление кислотных свойств является следствием кулоновского отталкивания протонов молекулы NH3 от положительно заряженного иона металла.
12

Жидкий аммиак и гидразин являются сильно ионизирующими растворителями. Собственная ионизация этих растворителей меньше, чем в случае воды:
NH3 |
+ NH3 NH4+(s) + NH2–(s) |
Кs = 10–33, |
N2H4 |
+ N2H4 N2H5+(s) + N2H3–(s) |
Кs = 2 10–25, |
H2O + H2O H3O+(р) + OH–(р)Кs ≡ Kw = 1,8 10–16.
При этом в жидком аммиаке производные иона NH4+, например, NH4Cl, ведут себя как сильные кислоты, а производные иона NH2–, например, NaNH2 – как сильные основания. Аммонооснования и аммонокислоты в жидком аммиаке вступают в реакцию нейтрализации:
NH4Cl + NaNH2 = 2NH3 + NaCl.
Жидкий аммиак – сильный акцептор протонов, поэтому многие слабые кислоты диссоциируют в нём нацело, например, уксусная кислота. В жидком аммиаке протекают реакции, аналогичные гидролизу (аммонолиз):
SnCl4 + 8NH3 (жидк) = Sn(NH2)4 + 4NH4Cl,
SO2Cl2 + 4NH3 (жидк) = SO2(NH2)2 + 2NH4Cl,
для сравнения:
SnCl4 + 4H2O = Sn(OH)4 + 4HCl,
SO2Cl2 + 2H2O = (HO)2SO2 + 2HCl.
Активныеметаллыреагируютсжидкимаммиакомтакже, какисводой:
2Na + 2NH3 (жидк) = Н2 + 2NaNH2 (амид натрия), Zn + 2NH4Cl + 2NH3(жидк) = Н2 + [Zn(NH3)4]Cl2,
для сравнения:
2Na + 2H2O = 2NaOH + H2,
Zn + 2HCl + 4H2O = Н2 + [Zn(H2O)4]Cl2.
Аммиак, гидразин и гидроксиламин проявляют восстановительные свойства и окисляются чаще всего до азота:
4NH3 + 3O2 = 2N2 + 6H2O,
N2H4 жид. + O2 = N2 + 2H2Oжид. + 622 кДж/моль.
В присутствии металлической платины аммиак горит с образованием монооксида азота:
4NH3 + 5O2 = 4NO + 6H2O.
При окислении аммиака фтором образуется трифторид азота: 4NH3 + 3F2 = NF3 + 3NH4F.
Окислительно-восстановительные свойства аммиака, гидразина и гидроксиламина в водных растворах отражены на диаграмме Латимера
(рис. 5).
Аммиак и в кислой, и в щелочной среде является слабым восстановителем, в водных растворах не окисляется даже такими сильными окислителями как KMnO4 или HNO3. Причина заключается в кинетической инертности NH3 H2O и NH4+, что позволяет при проведении окислитель-
Ks − константа автопротолиза растворителя (ионное произведение растворителя). 13
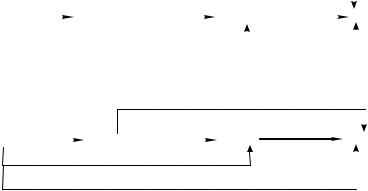
но-восстановительных реакций аммиак и его соли использовать для создания соответственно щелочной или кислой среды.
|
|
|
|
|
|
+ 1 ,3 5 B |
|
|
|
|
|
|
|||
|
|
- 1 , 8 7 B |
|
|
+ 1 , 6 4 B |
|
|
|
+ |
+ 1 , 2 8 B |
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
||||||
N |
2 |
N H 3 O H + |
|
N 2 H 5 |
|
N H 4 |
|||||||||
|
|
|
|
|
|
||||||||||
|
|
|
|
- 0 , 2 3 B |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
+ 0 , 2 8 B |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ 0 , 4 2 B |
|
|
|
|
|
|
||
|
|
- 3 , 0 4 B |
|
|
+ 1 , 8 8 B |
|
|
|
|
+ 0 , 1 0 B |
|
|
|
|
|
N 2 |
N H 2 O H |
|
N 2 H 4 |
|
N H 3 |
|
|||||||||
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|||||||||
|
|
|
|
- 1 , 1 6 B |
- 0 , 7 4 B |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 5. Диаграмма Латимера для азота
Гидразин и гидроксиламин могут проявлять окислительно-восста- новительную двойственность. В реакциях, протекающих в водных растворах, N2H4 (N2H5+) и NH2OH (NH3OH+) чаще всего выступают как сильные восстановители, окисляясь обычно до диазота. С повышением рН раствора восстановительные свойства N2H4 и NH2OH усиливаются. Это обстоятельство можно использовать на практике для избирательного восстановления металлов из растворов, содержащих смесь их солей. Например, если раствор содержит хлориды Au(III), Cu(II), Sn(IV) и Ni(II), то при действии гидразина в сильнокислой среде (рН < 2) восстанавливается золото(+3):
4H[AuCl4] + 3N2H5Cl = 4Au + 3N2 + 19HCl,
в слабокислой − медь(+2):
2CuCl2 + N2H5Cl = 2Cu + N2 + 5HCl,
в нейтральной − олово(+4):
(NH4)2[SnCl6] + 5N2H4 = Sn + N2 + 2NH4Cl + 4N2H5Cl,
а в щелочной − никель(+2):
2[Ni(NH3)6]Cl2 + N2H4 = 2Ni + N2 + 4NH4Cl + 8NH3.
Гидроксиламин и его соли также используют в качестве эффективных восстановителей:
2NH2OH + I2 + 2KOH = N2 + 2KI + 4H2O,
но они способны и окислять Fe(II) до Fe(III), восстанавливаясь до NH3 или
NH4+:
2[NH3OH]Cl + 4FeSO4 + 2H2SO4 = 2Fe2(SO4)3 + 2NH4Cl + 2H2O.
Безводные гидразин и гидроксиламин при нагревании диспропорционируют с образованием аммиака и диазота:
3N2H4 = N2 + 4NH3, 3NH2OH = N2 + NH3 + 3H2O.
14
Аммиак при высоких температурах также разлагается на азот и водород, однако этот процесс является реакцией внутримолекулярного окис- ления-восстановления:
2NH3 = N2 + 3H2.
Соли аммония термически неустойчивы. Соли кислот-неокисли- телей при нагревании обратимо разлагаются на аммиак и кислоту (или ангидрид кислоты и воду):
NH4Cl NH3 + HCl, (NH4)2CO3 2NH3 + CO2 + H2O.
Соли кислот-окислителей претерпевают внутримолекулярное окис- ление-восстановление и разлагаются необратимо:
2(NH4)2CrO4 = Cr2O3 + N2 + 2NH3 + 5H2O, 2NH4ClO3 = Cl2 + O2 + N2 + 4H2O.
В настоящее время в промышлености аммиак получают по методу Ф. Габера:
N2 + 3H2 2NH3; H° = −46 кДж/(моль NH3).
В соответствии с принципом Ле-Шателье − Брауна, равновесие реакции смещается вправо при понижении температуры и повышении давления. Однако для увеличения скорости реакции процесс ведут при температуре 400−500 °С и в присутствии катализатора (железная губка с добавками оксидов CaO, MgO, Al2O3 и SiO2). Давление в аппаратах может достигать 300 атм.
В лаборатории аммиак получают вытеснением из насыщенного раствора NH4Cl концентрированным раствором щёлочи:
NH4Cl + NaOH = NH3↑+ NaCl.
Гидразин получают окислением водного раствора аммиака гипохлоритом натрия. Образующийся на первой стадии реакции хлорамин
NH3 + NaOCl = ClNH2 + NaOH,
реагирует с избытком аммиака по схеме:
2NH3 + ClNH2 = N2H4 + NH4Cl.
При нагревании смеси избыток аммиака улетучивается: NH4Cl + NaOH = NH3↑+ NaCl + H2O.
Если же реакционную смесь нейтрализовать серной кислотой, то выделяется малорастворимая в этих условиях соль − N2H6SO4 (сульфат гидразиния(+2)).
Гидроксиламин получают электрохимическим восстановлением раствора азотной кислоты на свинцовом катоде:
NO3− + 6e− + 8H+ = NH3OH+ + 2H2O.
Образующийся ион NH3OH+ осаждают соляной кислотой в виде малорастворимой в кислой среде соли [NH3OH]Cl. Гидроксиламин выделяют, действуя на хлорид гидроксиламмония сильным основанием:
[NH3OH]Cl + NaOH = NH2OH + NaCl + H2O.
15

Азидоводородная кислота (азидоводород) HN3 – бесцветная летучая
жидкость (tпл. = −80 °С, tкип. = 36 °С) с резким запахом. Вещество чрезвычайно взрывчато, однако водные растворы с содержанием до 20 масс. %
безопасны. В водных растворах HN3 − слабая кислота, Кa = 1,9 10−5.
В молекуле азидоводородной кислоты три атома азота выстроены в линию, что определяется sp-гибридизацией валентных орбиталей цен-
трального атома азота: |
|
Орбитали боковых атомов азота находятся |
||
|
|
1100 |
H |
|
N- |
+ |
|
в sp2-гибридном состоянии, поэтому атом во- |
|
N |
|
дорода присоединяется под углом (110°). Цен- |
||
N |
|
|||
|
|
|
|
тральный атом азота четырехвалентен, что |
 возможно при переносе одного электрона с 2sорбитали на р-орбиталь концевого атома азота, вследствие чего центральный атом приобретает заряд +1, а концевой −1.
возможно при переносе одного электрона с 2sорбитали на р-орбиталь концевого атома азота, вследствие чего центральный атом приобретает заряд +1, а концевой −1.
Азидоводородная кислота проявляет окислительные свойства (азот в степени окисления +5 и -3) и восстанавливается по схеме:
HN3 + 3H+ + 2e− = N2 + NH4+ E0 = +1,96 B,
и реже − до иона аммония:
HN3 + 11H+ + 8e− = 3NH4+ E0 = +0,695 B.
Как и азотная кислота, HN3 растворяет металлы, стоящие в ряду напряжений после водорода:
4HN3 + Cu = Cu(N3)2 + N2 + (NH4)N3.
Смесь азидоводородной кислоты с концентрированной HCl при нагревании растворяет золото и платину, т.е. ведет себя аналогично «царской водке»:
Pt + 2HN3 + 8HCl = H2[PtCl6] + 2N2 + 2NH4Cl.
Соли азидоводородной кислоты называются азидами. Азиды щелочных металлов устойчивы и по свойствам напоминают галогениды. Азиды тяжёлых металлов неустойчивы, при нагревании или ударе взрываются. На этом основано применение, например, азида свинца Pb(N3)2 в качестве детонатора.
Азидоводородную кислоту можно получить окислением гидразина азотистой кислотой:
N2H4 + HNO2 = 2H2O + HN3
Водородные соединения фосфора Непосредственно с водородом фосфор не реагирует.
Однако при растворении фосфора в щелочах (см. выше) или обработке фосфидов водой:
Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3↑
выделяется очень ядовитый, с неприятным запахом
16
бесцветный газ фосфин − РН3 (tкип. = −87,7 °С) с примесью дифосфина −
Р2Н4.
При температуре около 150 °С фосфин самовоспламеняется на воздухе:
PH3 + 2O2 = HPO3 + H2O.
В присутствии примеси Р2Н4 фосфин самовозгорается и при обычных температурах.
Молекула РН3, как и молекула NH3, имеет форму тригональной пирамиды, однако величина валентного угла Н-Р-Н, равная 93,5°, указывает на незначительный вклад 3s-орбиталей в sp3-гибридные орбитали атома фосфора. РН3 имеет низкую в сравнении с NH3 температуру кипения вещества (−87,7 °С) и малую растворимость в воде (0,23 л в 1 л Н2О при 17 °С). Донорные свойства РН3 также значительно ослаблены (электронная пара находится на негибридной 3s-орбитали). Поэтому, в отличие от аммиака, растворение фосфина в воде не сопровождается образованием соединений, а донорные свойства РН3 проявляет только при взаимодействии с очень сильными кислотами:
PH3 + HI = PH4I (иодид фосфония).
Водой соли фосфония разлагаются. Фосфин является сильным восстановителем, он способен выделять металлы из растворов их солей:
PH3 + 8AgNO3 + 4H2O = Ag + H3PO4 + 8HNO3.
Дифосфин Р2Н4 − бесцветная, самовоспламеняющаяся на воздухе жидкость. Строение аналогично гидразину. В обычных условиях Р2Н4 очень неустойчив и при температуре выше −10 °С, а также на свету или в присутствии следов кислот разлагается.
Водородные соединения мышьяка, сурьмы и висмута
Арсин AsH3, стибин SbH3 и висмутин BiH3 − в |
|
As |
обычных условиях газообразные вещества с резким за- |
|
|
пахом, практически нерастворимые в воде. Очень ток- |
H |
H |
сичны, особенно арсин. Их молекулы имеют такое же |
||
строение, как и молекула РН3. |
|
H |
Валентные углы Н−Э−Н близки к 90°, почти от- |
|
сутствуют донорные свойства. AsH3, SbH3 и BiH3 не взаимодействуют с водой и даже с сильными кислотами. Напротив, у стибина проявляются слабые кислотные свойства и, при пропускании через раствор нитрата серебра, он образует чёрный осадок малоустойчивого стибида серебра:
SbH3 + 3AgNO3 = Ag3Sb↓ + 3HNO3.
Водородные соединения мышьяка, сурьмы и висмута термически не-
устойчивы ( Н0обр. > 0) и уже при комнатной температуре AsH3 и SbH3 медленно разлагаются, а BiH3 – очень быстро:
2ЭН3 = 2Э + 3Н2,
Это обстоятельство не позволяет хорошо изучить свойства BiH3.
17
Арсин и стибин проявляют сильные восстановительные свойства. Они горят на воздухе:
2ЭН3 + 3О2 = Э2О3 + 3Н2О и легко окисляются галогенами, серой, перманганатом калия, нитратом
серебра:
2AsH3 + 12AgNO3 +3H2O = 12Ag + As2O3 + 12HNO3.
ЭН3 можно получить действием разбавленных кислот на арсениды, стибиды и висмутиды:
Mg3Э2 + 6HCl = 2ЭH3↑+ 3MgCl2.
Арсин и стибин наиболее просто получаются действием цинка на подкисленные растворы соединений мышьяка и сурьмы:
As2O3 + 6Zn + 6H2SO4 = 2AsH3↑+ 6ZnSO4 + 3H2O.
В небольших количествах висмутин синтезируют термическим разложением его алкильных производных, например CH3BiH2.
При пропускании электрического разряда через арсин образуется диарсин As2H4 − аналог дифосфина. Это бесцветное газообразное вещество, которое легко разлагается при температурах выше −100 °С.
1.2.2. Кислородные соединения
Увеличение ионного вклада в химическую связь Э–О – причина роста термодинамической стабильности оксидов Э2О3 и Э2О5 при переходе от азота к фосфору и от мышьяка к сурьме. Резкое возрастание окислительной способности соответствующих соединений. Падение устойчивости этих оксидов от Р к As и от Sb к Bi обусловлено ростом деформируемости атомов. Для оксидов характерно нерегулярное изменение свойств однотипных соединений в ряду N–Bi – вторичная периодичность.
Кислородные соединения азота
Азот образует большое число оксидов: N2O, NO, N2O3, NO2, N2O4, N2O5 и очень неустойчивые N4O и NO3. Кратность связи N−O в оксидах больше единицы за счёт образования π-связей р-орбиталями азота и кислорода. Стандартная энергия Гиббса G° образования всех оксидов больше нуля, поэтому при обычных условиях непосредственным взаимодействием азота с кислородом оксиды получить нельзя. Однако анализ термодинамических характеристик образования молекулы NO ( H° = = 180,6 кДж/моль, S° = 24 Дж/(моль К)) свидетельствует о том, что реакция протекает с возрастанием энтропии и возможна при высокой температуре, так как с увеличением температуры G = H − T S может стать меньше нуля. Действительно, взаимодействие азота с кислородом с образованием NO происходит при 3000 °С:
N2 + O2 2NO.
18
В природе NO образуется в атмосфере при грозовых разрядах, а также при сгорании топлива в высокофорсированных бензиновых двигателях. И в том, и в другом случаях реакция протекает с затратой энергии.
Строение молекул оксидов азота и их основные свойства представлены в табл. 3.
Таблица 3
Оксиды азота (по данным [1,3])
Фор- |
Название |
Строение |
Описание |
|
мула |
||||
|
|
|
||
|
|
|
Бесцветный газ с сладковатым запахом |
|
|
|
|
(tпл. = –90,9 °С, tкип. = –88,6 °С) имеет рас- |
|
|
Монооксид |
|
творимость в воде такую же, как у СО2 |
|
N2O |
диазота (за- |
|
(0,17 г в 100 мл Н2О при 20 °С), но не |
|
|
кись азота) |
Линейное (С∞) |
реагирует с ней. Молекула N2O изоэлек- |
|
|
|
N–=N+=O или |
тронна CO2, NO2+, N3- |
|
|
|
N≡N+→O− |
|
|
|
Моноок- |
|
Бесцветный парамагнитный газ (tпл. = |
|
NO |
|
= −163,6 °С, tкип. = −151,8 °С), малорас- |
||
сид(моно)азо |
|
творимый в воде (7,38 мл в 100 мл воды |
||
|
та |
|
при 0 °С); в чистом виде в жидком и |
|
|
|
|
твёрдом состояниях также бесцветен |
|
|
|
|
Голубое твёрдое вещество (т. пл. – |
|
|
Триоксид |
|
100,7 °С), в газовой фазе обратимо дис- |
|
N2O3 |
|
социирует на NO и NO2 |
||
диазота |
|
|
||
|
|
|
||
|
|
Плоское (Cs) |
|
|
|
|
|
Бурого цвета, ядовитый газ (tкип. = 21,15 °С, |
|
|
Диоксид |
|
tпл = –11,25 °С). Обратимо димеризуется в |
|
NO2 |
|
N2O4 В жидком виде вещество окрашено в |
||
азота |
|
|||
|
|
коричневый цвет, а в кристаллическом – |
||
|
|
|
||
|
|
Изогнутое (Cs) |
бесцветно |
|
|
|
|
Бесцветная жидкость (т. пл. –11,2 °С), |
|
|
|
|
обратимо диссоциирует в газовой фазе с |
|
N2O4 |
Тетраоксид |
|
образованием NO2 |
|
диазота |
|
|
||
|
|
|
||
|
|
Плоское (D2h) |
|
|
|
|
[NO2]+[NO3]- - |
Бесцветное ионное твердое вещество (tпл. = |
|
|
|
«нитрат нитро- |
= 41 °С).; при 32,4 °С возгоняется с обра- |
|
|
|
ния». |
зованием неустойчивого молекулярного |
|
|
Пентаоксид |
|
газа (уголN-O-N – 180°) |
|
N2O5 |
|
|
||
диазота |
|
|
||
|
|
|
||
|
|
Плоское C2v(-D2h) |
|
|
|
|
19 |
|
Неустойчивый парамагнитный радикал
NO3 |
Триоксид |
|
азота |
||
|
Плоское (D3h)
Оксид азота (I) (оксид диазота) N2O. Формально атомы азота в N2O
имеют разные степени окисления и валентности. Оксид диазота – инертное соединение и при обычной температуре не реагирует даже с галогенами. При нагревании N2O разлагается с выделением кислорода:
2N2O = 2N2 + O2,
поэтому при повышенной температуре N2O – сильный окислитель и поддерживает горение (в его атмосфере загорается тлеющая лучина).
Получают оксид азота (I) нагреванием (250 °C) предварительно очищенного от примесей нитрата аммония:
NH4NO3 = N2O + 2H2O,
или взаимодействием сульфаминовой кислоты с концентрированной HNO3:
(H2N)HSO3 + HNO3 = N2O + H2SO4 + H2O.
С водой оксид азота (I) не взаимодействует, хотя известна азотноватистая кислота – H2N2O2 (H–O–N=N–O–H). Она представляет собой бесцветные, расплывающиеся на воздухе кристаллы, очень неустойчива, взрывчата, воспламеняется при контакте с твёрдой щёлочью; хорошо растворяется в воде, спирте, эфире и бензоле. При хранении кислота самопроизвольно разлагается:
H2N2O2 = N2O + H2O.
Обратная реакция не идёт. Кислотные свойства H2N2O2 выражены слабо – Кa1 = 9 10–8, Кa2 = 10–11 (по силе близка к угольной кислоте).
Соли азотноватистой кислоты – гипонитриты – более устойчивы. Гипонитриты можно получить из соответствующих нитритов восстановлением амальгамой натрия:
2NaNO2 + 4Na(Hg) + 2H2O = Na2N2O2 + 4NaOH.
H2N2O2 получают действием на Ag2N2O2 сухим HCl в абсолютном эфире:
Ag2N2O2 + 2HCl = H2N2O2 + 2AgCl ↓.
Оксид азота (II) (монооксид азота) NO является промежуточным продуктом в промышленном синтезе азотной кислоты. Электронное строение молекулы NO представлено на диаграмме МО (рис. 6).
20
