
5 и 6 группы
.pdf
Тригалогениды применяются для получения фосфористой кислоты, фосфорорганических соединений, красителей, лекарств, инсектицидов и отравляющих веществ.
PCl3, PBr3 и PI3 образуются при взаимодействии белого фосфора с
недостатком галогена: |
|
|
|
|
|
|
Р4 + 6Сl2 = 4PCl3. |
|
|
|
|
|
|
Трифторид фосфора получают обменными реакциями: |
|
|
|
|
||
PCl3 + 3HF(газ) = PF3↑ + 3HCl↑; |
2PCl3 + 3ZnF2 = 2PF3↑+ 3ZnCl2. |
|
||||
Пентагалогениды фосфора: PF5 – газ (tкип. = –84,6 °С) |
|
|
F |
|
||
и твердые вещества – PCl5 (tвозг. = 159 °С) и PBr5 (tкип. = |
|
|
|
|||
= 106 °С). В парах молекулы PHal5 имеют форму триго- |
|
|
|
|
F |
|
нальной бипирамиды (sp3d-гибридизация валентных орби- |
|
|
|
|
||
F |
|
P |
||||
талейатомафосфора). |
|
|
|
|||
|
|
|
||||
Кристаллический PCl5 построен из тетраэдриче- |
|
|
|
|
F |
|
ских ионов [PСl4]+ и октаэдрических ионов [PСl6]–, а |
|
|
F |
|
||
PBr5 − из ионов [PBr4]+ и Br−. |
|
|
|
|
||
Пары пентагалогенидов при нагревании (t > 300 °C) разлагаются: |
|
|||||
PCl5 PCl3 + Cl2,
что позволяет использовать PCl5 в качестве хлорирующего реагента. Как типичные галогенангидриды PCl5 и PBr5 разлагаются водой, образуя сначала оксотригалогениды фосфора, а затем ортофосфорную кислоту:
PCl5 + H2O = POCl3 + 2HCl, |
POCl3 + 3H2O = H3PO4 + 3HCl. |
Оксотрихлорид фосфора POCl3 |
– бесцветная жидкость (tкип. = 105 °С, |
tпл.= 1 °С), растворяет неорганические соли, например, NaCl и NH4Cl, и сама хорошо растворима в бензоле, хлороформе, сероуглероде и др. Применяется для получения фосфорорганических соединений. Будучи координационноненасыщенными соединениями, пентагалогениды способны образовывать комплексные соединения:
PF5 + HF = H[PF6] и PCl5 + HCl = H[PCl6].
H[PF6] и H[PCl6] являются сильными кислотами, их соли Na[PF6] и Na[PCl6] хорошо растворимы во многих органических растворителях и химически инертны, что позволяет использовать эти соединения как электропроводящие добавки в процессах электролиза в неводных растворах.
Соединения мышьяка, сурьмы и висмута с галогенами Мышьяк, сурьма и висмут (III) образуют фториды, хлориды, бромиды и
иодиды, а из соединений висмута (V) получены только фториды. Галогениды ЭHal3 и ЭHal5 по своей природе являются галогенангидридами, но отличаются некоторыми особенностями в реакциях с водой. Физические свойства соединений приведены в таблице 4. В газовой фазе молекулы тригалогенидов имеют строение тригональной пирамиды (sp3-гибридизация орбиталей центрального атома, рис. 12).
41
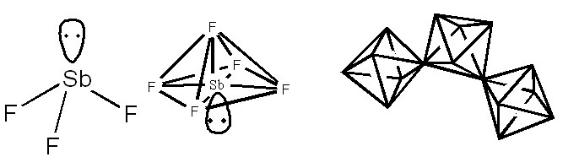
Рис. 12. Строение молекул галогенидов ЭF3 и ЭF5
Пентагалогениды в газовой фазе (a) состоят из молекул ЭF5, имеющих форму тетрагональной пирамиды (sp3d2-гибридизация), а в жидком и твёрдом состояниях (b) – из полимерных молекул – цепочек октаэдров с общими вершинами:
|
|
|
|
Таблица 4 |
|
|
Свойства галогенидов мышьяка, сурьмы и висмута |
||||
|
|
|
|
|
|
Вещество |
Физическое |
Растворимость |
Температура |
Температура |
|
состояние |
в воде |
плавления, °С |
кипения, °С |
||
|
|||||
AsF5 |
бесцв. газ |
растворим |
–78,9 |
–52,8 |
|
AsCl5 |
бесцв. жидкость |
разлагается |
–40 |
разл. |
|
SbF5 |
бесцв. жидкость |
растворим |
6 |
149,5 |
|
SbCl5 |
лим.-жёлт. жид- |
растворим |
4,0 |
140 |
|
кость |
|||||
|
|
|
|
||
SbI5 |
коричн. твёрд. в-во |
разлагается |
79 |
разл. до 130° |
|
BiF5 |
белые кристаллы |
гидролизуется |
|
550 возгон. |
|
AsF3 |
бесцв. жидкость |
раств., гидролиз. |
–5,9 |
57,8 |
|
AsCl3 |
бесцв. жидкость |
растворим |
–16 |
130 |
|
AsBr3 |
бесцв. кристаллы |
растворим |
31,2 |
221 |
|
AsI3 |
красн. кристаллы |
растворим |
141 |
371 |
|
SbF3 |
бесцв. кристаллы |
раств. и гидролиз. |
291 |
318 |
|
SbCl3 |
бесцв. кристаллы |
988 г в 100 г воды |
72,3 |
221 |
|
|
|
при 25 ºС |
|
|
|
SbBr3 |
бесцв. кристаллы |
раств., гидролиз. |
97 |
280 |
|
SbI3 |
красн. кристаллы |
раств., гидролиз. |
170 |
400 |
|
BiF3 |
бесцв. кристаллы |
плохо раств. |
730 |
|
|
BiCl3 |
бесцв. кристаллы |
гидролизуется |
232 |
441 |
|
BiBr3 |
оранж. кристаллы |
гидролизуется |
218 |
461 |
|
BiI3 |
чёрн. кристаллы |
малорастворим |
407 |
439 возгон. |
|
Наличие вакантных d-орбиталей у центральных атомов делает эти вещества сильнейшими кислотами Льюиса, поэтому ЭHal3 и ЭHal5 способны присоединять молекулы воды и галогенид-ионы с образованием комплексных соединений:
42
SbCl5 + H2O [SbCl5(H2O)] H+ + [SbCl5(OH)]–,
SbCl5 + HCl H[SbCl6] H+ + [SbCl6]–,
SbCl5 + NaCl Na[SbCl6] Na+ + [SbCl6]–,
AsCl3 + NaCl = Na[AsCl4],
BiI3 + KI K[BiI4].
Следует отметить, что растворением в плавиковой кислоте SbF5 можно существенно увеличить еT кислотность:
HF + SbF5 H+ + [SbF6]–.
Смесь, состоящая из SbF5 и фторсульфоновой кислоты HSO3F, называется «сверхкислотой» и по кислотности превосходит серную в 1012 раз. Сверхкислота способна протонировать галогены, серу и даже алканы:
SbF5 + HSO3F H[SbF5(SO3F)],
C(CH3)4 + H[SbF5(SO3F)] [C(CH3)3]+[SbF5(SO3F)]– + CH4.
При взаимодействии с водой галогенидов мышьяка (III), образуются кислоты, но, в отличие от PHal3, гидролиз AsHal3 обратим:
AsCl3 + 3H2O H3AsO3 + 3HCl,
и из крепких солянокислых растворов при кипячении отгоняется AsCl3. Тригалогениды сурьмы и висмута растворяются в небольшом коли-
честве воды, при этом образуются прозрачные растворы. При разбавлении растворов SbCl3 и BiCl3 выделяются белые малорастворимые вещества − оксохлориды SbOCl и BiOCl. По-видимому, их образованию предшествует целый ряд процессов − реакции замещения хлорид-ионов на воду (акватация):
[Sb(H2O)3Cl3] + H2O [Sb(H2O)4Cl2]+ + Cl−,
[Sb(H2O)4Cl2]+ + H2O [Sb(H2O)5Cl]2+ + Cl−
и кислотно-основные взаимодействия − отщепление протона от координированных молекул воды с образованием гидроксокомплексов:
[Sb(H2O)5Cl]2+ + H2O [Sb(H2O)4(OH)Cl]+ + H3O+,
[Sb(H2O)4(OH)Cl]+ + H2O [Sb(H2O)3(OH)2Cl]0 + H3O+.
Процесс завершается оксоляцией координированных гидроксо-ионов: [Sb(H2O)3(OH)2Cl]0 SbOCl↓ + 4H2O.
Гидролиз трихлоридов сурьмы и висмута можно записать суммарными уравнениями:
SbCl3 + H2O SbOCl↓+ 2HCl, BiCl3 + H2O BiOCl↓+ 2HCl.
Равновесия могут быть смещены влево добавлением концентрированной соляной кислоты.
В растворах концентрированных галогенводородных кислот и их солей тригалогениды превращаются в комплексы [ЭHal6]3– и [ЭHal4]–:
SbCl3 + 3HCl H3[SbCl6], SbCl3 + 3NaCl Na3[SbCl6],
AsCl3 + HCl H[AsCl4], BiI3 + KI K[BiI4].
43
Высшие галогениды проявляют окислительные свойства. При нагревании они диссоциируют, претерпевая внутримолекулярное окислениевосстановление:
ЭHal5 ЭHal3 + Hal2.
Поэтому некоторые бромиды и особенно иодиды неустойчивы, например BiI5 не существует, а AsI5 и SbI5 в водных растворах восстанавливаются иодид-ионами:
SbI5 + H2O = SbOI + I2 + 2HI.
Хлориды более устойчивы, например, H[SbCl6] при нагревании в концентрированной соляной кислоте восстанавливается, но реакция протекает обратимо:
H[SbCl6] + 2HCl H3[SbCl6] + Cl2.
BiF5 – очень сильный окислитель и окисляет воду с образованием озона:
3BiF5 + 3H2O = 3BiF3 + 6HF + O3.
Тригалогениды получают взаимодействием простых веществ с умеренным количеством галогена:
2Sb + 3Cl2 = 2SbCl3.
или кипячением оксидов в концентрированных галогенводородных кислотах:
As2O3 + 6HCl 2AsCl3↑ + 3H2O.
Пентагалогениды синтезируют действием избытком галогена на тригалогениды:
BiF3 + F2 = BiF5,
а также – галогенводородов на оксиды:
Sb2O5 + 10HCl = 2SbCl5 + 5H2O.
Для мышьяка, сурьмы и висмута известны галогениды, в которых элементы проявляют нетипичные для них чётные степени окисления, например, AsF4, As2I4, SbCl4, BiCl4, BiI. Некоторые из этих веществ построены из многоядерных молекул, содержащих элементы в разных степенях окисления. Кроме того, получены смешанные галогениды. Так, при взаимодействии AsF3 c SbF3, образуется соединение [AsF2][SbF4], а при действии Cl2 на AsF3 получается димер [AsCl4]+[AsF6]–.
1.2.4. Соединения с другими неметаллами
Сульфиды фосфора P4Sx − твёрдые вещества. В основе их структуры лежит тетраэдр Р4, в котором частично или полностью связи Р−Р замешены на сульфидные мостики P−S−P. Самым устойчивым сульфидом является Р4S3, другие сульфиды при нагревании переходят в него, выделяя элементарную серу. Сульфид P4S3 применяется в производстве спичек. Сульфиды фосфора имеют кислотный характер и при взаимодействии с сульфидом натрия образуют тиосоли:
44
P4S10 + 6Na2S = 4Na3PS4 (тиофосфат натрия − аналог ортофосфата на-
трия Na3PO4).
Растворимые в воде тиофосфаты щелочных металлов водой разлагаются с последовательным замещением атомов серы на кислород:
Na3PS4 + H2O = Na3POS3 + H2S ит.д. … Na3PO3S + H2O = Na3PO4 + H2S.
Кислотами-окислителямифосфорокисляетсядоортофосфорнойкислоты: 3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO.
Растворы сильных окислителей взаимодействуют со всеми модификациями фосфора, например, в лаборатории остатки белого фосфора нейтрализуют перманганатом калия:
3P4 + 20KMnO4 + 8H2O = 20MnO2 + 8K2HPO4 + 4KH2PO4.
При взаимодействии с металлами фосфор способен выступать окислителем, образуя фосфиды:
2P + 3Ca = Ca3P2 (при нагревании).
Фосфиды щелочных и щелочно-земельных металлов легко разлагаются водой:
Na3Р + 3Н2О = РН3 + 3NаОН,
а фосфиды переходных металлов являются соединениями переменного состава и не реагируют с водой.
Соединения с серой Э2S3, Э2S5 – малорастворимые в воде соединения с характерной окраской: As2S3 − жёлтый, As2S5 − лимонно-желтый, Sb2S3 − оранжево-красный, Sb2S5 − темно-оранжевый, Bi2S3 − черный. По кислотно-основным свойствам сульфиды мышьяка, сурьмы и висмута повторяют свойства соответствующих оксидов. Так, сульфиды As2S5, As2S3, Sb2S5 – типичные кислотные сульфиды, и реагируют с растворами основных сульфидов, образуя растворимые и устойчивые в воде тиосоли (или сульфидные комплексы):
As2S5 + 3Na2S = 2Na3AsS4,
Sb2S5 + 3Na2S = 2Na3SbS4,
As2S3 + Na2S = 2NaAsS2.
Bотличие от сульфидов мышьяка, Sb2S3 имеет амфотерный характер
ирастворим в сульфидах щелочных металлов и концентрированной соляной кислоте:
Sb2S3 + 3Na2S = 2Na3SbS3 Sb2S3 + 12HCl 2H3[SbCl6] + 3H2S.
Сульфид сурьмы (V) также растворяется в концентрированной соляной кислоте, однако эта сложная реакция сочетается с окислительновосстановительной:
Sb2S5 + 12HCl = 2H3[SbCl6] + 3H2S + 2S↓ (при нагревании).
Сульфид Bi2S3 − основный, поэтому его можно растворить только в кислотах, например, концентрированных HCl и HNO3:
45
Bi2S3 + 12HCl 2H3[BiCl6] + 3H2S, 3Bi2S3 + 8HNO3 = 2Bi(NO3)3 + 2NO + 9S + 4H2O.
Рассмотренные выше сульфиды получают действием сероводорода на кислые (рН = 0,6) растворы соединений мышьяка, сурьмы или висмута, например:
2H3AsO4 + 5H2S = As2S5 + 8H2O,
либо разложением тиосолей 6-молярным раствором соляной кислоты: 2Na3AsS4 + 6HCl = As2S5 + 6NaCl + 3H2S.
Из простых веществ получить сульфиды Э2S3 и Э2S5 сложно, так как в этом случае могут образовываться смешанные сульфиды, полисульфиды и другие соединения со сложной структурой. Так, при сплавлении мышьяка с серой, в зависимости от условий, получаются тёмно-красного цвета сульфид As4S4 (встречается в природе в виде минерала реальгар), а также сульфид As4S6. Оба сульфида следует рассматривать как производные тетраэдрического мышьяка As4. Их молекулы имеют клеточное строение, подобное As4O6 (илиР4О6), стемотличием, чтовAs4S4 частичносохраненысвязиAs-As.
Кислотные сульфиды растворяются не только в растворах основных сульфидов, но и в щелочах:
Sb2S3 + 6NaOH = Na3SbS3 + Na3[Sb(OH)6].
Следует отметить, что кислотные свойства сульфидов мышьяка выражены настолько сильно, что As2S3 и A2S5 способны растворяться в растворе (NH4)2CO3, имеющего слабощелочную среду (рН = 9).
As2S5 + 3(NH4)2CO3 = (NH4)3AsS4 + (NH4)3AsO4 + 3CO2.
Сульфиды мышьяка (III) и сурьмы (III) довольно легко окисляются, например, полисульфидом аммония:
Sb2S3 + 2(NH4)2S2 + (NH4)2S = 2(NH4)3SbS4
1.2.5. Нитриды, фосфиды, арсениды
Нитриды:
1)ковалентные – C2N2, P3N5, As4N4, S2N2 и S4N4;
2)солеобразные – Li3N, Mg3N2, Ca3N2, Cu3N, Zn3N2. Гидролизуются
водой с выделением аммиака;
3)ковалентные алмазоподобные – BN, AlN. Они устойчивы к нагреванию и действию кислот;
4)металлоподобные – TiN, CrN, Cr2N. Они тугоплавки, очень тверды
ихимически инертны.
Фосфиды:
1) летучие ковалентные (фосфиды элементов-неметаллов – Se и Te и
др.);
2) ионные (с преобладающе ионным характером связи Р–М). Их образуют ЩЭ, ЩЗЭ, РЗЭ (Na3P, Ca3P2 и др.). Эти соединения, реагируя с водой, гидролизуются с образованием фосфина;
46
3)ковалентные полимерные, например BP, нерастворимый в кислотах и щелочах.
4)металлоподобные, имеющие очень сложное строение, например,
Fe2P. Фосфиды такого типа нерастворимы в воде, имеют электронную проводимость.
Арсениды ЭхAsу:
1)летучие, с молекулярной структурой, например арсин AsH3;
2)ионные, тугоплавкие (соединения As с ЩЭ и ЩЗЭ – Mg3As2, Ca3As2 и др.);
3)ковалентные нелетучие полимеры (AlAs, GaAs и др.);
4)металлоподобные (TiAs, NiAs и др.).
1.3. Применение элементов VA группы и их соединений
Азот используется главным образом для получения аммиака, а также в качестве инертного газа в системах, где отсутствуют сильные восстановители или растворы комплексов переходных металлов. Жидкий азот широко используется для создания низких температур −195 °С, при обезвреживании взрывных устройств и для тушения особых категорий пожаров.
Аммиак относится к базовым неорганическим соединениям − ежегодно в мире производится около 5 млн тонн аммиака. Около 80 % его расходуется в производстве азотных удобрений (NH4NO3, CO(NH2)2 и др.), большая доля NH3 идёт на получение азотной кислоты, органических аминов, синтетических волокон, взрывчатых веществ, солей аммония и др. продуктов. Жидкий аммиак и его водные растворы используются как среды в различных химико-технологических процессах.
Гидразин используется как ракетное топливо. Соли гидразина и гидроксиламина применяются в качестве эффективных восстановителей, в производстве органических красителей и др. веществ.
Следует помнить, что аммиак и особенно гидразин и гидроксиламин и их соединения чрезвычайно токсичны.
Оксид азота (I) применяется в медицине в качестве анестезирующего средства, а из-за наркотического эффекта его называют «веселящим газом».
Азотная кислота находит широкое применение для растворения металлов, их соединений или рудных концентратов. Большие её количества идут на производство азотных удобрений (NH4NO3, KNO3, NaNO3, Ca(NO3)2). 100%-я HNO3 используется как нитрующий реагент в технологиях получения органических веществ и как окислитель ракетного топлива. Безводные нитраты калия, стронция и бария применяются в пиротехнике и как твердофазные окислители в процессах окислительного плавления и спекания.
Основная масса красного фосфора используется для изготовления пиротехнических материалов и спичек.
47
Фосфорная кислота и её кислые соли входят в состав препаратов для удаления продуктов коррозии с поверхности металлических изделий и создания защитных фосфатных плёнок с высокими антикоррозионными свойствами. Электрохимической обработкой металлов (анодирование) в растворах фосфорной кислоты на них получают защитные и декоративные покрытия. Ортофосфорная кислота используется в пищевой промышленности как консервант, как компонент питательной среды дрожжей и заквасок, а также в качестве регулятора кислотности в безалкогольных напитках. Фосфаты кальция и аммония производятся в больших количествах, как фосфорсодержащие минеральные удобрения (аммофос, суперфосфат, двойной суперфосфат и др.). Фосфаты применяются в производстве моющих средств (Na5P3O10), зубных паст, стекла, умягчителей воды, флокулянтов, цементов, огнестойких пропиток тканей и деревянных конструкций.
Неорганические и органические производные мышьяка применяют в сельском хозяйстве для борьбы с вредными насекомыми и грызунами, а в медицине – в качестве лекарственных препаратов. Арсениды галлия и р- элементов используются в электронике как полупроводниковые материалы. Сурьму и висмут применяют в составе разнообразных сплавов для придания им специфических физических и химических свойств. Так, олово, содержащее небольшие количества сурьмы, устойчиво к «оловянной чуме», а присадки сурьмы в свинце повышают его коррозионную стойкость. Сурьма и висмут входят в состав многих легкоплавких сплавов (припоев). Оксиды элементов находят применение в производстве керамики и стекла. Галогениды мышьяка и сурьмы применяют как катализаторы при получении многих органических веществ.
Пентафториды применяют как фторирующее реагенты. AsCl3 и SbCl3 являются исходными веществами для синтеза многих неорганических и органических производных мышьяка и сурьмы. BiI3 применяют в качестве реактива на алкалоиды (хинин, кофеин, никотин, морфин и др.).
Соединения сурьмы, висмута и особенно мышьяка, чрезвычайно токсичны.
ГЛАВА 2. VВ-ГРУППА
2.1.Простые вещества
Всостав VВ-группы ПС входят элементы ванадий 23V (Vanadium),
ниобий 41Nb (Niobium), тантал 73Ta (Tantalum) и дубний 105Db (Dubnium).
По причине небольшого периода полураспада химия дубния практически не изучена.
Восновном состоянии атомы ванадия и тантала имеют электронную конфигурацию (n – 1)d3ns2, в то время как атом ниобия – 4d45s1, что объ-
48
ясняется близостью энергий энергетических подуровней 4d и 5s. По мере увеличения атомного номера электронные оболочки уплотняются, о чем свидетельствуют рост значений первой энергии ионизации и характер изменения атомных и ионных радиусов в ряду V — Nb — Та. Размеры атомов изменяются немонотонно: при переходе от ванадия к ниобию радиус растет, а затем остается практически неизменным (лантанидное сжатие). При переходе от элементов 3d-ряда к 4d- и 5d-элементам увеличение размера d-орбиталей приводит к упрочнению d–d-перекрывания и росту ковалентного вклада в металлическую связь. Именно этим объясняется возрастание твердости, температур плавления и кипения металлов VВгруппы ПС в ряду V–Nb–Та, а также ослабление химической активности.
Ванадий, ниобий и тантал – твердые тугоплавкие металлы серого цвета, хорошо поддающиеся механической обработке. Их основные фи- зико-химические свойства приведены в таблице. Химические и физические свойства дубния ещё практически не изучены.
|
|
|
Таблица 5 |
Некоторые свойства элементов подгруппы ванадия |
|||
Свойство |
V |
Nb |
Ta |
|
|
|
|
Атомный радиус, нм |
0,136 |
0,147 |
0,149 |
|
|
|
|
Ионный радиус Э4+, нм |
0,040 |
0,069 |
0,068 |
Потенциал ионизации, эВ |
6,74 |
6,88 |
7,89 |
|
|
|
|
Е0(М2О5/М0), В |
−0,105 |
−0,65 |
−0,81 |
Температура плавления, °С |
1710 |
2487 |
2997 |
|
|
|
|
Температура кипения, °С |
3450 |
4950 |
5425 |
|
|
|
|
Плотность, г/см3 |
5,96 |
8,58 |
16,69 |
Содержание в земной коре, |
1,5·10–2 |
2·10–5 |
2,4·10–5 |
масс.% |
|
|
|
Массовые числа природных |
47,48,49,50,51,52 |
93 |
180, 181 |
изотопов |
|
|
|
2.1.1. Химические свойства
Наличие 5 валентных электронов обусловливает большой набор степеней окисления ванадия, ниобия и тантала в соединениях: +2, +3, +4 и +5. Наиболее характерная степень окисления элементов в соединениях +5. Как и в случае других d-элементов устойчивость производных в низших степенях окисления уменьшается в ряду V–Nb–Ta. Ионы металлов, будучи жесткими кислотами, образуют наиболее прочные соединения с такими жесткими основаниями как фторид-, гидроксид- и пероксид-ионы. Электродные потенциалы этих металлов отрицательнее потенциала водо-
49
рода (Е0(V2+/V) = −1,18 B, E0(Nb3+/Nb) = −1,10 B), но в компактном со-
стоянии они, и особенно тантал, устойчивы к химическим воздействиям. Так, ниобий и тантал не растворимы во всех кислотах, кроме плавиковой. Обычно металлические ниобий и тантал растворяют в смеси HF и HNO3:
Ta + 7HF + 5HNO3 = H2[TaF7] + 5NO2 + 5H2O.
Ванадий способен растворяться не только в HF, но и в кислотахокислителях: HNO3, конц. H2SO4:
3V + 8HNO3 = 3VO2NO3 + 5NO + 4H2O,
V + 3H2SO4 = VOSO4 + 2SO2 + 3H2O.
Растворы щелочей на эти металлы не действуют, однако с расплавленными щелочами они медленно реагируют:
4Nb + 12NaOH + 5O2 = 4Na3NbO4 + 6H2O.
Причину химической стойкости металлов связывают с наличием на их поверхности прочных оксидных пленок. При высоких температурах порошкообразные металлы взаимодействуют с кислородом, галогенами, серой, азотом и водородом:
2M + 5O2 = 2M2O5, |
|
|
2M + 5F2 |
= 2MF5, |
|
2Nb + 5Cl2 2NbCl5, 2Ta + 5Cl2 |
= 2TaCl5, но |
V + 2Cl2 VCl4, |
2Nb + 5Br2 2NbBr5, 2Ta + 5Br2 = 2TaBr5, но |
2V + 3Br2 2VBr3, |
|
Ta + 2S = TaS2, |
|
|
2M + N2 = 2MN. |
|
|
Сводородом металлы образуют твёрдые растворы внедрения.
2.1.2.Нахождение в природе и получение
Самостоятельные минералы ванадия встречаются крайне редко, по-
этому ванадий относят к рассеянным элементам. Основной источник ванадия железные и титановые руды (магнетиты и титаномагнетиты), а также ванадит − 3Pb3(VO4)2 PbCl2. Ниобий и тантал являются редкими элементами, близость химических свойств обусловливает их совместное нахождение в одних и тех же минералах – тантало-ниобатах (колумбит − Fe(NbO3)2, танталит − Fe(TaO3)2) и титано-тантало-ниобатах (лопарит, пирохлор, ильмено-рутил).
Руды, содержащие ванадий или ниобий и тантал, обогащают, получая концентраты. Рудные концентраты разлагают различными методами: сплавлением со щелочами или KHSO4, растворением в HF или H2SO4, хлорированием. После разделения образующихся соединений и очистки от примесей в зависимости от типа исходных концентратов получают оксиды, хлориды или фторидные комплексы – K2[MF7]. Большое практическое значение имеют продукты, непосредственно получаемые из рудных концентратов – феррованадий и феррониобий, применяющиеся в качестве добавок при варке специальных сталей. Технология получения металлов
50
