
5 и 6 группы
.pdfподгруппы ванадия в конечном итоге сводится к восстановлению их высших оксидов и галогенидов методом металлотермии:
V2O5 + 5Ca = 2V + 5CaO, 3V2O5 + 10Al = 6V + 5Al2O3,
K2 [NbF7] + 5Na = Nb + 5NaF + 2KF, NbCl5 + 5Na = Nb + 5NaCl, K2 [TaF7] + 5Na = Ta + 5NaF + 2KF, TaCl5 + 5Na = Ta + 5NaCl.
Для получения ниобия или его сплава с танталом используется карботермическое восстановление Nb2O5 карбидом ниобия при 1600 °С в вакууме:
Nb2O5 + 5NbC = 7Nb + 5CO.
Кроме того, для получения ниобия и тантала применяется электролиз расплавов K2[TaF7] или Ta2O5 в смеси с KCl и KF.
2.2. Соединения элементов VВ-группы
2.2.1. Соединения с кислородом
При нагревании на воздухе ванадий темнеет, покрываясь оксидами в различной степени окисления и, наконец, сгорает с образованием V2O5. Известны четыре типа соединений ванадия с кислородом: VO (чёрного цвета), V2O3 (чёрный), V2O4 (тёмно-синий) и V2O5 (красно-жёлтый).
Оксид ванадия (V) V2O5 – наиболее важное из всех соединений ванадия, его получают нагреванием метаванадата аммония на воздухе:
2NH4VO3 = V2O5 + 2NH3 + H2O.
V2O5 незначительно растворим а воде (0,07 % при 25 °С), водные растворы имеют кислую реакцию. Оксид ванадия (V) реагирует с щелочами с образованием солей. Проявляя в основном кислотные свойства, V2O5 все же является амфотерным оксидом. Так, V2O5 реагирует с азотной кислотой:
V2O5 + 2HNO3 = 2 [VO2]NO3 + H2O
собразованием в растворе нитрата диоксованадия (ион V5+, как и V4+
вводном растворе не существует). V2O5 обладает окислительными свойствами, например, в реакциях:
V2O5 + SO2 = 2VO2 + SO3,
V2O5 + 2HClконц. 2VO2 + Cl2 + H2O.
Оксид ванадия (IV) V2O4 получают восстановлением V2O5 углём или щавелевой кислотой при нагревании:
V2O5 + C = V2O4 + CO.
В этом оксиде, помимо связей металл – кислород, имеются связи металл – металл, соединение фактически является кластером. Оксид имеет амфотерный характер:
V2O4 + 2H2SO4 = 2[VO]SO4 (сульфат ванадила), 2V2O4 + 2NaOH = H2O + Na2V4O9 (тетраванадит натрия).
51
Кислота H2V4O9 в свободном состоянии не получена. Как и все низшие оксиды ванадия, V2O4 при нагревании очень легко окисляется кислородом воздуха до высшего оксида:
2V2O4 + O2 = 2V2O5.
Оксид ванадия (III) V2O3 получают восстановлением V2O5 водородом при 900 °C. На воздухе V2O3 медленно окисляется до V2O4, в воде, растворах щелочей и кислот не растворяется (исключение HF и HNO3). При добавлении аммиака к азотнокислым растворам оксида ванадия(III) выделяется зелёный осадок гидроксида ванадия(III) – V(OH)3, обладающий основными свойствами.
Оксид ванадия (II) VO имеет основный характер, при растворении в кислотах образует соли, водные растворы которых окрашены в фиолетовый цвет. Получают оксид прокаливанием V2O5 при 1700 °С в токе водорода.
Ниобий образует оксиды NbO, Nb2O3, NbO2 и Nb2O5, а для тантала известны оксиды Ta2O2, Ta2O3, TaO2 и Ta2O5. Низшие оксиды можно получить восстановлением в токе водорода при нагревании высших оксидов М2О5 или восстановлением металлическим натрием оксифторониобатов (оксифторотанталатов). Практическое значение имеют только Nb2O5 и Ta2O5 (оба оксида белого цвета). Характер этих оксидов амфотерный с преобладанием кислотных свойств. Получают оксиды М2О5 нагреванием на воздухе металлов или прокаливанием ниобиевой или танталовой кислоты.
Гидроксиды. При добавлении минеральных кислот к растворам ванадатов, ниобатов и танталатов выпадают студенистые осадки гидроксидов неопределённого состава М2О5 · nH2O. Степень гидратации зависит от условий получения кислоты. Так из растворов выделены ванадиевые кислоты состава V2O5 · H2O, V2O5 · 2H2O и V2O5 · 3H2O, что соответствует мета-, ди- и ортованадиевым кислотам. При взаимодействии гидратированного V2O5 с растворами NaOH в зависимости от условий образуются
Na3VO4, Na4V2O7, Na8V2O9 и Na2V6O16. Ниобиевая и танталовая кислоты в реакциях со щелочами также образуют многочисленные и разнообразные
по составу ниобаты и танталаты.
Ниобиевая и танталовая кислоты способны растворяться в избытке сильных минеральных кислот и в плавиковой кислоте:
Nb2O5·H2O + H2SO4 = (NbO2)2SO4 + 2H2O,
Nb2O5·H2O + 14HF = 2H2[NbF7] + 6H2O,
Nb2O5·H2O + 1OHF = 2H2[NbOF5] + 4H2O (аналогичные соединения образуются и в случае тантала).
Ванадаты, ниобаты и танталаты
При взаимодействии V2O5 с растворами щелочей образуются ортованадаты:
V2O5 + 6NaOH = 2Na3VO4 + 3H2O.
52
Растворимые ортованадаты на холоду гидролизуются. Гидролиз сопровождается димеризацией:
2Na3VO4 + H2O Na4V2O7 + 2NaOH.
При кипячении растворов диванадаты переходят в метаванадаты: Na4V2O7 + H2O 2NaVO3 + 2NaOH.
Подкисление растворов ортованадатов приводит к полимеризации ванадат-ионов VO43– с образованием оксополианионов. С уменьшением рН растворов можно получить следующие оксоанионы:
VO43–→ V2O74–→ V3O93–→ V6O174–→ V10O286–→ V2O5·H2O→ (HVO3)∞
рН >12 11-12 |
9 |
7 |
1,6 |
<1 |
Аналогичные гидролитические процессы протекают в растворах ниобатов и танталатов. В отличие от ниобатов и танталатов, ванадаты в водных растворах серной кислоты легко восстанавливаются в соединения более низких степеней окисления ванадия − V(IV), V(III) и V(II):
3Na3VO4 + 2Bi(Hg) + 9H2SO4 = 3[VO]SO4 + Bi2(SO4)3 + 3Na2SO4+ 9H2O,
2Na3VO4 + 2Mg + 8H2SO4 = V2(SO4)3 + 2MgSO4 + 3Na2SO4 + 8H2O, 2Na3VO4 + 3Zn(Hg) + 8H2SO4 = 2VSO4 + 3ZnSO4 + 3Na2SO4 + 8H2O.
Реакции сопровождаются изменением окраски растворов: гидратиро-
ванные ионы VO2+ − зелёного цвета, V3+ − голубого цвета, а растворы V2+ − фиолетовые.
Пероксосоединения
При действии на ванадаты пероксидом водорода образуются пероксованадаты:
2NaVO3 + H2O2 + 2NaOH = Na4V2(О2)O6 + 2H2O.
Растворы пероксованадатов окрашены в жёлтый цвет. Добавление сильных кислот изменяет окраску раствора на красную ввиду образования пероксованадиевой кислоты НV(O2)O2. Эта реакция используется в аналитической химии.
Для ниобия и тантала также характерно образование пероксониобатов и пероксотанталатов:
KNbO3 + 4H2O2 + 2KOH = K3NbO8 + 5H2O.
Соль K3NbO8 можно рассматривать как продукт замещения четырех атомов кислорода в ортониобате K3NbO4 на пероксо-группы (О22–) – K3Nb(O2)4. Пероксотанталаты имеют аналогичный состав. Если к растворам пероксониобатов и пероксотанталатов добавлять серную кислоту, то образуются осадки пероксониобиевой или пероксотанталовой кислот:
2K3TaO8 + 3H2SO4 + 4H2O = 2HTa(O2)O2↓+ 3K2SO4 + 6H2O.
Пероксогруппы, как лиганды, способны координироваться к центральному атому в ниобатах и танталатах. При этом полимерные ионы разрушаются и образуются насыщенные тетрапероксониобат-ионы − [Nb(O2)4]3− или тетрапероксотанталат-ионы – [Ta(O2)4]3−. Известны перок-
53
сокомплексы со смешанными лигандами, например, K3[Nb(O2)2(C2O4)2]. Получение пероксосоединений широко используется в аналитической химии ниобия и тантала.
2.2.2. Соединения с галогенами
Пентафториды MF5 получаются прямым действием сухого фтора на нагретый металл. Эти вещества – типичные галогенангидриды и очень склонны к гидролизу:
2VF5 + 6H2O = V2O5 H2O + 10HF,
NbF5 + H2O = H2[NbOF5] ,
TaF5 + H2O = H2[TaOF5].
При растворении пентафторидов ниобия и тантала в HF образуются гептафторокомплексы:
NbF5 + 2HFконц. = H2[NbF7], TaF5 + 2HFразб. = Н2[TaF7].
Различие в формах нахождения ниобия и тантала в разбавленных растворах плавиковой кислоты (H2[NbOF5] и H2[TaF7]) используется при разделении этих очень похожих металлов. Из комплексных кислот получено множество солей, из которых практически наиболее значимы
K2[NbOF5] и K2[TaF7].
Кроме фторидных комплексов известны оксофториды MOF3 и простые фториды − VF4, VF3.
Для всех трех металлов известны хлориды MCl5, MCl4, MCl3 и оксохлориды MOCl3, MOCl2, которые по своей природе являются галогенангидридами. Ванадий образует также соли – VCl2 и VOCl, они являются сильными восстановителями.
2.2.3. Соединения с другими неметаллами
Для ванадия известно несколько сульфидов – VS, V2S3 и V2S5. Низшие сульфиды легко окисляются кислородом воздуха до V2O5 и SO2. При нагревании V2S3 c серой образуется сульфид ванадия(V):
V2S3 + 2S = V2S5.
Этот сульфид имеет кислотный характер и растворяется в сульфиде аммония с образованием тиосоли:
V2S5 + 3(NH4)2S = 2(NH4)3VS4.
Кроме того, тиосоли легко получаются при действии гидросульфида аммония на растворы ванадатов:
Na4V2O7 + 6NH4HS + 4H2S = 2(NH4)3VS4 + 2Na2S + 7H2O.
Подкисление растворов тиованадатов приводит к выпадению осадка сульфида ванадия(V):
2(NH4)3VS4 + 6HCl = V2S5↓ + 6NH4Cl + 3H2S.
Для ниобия и тантала известны сульфиды Nb2S3, Ta2S3, NbS2 и TaS2. В их структуре предполагаются связи металл–металл.
54
2.3. Применение элементов VВ группы и их соединений
Металлы подгруппы ванадия − одни из наиболее ценных металлов современной техники. Основное применение всех трёх металлов – металлургия особых сталей и сплавов. Из хромованадиевых сталей изготавливают слесарные инструменты. Ниобий и тантал в чистом виде и в составе сплавов с никелем, вольфрамом, рением используются как конструкционные материалы в атомной энергетике и для изготовления химической аппаратуры. Термостойкие сплавы ниобия и тантала незаменимы при создании двигателей сверхзвуковых самолётов и ракет. В электронике и электротехнической промышленности ниобий и особенно тантал применяют в производстве электролитических конденсаторов и сверхпроводящих сплавов. Способность ниобия и тантала сращиваться с живой тканью организма человека находит применение в протезировании. Тонкими танталовыми нитями сшивают кровеносные сосуды и нервы, а из стержней и пластин изготавливают имплантанты костных тканей. Соединения ванадия(V) являются катализаторами-переносчиками кислорода. Так, оксид ванадия(V) используется для каталитического окисления SO2 в контактном процессе получения серной кислоты, а ряд других соединений ванадия (V) применяется для каталитического окисления органических веществ.
VI ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
ГЛАВА 3. VIA-ГРУППА
Всостав VIА-группы ПС входят кислород 8O (Oxygenium), сера 16S (Sulfur), селен 34Se (Selenium), теллур 52Te (Tellurium) и полоний 84Po (Polonium). Общее название – халькогены («рождающие медные руды»). Кислород и сера – типичные неметаллы, селен и теллур имеют характерные металлические свойства, а полоний – металл.
Восновном состоянии атомы имеют электронную конфигурацию ns2np4 с двумя неспаренными р-электронами. Кислород, не имеющий низкой по энергии свободной d-орбитали в большинстве соединений проявляет валентность, равную двум. Другие халькогены способны образовывать до шести ковалентных связей.
Атом кислорода не способен отдавать более двух электронов, соединения кислорода со степенью окисления +2 являются сильными окислителями и очень неустойчивы. Остальные галогены проявляют высшую степень окисления +6. Устойчивость данной степени окисления понижается от серы к полонию, для которого стабильны соединения со степенью окисления +4 и +2. Основные свойства элементов VIА-группы представлены в таблице 6.
55
Таблица 6
Свойства элементов VIA группы [1]
Свойство |
O |
|
S |
|
Se |
|
Te |
|
|
|
Po |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Заряд ядра Z |
|
8 |
|
16 |
34 |
|
52 |
|
|
|
84 |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Электронная |
[He]2 |
[Ne]3s2 |
[Ar]3d10 |
10 |
5s |
2 |
5p |
4 |
14 |
5d |
10 |
||||||
конфигурация |
2 |
2p |
4 |
3p |
4 |
4s |
2 |
4p |
4 |
[Kr]4d |
|
|
[Xe]4f |
|
|||
в основ |
s |
|
|
|
|
|
|
|
|
|
6s26p4 |
|
|||||
ном состоянии |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Число стабильных |
|
3 |
|
4 |
|
|
6 |
|
8 |
|
|
|
|
0 |
|
|
|
изотопов |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Энергия ионизации I1, |
1313, |
999,6 |
940,9 |
869,3 |
|
|
|
812,0 |
|
||||||||
кДж/моль: |
|
9 |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Энергия сродства |
141 |
200 |
195 |
|
190 |
|
|
|
183 |
|
|
||||||
к электрону, кДж/моль |
|
|
|
|
|
|
|||||||||||
Электроотрицатель- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ность: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
По Полингу |
3,44 |
2,58 |
2,55 |
|
2,10 |
|
|
|
2,00 |
|
|||||||
По Оллреду-Рохову |
3,50 |
2,44 |
2,48 |
|
2,01 |
|
|
|
1,76 |
|
|||||||
Ковалентный |
0,074 |
0,104 |
0,140 |
0,160 |
|
|
|
0,164 |
|
||||||||
радиус, нм |
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.1. Простые вещества
3.1.1. Физические свойства
Кислород − бесцветный газ, не имеющий вкуса и запаха. Растворимость в воде − 3,08 см3 на 100 мл воды при 20 оС. Растворимость в органических растворителях на порядок выше, для диэтилового эфира − 45,0 см3 на 100 мл при 25 оС, 30,2 см3 для CCl4, 22,3 см3 для бензола.
Жидкий кислород (tкип = −182,98 °C) − это бледно-голубая жидкость. Твердый кислород (tпл = −218,79 °C) − синие кристаллы. Известны шесть
кристаллическихфаз, изкоторыхтрисуществуютпридавлениив1 атм: α-О2 − существует при температуре ниже 23,65 К; ярко-синие
кристаллы относятся к моноклинной сингонии.
β-О2 − существует в интервале температур от 23,65 до 43,65 К; бледно-синие кристаллы (при повышении давления цвет переходит в розовый) имеют ромбоэдрическую решётку.
γ-О2 − существует при температурах от 43,65 до 54,21 К; бледносиние кристаллы имеют кубическую симметрию.
Еще три фазы образуются при высоких давлениях:
δ-О2 интервал температур 20–240 К и давление 6–8 ГПа, оранжевые кристаллы;
ε-О2 давление от 10 и до 96 ГПа, цвет кристаллов от темно-красного до черного, моноклинная сингония;
56

ζ-О2 давление более 96 ГПа, металлическое состояние с характерным металлическим блеском, при низких температурах переходит в сверхпроводящее состояние.
Электроотрицательность кислорода − 3,5, она уступает только
электроотрицательности фтора. |
|
Озон O3 – это нестабильный |
|
диамагнитный газ синего цвета с харак- |
|
терным острым запахом. Молекула O3 |
|
имеет угловую форму, как и изоэ- |
|
лектронные частицы ONCl и ONО– |
|
(рис. 13). Озон конденсируется в виде |
|
темно-синей жидкости (т. кип. –111,9 °С) |
Рис. 13. Структура молекулы О3 |
и затвердевает в виде фиолетово-черных |
|
кристаллов (т. пл. –192,5 °С). Как твердый, так и жидкий озон взрываются изза разложения до газообразного кислорода. Газообразный озон также термодинамически неустойчив по отношению к разложению до дикислорода, однако он разлагается даже при 200 °С весьма медленно, если отсутствуют катализаторы и ультрафиолетовое облучение.
Аллотропия серы более обширна и сложна, чем у любого другого элемента (за исключением, пожалуй, углерода после синтеза бесчисленных фуллереновых кластеров). Это обусловлено как большим разнообразием молекулярных форм, существующих благодаря способности серы образовывать цепи –S–S–, так и многочисленными вариантами расположения этих молекул внутри кристалла. Связи S–S
очень разнообразны и подвижны: |
|
||
межатомное |
расстояние |
может |
|
меняться в широком диапазоне (0,180– |
|
||
0,260 нм) в зависимости от числа и |
|
||
кратности связей, в то время как |
|
||
валентные углы S–S–S меняются от 90° |
|
||
до 180°, а диэдральные (двугранные) |
|
||
углы S–S–S–S от 0° до 180° (рис. 14). |
|
||
Ромбическая и моноклинная моди- |
|
||
фикации серы построены из цикли- |
|
||
ческих молекул S8 (рис. 15), которые |
Рис. 14. Участок бесконечной |
||
имеют форму короны. Длины всех |
цепи Sn, показывающий типичные |
||
связей S–S которой равны 0,206 нм и |
значения валентного угла S–S–S |
||
углы –S–S–S– близки к тетраэдрическим |
(106o) и диэдрального угла S–S–S–S |
||
(108°). |
|
|
(83,5o) [3] |
57
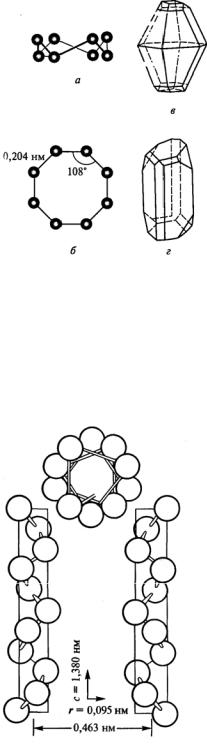
Устойчивая при комнатной темпе- |
|
|||||||
ратуре |
ромбическая сера |
представляет |
|
|||||
собой легкоплавкий светло-желтый |
|
|||||||
порошок плотностью 2,07 г/см3. Он |
|
|||||||
нерастворим в воде и не смачивается |
|
|||||||
водой, плавая по ее поверхности. Сера |
|
|||||||
хорошо растворима в жидком аммиаке, а |
|
|||||||
также в некоторых органических раст- |
|
|||||||
ворителях. При охлаждении до –50 °С |
|
|||||||
ромбическая сераобесцвечи-вается. |
|
|
||||||
При |
охлаждении |
расплавленной |
|
|||||
серы образуются длинные светло-жел- |
|
|||||||
тые иглы |
моноклинной |
модификации |
|
|||||
(плотность 1,96 г/см3). При комнатной |
Рис. 15. Строение молекулы S8: |
|||||||
температуре |
они неустойчивы: |
иглы, |
||||||
хотя и |
сохраняют прежнюю форму, |
а – вид сбоку; б – вид сверху; |
||||||
в – форма кристаллов |
||||||||
теряют |
прозрачность и |
блеск, |
пре- |
|||||
ромбической серы; |
||||||||
вращаясь в конгломерат мелких крис- |
||||||||
г – форма кристаллов |
||||||||
таллов ромбической серы. |
|
|
||||||
|
|
моноклинной серы [1] |
||||||
При закалке, т. е. быстром охлаж- |
||||||||
|
||||||||
дении расплавленной серы, предвари- |
|
|||||||
тельно нагретой до температуры кипе- |
|
|||||||
ния, образуется метастабильная пласти- |
|
|||||||
ческая |
модификация, |
образованная |
|
|||||
спиральными |
цепями |
из |
атомов S |
|
||||
(рис. 16). В пластической сере эти |
|
|||||||
цепочки большей частью скручены и |
|
|||||||
вытянуты в одном направлении. Тон- |
|
|||||||
кие нити, полученные при выливании |
|
|||||||
кипящего расплава в холодную воду, |
|
|||||||
удается растянуть в 15 раз. Со време- |
|
|||||||
нем эта модификация постепенно пере- |
|
|||||||
ходит обратно в ромбическую серу. |
|
|||||||
Помимо циклических молекул S8 |
|
|||||||
известно большое количество модифи- |
|
|||||||
каций Sn с размером цикла n = 6 – 20. |
|
|||||||
Например, в растворах ромбической |
Рис. 16. Строение левых и правых |
|||||||
серы в полярных растворителях (мета- |
||||||||
ноле, |
ацетонитриле) |
присутствует |
спиралей S∞ [3] |
|||||
примерно 1 % серы S7 (рис. 17). Общим
методом синтеза цикла размером (х + у)служит взаимодействие сульфана H2Sx с хлоридом SyCl2, например:
58
H2S8 + S4Cl12 = S12 + 2НС1
Полиморфизм селена и теллура связан с многообразием способов упаковки молекулярных цепей и циклов в кристаллах. Красные моноклинные модификации селена (α, β, γ), образующиеся при кристаллизации растворов селена в сероуглероде, состоят из циклических гофрированных молекул Se8, похожих на S8, и не проводят электрический ток. Аморфный красный селен осаждается из водных растворов его соединений действием SO2 и других восстановителей.
Рис. 17. Молекулярная структура цикло-Sn: а) S7, б) S12, в) S18, г) S20 [3]
Наиболее термодинамически устойчива серая гексагональная (элементарный объем представляет собой ортогональную призму с основаниями в виде правильных шестиугольников) модификация селена обладающая металлическим блеском (tпл = 220 °С). Она образуется при нагревании всех остальных модификаций. Серый селен состоит из неразветвленных спиральных полимерных цепей Sen, в которых каждый атом селена соединен ковалентными связями с двумя ближайшими соседями.
Для теллура существует только одна гексагональная модификация, аналогичная гексагональной модификации селена и также состоящая из бесконечных параллельных спиральных цепей. Отдельных молекул свободный теллур не образует. Между цепями действуют слабые
59
межмолекулярные силы, поэтому Те, как и Se, плавится при сравнительно низких температурах.
3.1.2. Нахождение в природе и получение
Основным источником кислорода в виде простого вещества (О2 и О3) служит прежде всего атмосфера Земли, значительное его количество растворено в гидросфере. Помимо этого кислород присутствует в земной коре в виде различных соединений, составляя 45,5 мас. % земной коры.
В промышленности кислород получают из воздуха путем криогенной ректификации. Выбор лабораторного способа получения кислорода зависит от необходимого количества газа и его чистоты. Многие соли оксокислот при нагревании разлагаются с выделением кислорода, например, хлорат калия KClO3 (бертолетова соль):
2KClO3 → 2KCl + 3O2.
Наиболее часто применяется термическое разложение перманганата калия KMnO4:
2KMnO4 → K2MnO4 + MnO2 + O2↑.
Так же часто используется каталитическое разложение пероксида водорода в присутствии оксида марганца (IV):
2H2O2 → 2H2O + O2↑.
Озон образуется при действии на кислород электрического разряда или ультрафиолетового излучения. Их разделяют фракционной перегонкой сжиженной смеси O3 – O2. В лаборатории смесь озона с кислородом (5–15% O3) получают при тихом разряде переменного тока высокого напряжения (8000 В) или при электролизе эвтектической смеси хлорной кислоты HClO4, перхлората магния Mg(ClO4)2 и воды при –50 °С (>20 % O3). В атмосфере озон образуется из кислорода под действием солнечного ультрафиолетового излучения, на высоте 15–25 км его концентрация достигает 27 масс. %. Озоновый слой защищает живые организмы от действия жесткого ультрафиолетового излучения.
Содержание серы в земной коре составляет 0,0340 %, главным образом в виде соединений. Она занимает шестнадцатое место по распространенности среди химических элементов вслед за барием (0,0390 %) и стронцием (0,0384 %); содержание серы в земной коре примерно вдвое выше, чем у следующегозанеюуглерода(0,0180 %).
Три наиболее важных промышленных источника серы.
1.Элементарная сера (простое вещество) на шапках соляных куполов
вСША и Мексике и осажденные эвапоритовые отложения на юго-востоке Польши.
2.H2S в природном газе и сырой нефти, серосодержащие органические соединения нефтьсодержащих сланцев и угля. Добыча серы из природного газа начинается с отделения сероводорода абсорбцией в моноэтаноламине. Затем третья часть сероводорода сжигается для получе-
60
