
- •Annotation
- •1 Аналіз способів очистки питних вод
- •1.3.1 Джерела забруднення поверхневих вод суші
- •Значення води для здоров’я людини
- •2.1.1 Джерела забруднення вод та вплив забруднення на здоров'я людини
- •2.1.2 Вплив на людину хімічного складу води
- •2.2 Економія водних ресурсів
- •2.3 Різновиди колодязів та їх будова
- •7 Дощата обшивка оголовка
- •3 Відстійник; 4гирло; 5оголовок; 6шахта (для установки арматури)
- •2.4 Захворювання, що спричиняє хлор
- •2.4.1 Проблема хлорування води
- •3 Методологія стерилізації води
- •3.1 Хлорування
- •3.2 Озонування
- •3.4 Знезараження питної колодязної (криничної) води дезінфікація колодязя (криниці)
- •4 Розрахунок еколого-економічних показників стерилізації води
- •4.1 Дезінфекція шахтних колодязів
- •4.2 Знезараження води при децентралізованому водопостачанні із застосуванням дезінфекційного засобу «Жавель-Клейд»
- •5 Охорона праці
- •5.1 Технічні рішення щодо безпеки при проведенні досліджень
- •5.2 Технічні рішення з гігієни праці та виробничої санітарії
- •5.2.1 Мікроклімат
- •5.2.2 Виробниче освітлення
- •5.2.3 Виробничий шум
- •5.2.4 Виробничі випромінювання
- •5.3 Пожежна безпека
- •5.3.1 Технічні рішення системи запобігання пожеж
- •5.3.2 Технічні рішення систем попередження пожеж і протипожежного захисту
- •6 Технологічна вода та стічні води
- •6.1 Характеристика стічних вод окремих виробництв
- •6.2 Вимоги до якості води, що скидається в централізовані біологічні очисні споруди та природні водойми
- •6.3 Основні методи очистки стічних вод
- •7 Розрахунок економічної ефективності
- •7.1 Розрахунок економічної ефективності антрацит-фільтрату у порівнянні з кварцовим піском
- •7.2 Вартість фільтруючого завантаження
- •7.2.1 Вартість електроенергії, затрачуваної на промивання фільтруючого завантаження
- •7.2.2 Вартість води, що витрачає на промивання фільтрів
- •7.2.3 Фактичні витрати при експлуатації фільтрів з піщаним і антрацитовим завантаженнями
- •7.2.4 Розрахунок окупності витрат
- •7.2.5 Розрахунок прибутку
- •7.3 Визначення госпрозрахункової порівняльної й загальної ефективності капітальних вкладень
- •7.3.1 Розрахунок приведених витрат
- •7.3.2 Розрахунок коефіцієнта порівняльної ефективності
- •7.3.3 Розрахунок терміну окупності додаткових капітальних вкладень
- •7.3.4 Розрахунок науково-технічного ефекту антрацит-фільтрату
- •8 Вибір методу очищення стічних вод
- •8.1 Визначення розрахункових витрат стічних вод
- •8.2 Визначення концентрації забруднень
- •8.3 Розрахунок коефіцієнта змішання води водойми зі стічними водами
- •8.4 Визначення необхідного ступеню очищення стічних вод
- •8.4.1 Визначення необхідного ступеню очищення стічних вод за вмістом завислих речовин
- •8.4.2 Розрахунок необхідного ступеню очищення стічних вод за бпк
- •8.4.3 Визначення необхідного ступеню очищення стічних вод за розчиненим у воді водойми киснем
- •Висновки
- •Список використаних джерел
- •Додаток а Технічне завдання Міністерство освіти і науки України
- •Технічне завдання
- •Додаток б Деякі показники якості води
- •Додаток в Оцінка найбільш ефективних способів покращення якості питної води серед різних груп експертів
- •Додаток г Вимоги до якості води централізованого господарсько-питного водопостачання
- •Додаток д Закони України які регулюють водогосподарську діядьність
- •Додаток е
- •Додаток є Викиди шкідливих речовин та розміщення відходів не відбувається
1.3.1 Джерела забруднення поверхневих вод суші
Процеси забруднення гідросфери пов’язані з різними чинниками, проте основними джерелами є промислові підприємства, річковий транспорт, сільське та комунальне господарство. Крім того, поверхневі води можуть забруднюватись через атмосферні опади, внаслідок скидання теплих вод, які використовуються для охолодження на ТЕС і АЕС, міськими зливовими стоками, хімікатами під час їх транспортування, водами шахт і рудників. Також для України після аварії на Чорнобильській АЕС в 1986 році постало питання радіоактивного забруднення.
Всі різноманітні забруднюючі речовини, які потрапляють до поверхневих вод, можна представити наступною схемою (рис. 1.1).
Отже, як видно з рисунку 1.1, поверхневі води є акумуляторами досить великої кількості різноманітних забруднюючих та токсичних речовин різного походження.
Надзвичайно великої шкоди водоймам та водотокам завдають неочищені стічні води. В Україні скидається у водні об’єкти близько 17,4 км 3 стічних вод за рік, які містять 5273 тис. т розчинених речовин [4].
Промислові стічні води забруднюють екосистеми найрізноманітнішими компонентами в залежності від специфіки галузей промисловості. В таблиці 1.1 наведені пріоритетні забруднювачі водних екосистем за галузями промисловості.
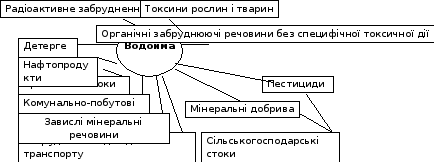
Рисунок 1.1 – Забруднюючі речовини поверхневих вод [4]
Таблиця 1.1 – Пріоритетні забруднювачі водних екосистем за галузями промисловості [3]
|
Галузь промисловості |
Пріоритетні забруднювачі |
|
Нафтогазове видобування, нафтопереробка |
нафтопродукти, СПАР, феноли, амонійні солі, сульфіди |
|
Целюлозно-паперова, лісова промисловість |
сульфати, органічні речовини, азот, лігніни, смоли та жири |
|
Машинобудування, металообробка, металургія |
важкі метали, завислі речовини, фториди, ціаніди, амонійний азот, нафтопродукти, смоли, фенол |
|
Хімічна промисловість |
феноли, нафтопродукти, СПАР, ароматичні вуглеводні, неорганіка |
|
Гірничо-видобувна, вугільна промисловість |
флотореагенти, неорганіка, феноли, завислі речовини |
|
Легка, текстильна, харчова промисловість |
СПАР, нафтопродукти, органічні фарбники, іншу органічні речовини |
З таблиці 1.1 можна зробити висновок, що промислові підприємства скидають у поверхневі води велику різноманітність небезпечних токсичних речовин специфічної дії, що ускладнює їх детоксикацію.
Основні чинники впливу сільськогосподарського виробництва на поверхневі води – це внесення добрив, отрутохімікатів, тваринницькі комплекси та ерозія ґрунту. Щорічні надходження мінеральних добрив на поля в Україні становлять більше 90 тис т. пестицидів – 4,5 млн. т Із них лише 5-10 % поглинається рослинами, решта 90-95 % змивається дощами й талими водами, здувається вітрами й потрапляє в річки, озера, ґрунтові води, стаючи шкідливими компонентами екосистеми. Із 170 найменувань отрутохімікатів, які використовуються в Україні 49 є особливо небезпечними [1].
У результаті сьогодні водойми забруднені сполуками азоту, фосфору, калію, часто радіоактивними елементами (містяться у фосфорних мінеральних добривах), іноді важкими металами (міддю, цинком). Сумарна міграція азоту вниз із ґрунтового шару може становити 10 – 80 %, калію -30 %, фосфору – 6%. Причому втрати добрив на легких піщаних ґрунтах у 8 – 12 разів більші, ніж на важких глинястих [4].
Дуже напружена екологічна обстановка склалась навколо ферм і тваринницьких комплексів, яких в Україні налічується понад 45 тис. річний вихід гною становить близько 300 млн. м³, де вміст азоту – до 1,5 млн. т. Не менше 10% цього азоту в процесі зберігання, транспортування та утилізації зливається та фільтрується в поверхневі води. У перерахунку на нітратне забруднення в навколишнє середовище щорічно надходить 450 тис. т азотних сполук [4]. У водоймах, які забруднюються стічними водами тваринницьких комплексів, вміст аміаку може коливатись від 0,05 до 1,0 мг/дм³ і більше, нітритів – від 0,01 до 0,09 і вище, нітратів – до 5-10 мг/дм³ [7].
Приблизно 90 % води, що використовується в містах, викидається в забрудненому стані в річки та водойми. Середня концентрація забруднюючих речовин в стічних водах комунально-побутового сектора становить близько 1 кг/м3, причому близько 50 % речовин знаходиться в розчиненому стані.
Щорічно у водойми України скидається близько 4 млрд. м3 забруднених стоків. Теоретично наявні методи дають можливість очистити стічні води на 95–96%, але на практиці – 70–85%. Найбільшу кількість стічних вод скидають міста Маріуполь (253,8 млн. м3), Дніпропетровськ (188 млн. м3), Запоріжжя (65 млн. м3), Київ (29 млн. м3). основні причини забруднення – застаріле обладнання, відсутність очисних споруд, аварійні скиди (їх буває понад 250 на рік) [15].
Матеріали та методи дослідження
Хімічний аналіз води
Хімічний аналіз води поділяється на якісний і кількісний. Завдання якісного аналізу – встановлення якісного складу домішок. Кількісний аналіз дає можливість оцінити кількісний вміст домішок у воді [6].
Якісний аналіз дає відповідь типу «так-ні». Його виконують додаванням у дослідну пробу води реактиву (реагенту), який вступає в реакцію з визначуваною домішкою води, що супроводжується характерною зміною системи (поява чи зміна забарвлення, помутніння). В ряді випадків проведення якісного аналізу буває достатнім, щоб установити придатність води для певних цілей.
Якісний аналіз також дає можливість правильно обрати метод кількісного аналізу. Більшість методів визначення кількісного вмісту домішок призводять до помилкових результатів у присутності елементів, які мають певний вплив.
Найпоширенішими методами кількісного аналізу є гравіметричний, об’ємний (титриметричний) та фізико-хімічний.
Гравіметричний аналіз виконується додаванням у пробу надлишку реактиву (тобто із запасом), який утворює з визначуваною речовиною малорозчинну сполуку, що дає осад. Останній відфільтровують, висушують, визначають його масу.
Характерною особливістю гравіметричного аналізу є додавання до проби води надлишку реактиву для забезпечення повноти реакції його з визначуваним компонентом. Реактив повинен бути селективним, тобто реагувати тільки з визначуваною домішкою.
Принцип об’ємного аналізу полягає в тому, що визначувана речовина вступає в хімічну взаємодію з реактивом, який додають у пробу води у вигляді розчину точно відомої концентрації (титрований розчин) і в кількості, що еквівалентна кількості визначуваної речовини. Процес приливання реактиву у аналізовану воду називається титруванням. Кінець реакції між титрованим розчином реактиву і визначуваною речовиною встановлюють за зміною забарвлення індикатора, який додають у воду як допоміжний реактив.
Для обчислення результату аналізу необхідно знати точні об’єми розчинів речовин, які беруть участь у реакції (титрованого розчину і проби води). Формула (1.1) для розрахунку має вигляд:
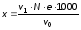 ,
(1.1)
,
(1.1)
де х – кількість визначуваної речовини, мг/дм3; v1– об’єм титрованого розчину, витраченого на титрування проби досліджуваної води, см3; N – молярна концентрація еквівалента реактиву (титрованого розчину), моль/дм3; емолярна маса еквівалента визначуваного компонента, г/моль; v0– об’єм досліджуваної води, що взяли для титрування, см3.
У тих випадках, коли визначувана речовина є у воді в дуже малій кількості, найдоцільнішими є методи фізико-хімічного аналізу. Особливо поширені методи колориметрії та нефелометрії.
Методами колориметрії концентрацію речовини, якщо вона забарвлена, можна визначити безпосередньо, порівнюючи інтенсивність забарвлення зі стандартом (тобто із розчином з відомою концентрацією речовини). В інших випадках у досліджувану воду додають реактив, який вступає в реакцію з визначуваною речовиною і утворює забарвлену сполуку. Порівнюючи забарвлення досліджуваної води із стандартом, до якого введено той самий реактив, встановлюють концентрацію визначуваної речовини.
Порівнюючи інтенсивності забарвлення, використовують головним чином такі методи: метод кольорової шкали, метод порівняння забарвлення, фотоколориметричний.
При використанні методу кольорової шкали забарвлення досліджуваної проби води порівнюється із забарвленням серії стандартних розчинів, виготовлених таким самим способом. Аналіз виконується у скляних посудинах, які заповнюються досліджуваною водою і стандартними розчинами. Концентрація визначуваної речовини у воді дорівнює концентрації стандартного розчину, з кольором якого збігається колір проби води.
При застосуванні методу порівняння забарвлення порівнюється інтенсивність забарвлення проби води і стандартного розчину, які можуть значно різнитися між собою. Порівняння проводять у спеціальних колориметричних циліндрах (циліндри Генера) із маленькими кранами, що розміщені у нижній частині циліндра. Висоту стовпа рідини в кожному циліндрі регулюють через відливання таким чином, щоб інтенсивності кольорів у обох циліндрах при розгляданні рідини зверху зрівнялись.
При досягненні однакової інтенсивності забарвлення мають місце співвідношення такі формули (1.2) та (1.3):
Сст hст = Св hв (1.2)
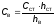 ,
(1.3)
,
(1.3)
де Ссті Св– концентрації відповідно стандартного розчину і досліджуваної води; hст і hв– висота стовпа відповідно стандартного розчину і води.
Методами хімічного аналізу визначають фізичні і хімічні показники якості води.
До фізичних показників належать: температура води, вміст завислих речовин, забарвлення, запах і смак; до хімічних – активна реакція води (рН), перманганатна окислюваність, хімічне споживання кисню (ХСК), біохімічне споживання кисню (БСК), наявність азотвмісних речовин, розчинені у воді гази, щільний залишок і втрата при прожарюванні, жорсткість, лужність, вміст у воді сульфатів, хлоридів, заліза, марганцю та інших елементів [7].
Бактеріологічний аналіз
При бактеріологічному аналізі води визначають кількість сапрофітних (нехвороботворних) бактерій і бактерій групи кишкової палички Escherichia coli, які характеризують фекальне забруднення води. Розрізняють такі бактеріологічні показники якості води:
1) ЗМЧ загальна кількість сапрофітних бактерій в 1 см3 води; цей показник називають також загальним мікробним числом;
2) БГКП (колі-індекс) кількість бактерій групи кишкової палички, яка міститься в 1 дм3води.
Технологічний аналіз
В сучасних умовах отримання води певної якості здійснюється за складною хімічною технологію, в якій застосовується велика кількість різних реагентів, матеріалів, фізичних агентів і різноманітні споруди.
У результаті цих дій властивості води зазнають значних змін, які важко передбачити, але необхідно брати до уваги, щоб забезпечити потрібний ефект очистки. Ці так звані технологічні властивості води визначають методами технологічного аналізу. За допомогою такого аналізу серед кількох можливих методів коригування певного показника якості води вибирають найбільш ефективний та економічний, встановлюють необхідну дозу реагенту, визначають кінетику осаду зависів, швидкість протікання води в різних спорудах, динаміку збільшення втрат напору у фільтрувальних спорудах тощо. Незнання технологічних властивостей води може призвести до значних помилок при проектуванні водоочисних станцій.
При використанні найуживаніших технологічних схем очищення води необхідно мати дані про параметри, які характеризують її технологічні властивості: коагульованість, знебарвлення, осаджуваність зависі, фільтрованість, знезалізення, пом’якшення, стабільність, хлорованість. Ці дані отримують в результаті технологічного аналізу води [6].
Визначення фізичних показників якості води
Температура води – важливий фактор, що впливає на фізичні, хімічні, біохімічні та біологічні процеси, які відбуваються у водоймах. Від неї значною мірою залежить кисневий режим водойми, інтенсивність процесів самоочищення тощо. На температуру води зважають при розрахунках багатьох очисних споруд.
Для питних цілей оптимальною є температура 7...11 С. Цій умові найбільш відповідають підземні води. Вони, як правило, характеризуються сталістю температури, котра при глибині залягання водоносного шару більше ніж 200 м складає 6...10С. Для поверхневих вод властиві значні сезонні перепади температури – в середньому від 0,1 до 30С. Вимірювання температури проводять одночасно з відбором проби води з джерела. Там, де це неможливо, температуру вимірюють у бутлі вмістом не менш як 1000 см3, яку перед відбором проби витримують у досліджуваній воді для зрівняння температур.
Для вимірювання використовують калібровані ртутні термометри з ціною поділки 0,1...0,5 С. Результат виражають в градусах Цельсія, знак ставиться тільки при температурах, нижчих за нуль [6].
Прозорість води
Прозорість води визначають якісно і кількісно для озер, а для річок тільки якісно [15]. Якісну характеристику прозорості води визначають візуально (неозброєним оком або за допомогою приладів). Для цього в одно літрову посудину з прозорого скла наливають досліджувану воду і розглядають на світло. Оцінку дають за такою шкалою:
дуже прозора – коли немає будь-яких найменших часточок у воді; прозора – коли є невелика кількість дрібненьких часточок;
слабо каламутна – коли добре видно роздріблені частинки;
дуже каламутна – коли роздрібнених частинок так багато, що проба води майже непрозора.
Для кількісного визначення прозорості води користуються більше диском, який занурюють у воду на шнурі з тіньового боку човна. Занурюючи диск, спостерігають, коли він зникне з очей. Глибину, на якій диск перестає бути видно, вимірюють у сантиметрах і вважають прозорість води. Якщо глибина водойми настільки мала, що диск лягає на дно раніше, ніж зникає з очей, то визначають прозорість “до дна”, а в дужках поряд зазначають глибину в сантиметрах [6].
Кольоровість води
Кольоровість води визначають у прозорій воді. Якщо вода не прозора, її фільтрують. У пробірку наливають майже повно води, ставлять її на аркуш білого паперу і, спостерігаючи зверху вниз, оцінюють воду щодо кольору так: безбарвна, світложовта, жовта, зеленувата, бура тощо.
Кількісне визначення кольоровості води проводять способом порівняння досліджуваної води з стандартом – платино-кобальтовим розчином. Для цього беруть два одинакові циліндри заввишки 20 см і об’ємом 100 мл. В один наливають досліджуваної води, а в другий таку саму кількість стандартного розчину, ставлять циліндри на аркуш білого паперу і порівнюють їх кольори. Якщо кольори не одинакові, то з досліджуваною водою порівнюють другий зразок стандартного розчину і так роблять доти , поки бідберуть стандарт потрібного кольору. Підібравши колір стандартного розчину до досліджуваного, визначають градуси кольоровості води за стандартом [7].
Методика визначення смаку
Смак води визначають органолептично: 10...15 см3води, підігрітої до 30С, кілька секунд утримують у роті, визначаючи якісну характеристику смаку і оцінюючи його інтенсивність [7].
При оцінці смаку рекомендована така шкала:
|
1. Надзвичайно неприємний. 2. Дуже неприємний. 3. Неприємний. 4. Злегка неприємний. 5. Не неприємний. |
6. Злегка приємний. 7. Приємний. 8. Дуже приємний. 9.Надзвичайно приємний. |
Для оцінки можуть застосовуватись також бальні шкали. Наприклад, смак еталонного зразка має показник 20 балів, а втроє неприємніший – 60 балів і т. ін
Способи очищення питної води
Одного дотримання гранично доступних концентрацій недостатньо для за без-печення якості води.
Класифікація питної води дуже складна, але необхідна.
Є багато типів очищення води :
1) Механічні способи очищення – застосовується для очищення води твердих та масляних забруднень. Механічне очищення здійснюється за одним із таких методів:
1. подрібнення великих за розміром забруднень у менші за допомогою механічних пристроїв;
2. відстоювання забруднень зі стоків за допомогою нафтовловлювачів, пісковловлювачей та інших відстійників;
3. розділення води та забруднювачів за допомогою цинтрефуг та гідро-циклонів;
4. усередненя стоків чистою водою з метою зниження концентрації шкідливих речовин та домішок до рівня, при котрому стоки можна скидати у водойми або каналізацію;
5. влучення механічних домішок за допомогою елеваторів, решіток, скребків та інших пристроїв;
6. фільтрування стоків через сітки,сита, спеціальні фільтри, а найчастіше – шляхом пропускання їх через пісок;
7. освітлення води шляхом пропускання її через пісок або спеціальні пристрої, наповнені композиціями або мінералами, здатними поглинати завислі частки.
Вибір схеми очищення води від завислих часток та нафтопродуктів залежить від виду та кількості забруднень, необхідного ступеня очищення [8].
2) Фізико-механічні способи очищення стоків та води базуються на флотації, мембраннних методах очищення, азотропній відгонці.
- Флотація – процес молекулярного прилипання частинок забруднень до поверхні розподілу двох фаз (вода – повітря, вода – тверда речовина). Процес очищення СПАР, нафтопродуктів, волокнистих матеріалів флотацією полягає в утворенні системи «частинки забруднень – бульбашки повітря», що спливає на поверхню та утилізується. За принципом дії флотаційні установки класифікуються так:
- флотація з механічним диспергуванням повітря;
- флотація з подачею повітря через пористі матеріали;
- електрофлотація;
- біологічна флотація.
- зворотний осмос (гіперфільтрація) – процес фільтрування питної води через напівпроникні мембрани під тиском.
3) Ультрафільтрація – мембранний процес розподілу розчинів, осмотичний тиск котрих малий. Застосовується для очищення питної води від високомолекулярних речовин, завислих частинок та колоїдів.
1. Електродіаліз – процес сепарації іонів солей в мембранному апараті, котрий здійснюється під впливом постійного електричного струму. Електродіаліз застосовується для демінералізації питної води. Основним обладнанням є електродіалізатори, що складаються з катіонітових та аніонітових мембран.
2. Хімічне очищення використовується як самостійний метод або як попередній фізико-хімічним та біологічним очищенням. Його використовують для зниження корозійної активності питної води, видалення з них важких металів, очищення стоків гальванічних дільниць, для окиснення сірководню та органічних речовин, для дезинфекції води та її знебарвлення.
3. Нейтралізація застосовується для очищення стоків гальванічних, травильних та інших виробництв, де застосовуються кислоти та луги.
4. Окислення застосовується для знезараження питної від токсичних домішок (мідь, цинк, сірководень, сульфіди), а також від органічних сполук. Окиснювачами є хлор, азот кисень, хлорне вапно, гіпохлорид кальцію тощо [8].
4) Фізико-хімічні методи:
1. Коагуляція – процес з’єднання дрібних частинок забруднювачів в більші за допомогою коагулянтів. Для позитивно заряджених частинок коагулюючими іонами є аніони, а для негативно заряджених – катіони. Коагулянтами є вапняне молоко, солі алюмінію, заліза, магнію, цинку, сірчанокислого газу тощо.
2. Флокуляція – процес агрегації дрібних частинок забруднювачів у воді за рахунок утворення містків між ними та молекулами флокулянтів. Флокулянтами є активна кремнієва кислота, ефіри, крохмаль, целюлоза, синтетичні органічні полімери [9].
Для освітлення води одночасно використовуються кроагулянти та флокулянти, наприклад, сірчанокислий алюміній та поліакриламід. Коагуляція та флокуляція здійснюється у спеціальних ємностях та камерах.
При очищенні води використовується і електрокоагуляція – процес укрупнення частинок забруднювачів під дією постійного електричного струму.
3. Сорбція процес поглинання забруднень твердими та рідкими сорбентами (активованим вугіллям, золою, дрібним коксом, торфом, селікагелем, активною глиною тощо).
Адсорбційні властивості сорбентів залежить від структури пор, їхньої величини, розподілу за розмірами, природи утворення.
Активність сорбентів характеризується кількістю забруднень, що поглинаються на одиницю їхнього об’єму або маси (кг/м, кубічний) [10].
Після механічних, хімічних та фізико-хімічних методів очищення у питної води можуть знаходитись різноманітні віруси та бактерії (дизентирійні бактерії, холерний вібріон, збудники черевного тифу, вірус поліоміеліту, вірус гепатиту, цитато-генний вірус, аденовірус, віруси, що викликають захворювання очей). Тому з метою запобігання захворюванням питну воду перед повторним використанням для побутових потреб підлягають біологічному очищенню.
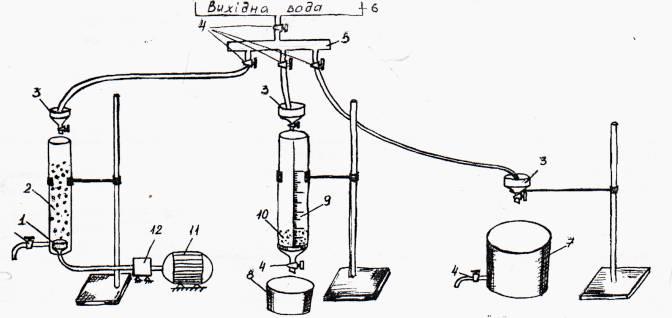
Рисунок 1.2– Експериментальна установка для очищення води
1 – розпилювач повітря; 7 – відстійник;
2 – аератор; 8 – приймальна склянка;
3 – дозувальна воронка; 9 – фільтрувальна колонка;
4 – пробкові крани; 10 – пісчаний фільтр;
5 – колектор; 11 – електродвигун;
6 – ємність для вихідної води; 12 – компресор.
Процес очищення питної води від Заліза:
Залізо постійно присутнє у поверхневих і підземних водах у вигляді солей Fе (ІІ) і солей F (ІІІ), тобто у вигляді іонів Fе2+і Fе3+. Підвищена кількість заліза у воді надає їй буре забарвлення і «залізний» присмак.
Експериментальна установка представлена (рис. 1.2), де змінними параметрами процесу прийняли аерацію, фільтрування, а також відстоювання води/
Аерацію води проводять у аераторі 2, в нижній частині якого змонтований розпилювач стиснутого повітря. Колонка змонтована на штативі, подачу води в аератор здійснювали за допомогою дозувальної воронки 3. Необхідне для процесу стиснуте повітря одержували за допомогою компресору 12, приводом якого є електродвигун 11. Вихідна вода подавалась в установку з баку 6 через колектор 5 і запірні пристрої – пробкові крани 4.
Фільтрування проводять на фільтрувальній установці. Вона включала в себе пристрій в якому можна було змінювати висоту шару пісчаного фільтру від 50 до 150 мм. Пристрій включає вертикальну колону з міліметровою шкалою. В нижній частин колони змонтоване перфороване днище, яке удержувало пісчаний фільтр з розміром часток 0,5-1,5 мм. Нижче перфорованого днища розташована конусна частина фільтру з пробковим краном для зливу фільтрувальної води, подачу води у фільтрувальну колону здійснювали за допомогою напорної склянки 6 з пробковим краном.
Експериментальна установка включала також відстійник 7 для зливу відстояної води. Подачу води у відстійник здійснювали за допомогою воронки 3 [8].
