- •Вопрос№1Важнейшие классы неорганических соединений. Оксиды, гидроксиды, кислоты, соли.
- •Вопрос№3 Химическая термодинамика. Основные понятия. Внутренняя энергия и энтальпия. Первый закон термодинамики.
- •Вопрос№4 Тепловой эффект химической реакции. Теплота образования вещества. Закон Гесса и следствие из закона Гесса.
- •Следствия из закона Гесса
- •Вопрос№5 Энтропия вещества из системы - мера беспорядка расположения в них частиц.
- •Границы применимости понимания энтропии как меры беспорядка
- •Билет№11 Химические реакции необратимые и обратимые. Химическое равновесие. Закон действия масс для обратимых гомогенных и гетерогенных химических реакций
- •Гетерогенные и гомогенные реакции.
- •Билет№13 Константа химического равновесия и её связь с изменением изобарного потенциала (свободной энергией Гиббса). Выявление возможности протекания реакции в данном направлении.
- •Электролиты и неэлектролиты. Растворы электролитов
- •Вопрос№17 Свойства разбавленных растворов электролитов. Степень диссоциации, константа диссоциации, изотопических коэффициент.
- •Билет №20 Обменные реакции в растворах электролитов. Условие необратимости реакций.
- •Билет №21 Гидролиз солями обратимый и не обратимый.
- •Билет №22 Электрохимические системы. Окислительно-восстановительные реакции. Составление уравнений. Электронный баланс.
- •Окисление, восстановление
- •Билет №26 Стандартные электродные потенциалы. Ряд напряжений и его возможности для характеристики химических свойств веществ.
Билет №20 Обменные реакции в растворах электролитов. Условие необратимости реакций.
В обменных реакциях, протекающих в растворах электролитов, наряду с недиссоциированными молекулами слабых электролитов, твердыми веществами и газами участвуют также находящиеся в растворе ионы. Поэтому сущность протекающих процессов наиболее полно выражается при записи их в форме ионно-молекулярных уравнений. Например, уравнения реакций нейтрализации сильных кислот щелочами
HClO4 + NaOH →NaClO4 + H2O,
2HNO3 + Ba(OH)2 → Ba(NO3)2 + 2H2O,
выражаются одним и тем же ионно-молекулярным уравнением
H+ + OH– → H2O,
из которого следует, что сущность этих процессов сводится к образованию из ионов водорода и гидроксид-ионов малодиссоциированного электролита – воды. Аналогично уравнения реакций
BaCl2 +H2SO4 → BaSO4 + 2HCl,
Ba(NO3)2 + Na2SO4 → BaSO4 + 2NaNO3
выражают один и тот же процесс образования из ионов Ва2+ и SO42— осадка малорастворимого электролита – сульфата бария
Ва2+ + SO42– → BaSO4↓.
На основании рассмотренных примеров можно сделать следующий вывод: реакции в растворах электролитов всегда идут в сторону образования наименее диссоциированных или наименее растворимых веществ. Из этого, в частности, следует, что сильные кислоты вытесняют слабые из растворов их солей
Реакции в растворах электролитов идут до конца если в результате взаимодействия веществ происходит образование осадка, выделение газа и образование слабого электролита. При написании ионно-молекулярных уравнений реакций, слабые электролиты, малорастворимые соединения и газы записываются в молекулярной форме, а находящиеся в растворесильные электролиты – в виде составляющих их ионов.
Условия необратимости реакций (условия протекания реакций до конца): 1. Образование осадка. К2SО4 + BаСl2 BaSО4 + 2КСl 2К+ + SО42- + Bа2+ + 2Сl- BаSО4 + 2К+ + 2Сl- SО42- + Bа2- BаSО4 2. Выделение газа. Na2S + 2HCl 2NaCl + H2S 2Na+ + S2- + 2H+ + 2Cl- 2Na+ + 2Cl- + H2S S2- + 2H+ H2S 3. Образование малодиссоциирующего соединения (слабого электролита или воды). NaOH + HCl NaCl + H2O Na+ + OH- + H+ + Cl- Na+ + Cl- + H2O OH- + H+ H2O 4. Образование комплексного соединения. NaOH + Al(OH)3 NaAl(OH)4 Na+ + OH- + Al(OH)3 Na+ + Al(OH)4- OH- + Al(OH)3 Al(OH)4- Следовательно, реакции идут с образованием веществ с меньшей концентрацией ионов в растворе. В соответствии с законом действующих масс скорость реакции прямопропорциональна произведению концентрации реагирующих веществ. Следовательно, не возможность протекания обратной реакции в случае её необратимости объясняется тем, что концентрациях ионов в растворе уменьшается (ионы связываются в молекулы неэлектролитов), скорость обратной реакции стремится к нулю. Вывод: реакции в растворах электролитов могут протекать лишь только в том случае, если участвующие во взаимодействии ионы полностью или частично уходят из сферы реакции (в виде газа, осадка, слабого электролита или комплексного соединения).
Билет №21 Гидролиз солями обратимый и не обратимый.
Гидро́лиз (от др.-греч. ὕδωρ — вода + λύσις — разложение) — один из видов химических реакций сольволиза, где при взаимодействии веществ с водой происходит разложение исходного вещества с образованием новых соединений. Механизм гидролиза соединений различных классов: соли, углеводы, белки, сложные эфиры, жиры и др. имеет существенные различия.
Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах (преимущественно, водных) растворимых солей-электролитов. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или (реже) молекулярном виде («связывание ионов»).
Различают обратимый и необратимый гидролиз солей[1]:
-
1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону):
![]()
![]()
(раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
-
2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону):
![]()
![]()
(раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
-
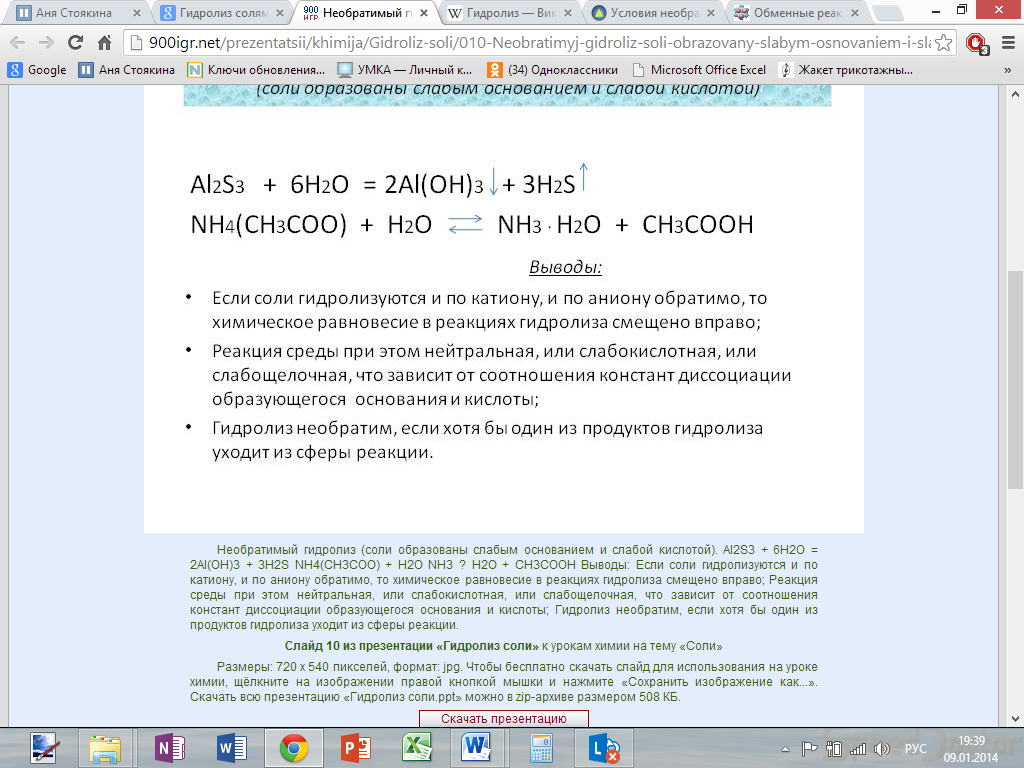
3. Гидролиз соли слабой кислоты и слабого основания:
![]()
![]()
(равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).
-
4. Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален.