
- •Квантовая оптика.
- •1/Тепловое излучение.
- •2/Фотоэффект.
- •3/Эксперименты, подтверждающие квантовые св-ва света.
- •4/Масса и импульс фотонов. Давление света.
- •5/Эффект Комптона.
- •6/Единство корпускулярных и волновых св-в электромагнитного излучения.
- •Элементы атомной физики и квантовой механики.
- •7/Модели атома Томпсона и Резерфорда.
- •8/Линейчатый спектр атома.
- •9/Гипотеза де Бролля.
- •10/Соотношение неопределенности Гейзенберга.
- •11/Волновая ф-я. Вероятность нахождения микрочастицы. Нормировка волн ф-ции.
- •12/Общее ур-ние Шредингера.
- •13/Представление физ величин с помощью операторов.
- •22/ Принцип неразличимости тождественных частиц. Фермионы и бозоны.
- •Распределение электронов по энергетическим уровням атома. Периодическая система элементов Менделеева.
- •23/ Рентгеновские спектры.
- •24/ Вынужденное излучение. Лазеры.
- •25/ Энергетические зоны в твердом теле.
- •26/ Сверхпроводимость.
- •27/ Элементы физики атомного ядра и элементарных частиц. Заряд, размеры и состав атомного ядра. Массовое и зарядовое число.
- •Энергия связи и масса ядра. Спин и магнитный момент.
- •Ядерные силы. Модели ядра.
- •28/ Радиоактивное излучение и его виды. Закон радиоактивного распада. Правило смещения.
- •29/Ядерные реакции и их основные типы.
- •30/Типы взаимодействия элементарных частиц.
- •Частицы и античастицы.
- •Классификация элементарных частиц.
- •Кварки.
Элементы атомной физики и квантовой механики.
7/Модели атома Томпсона и Резерфорда.
Как только Менделеев создал таблицу имени себя встал вопрос об строении атома.
1897 – открыли электрон,
1898 – явление радиоактивного распада,
фотоэлектронной эмиссии, термоэлектронной
эмиссии – показывают что из в-ва вылетают
электроны. Эти явления показывают что
![]() находятся
в атомах.
находятся
в атомах.
Модель пудинг с изюмом.
Положительный заряд
расположен равномерно внутри шарика а
отрицательный произвольным образом в
нем. Полный заряд
![]() равен
положительному (+) заряду пудинга.
равен
положительному (+) заряду пудинга.
1911- Резерфорд исследовал
рассеяние
![]() частиц
на тонкой золотой фольге.
частиц
на тонкой золотой фольге.![]() -
частицы это тяжелые частицы с зарядом
-
частицы это тяжелые частицы с зарядом![]() ,
,![]() .
Пучки
.
Пучки![]() частиц
обладали высокой монохроматичностью.
(рис. 10) Обнаружено что большая часть не
откланяется но одна из 20тыс. частиц
отклоняется на большие углы. На основе
этого выводы: 1) поскольку
частиц
обладали высокой монохроматичностью.
(рис. 10) Обнаружено что большая часть не
откланяется но одна из 20тыс. частиц
отклоняется на большие углы. На основе
этого выводы: 1) поскольку![]() частица
+ частица и она отклоняется то она
взаимодействует с + частицей. 2) Она
тяжелая а значит сталкивается с тяжелой
частицей 3) Т.к отклонение происходит
редко то эта частица должна иметь малое
кол-во.
частица
+ частица и она отклоняется то она
взаимодействует с + частицей. 2) Она
тяжелая а значит сталкивается с тяжелой
частицей 3) Т.к отклонение происходит
редко то эта частица должна иметь малое
кол-во.
На основе этого –
Планетарная модель : атом состоит
из ядра заряженного положительно вокруг
которого![]() .
Поскольку атом нейтрален то заряд ядра
(
.
Поскольку атом нейтрален то заряд ядра
(![]() )
равен сумме зарядов
)
равен сумме зарядов![]() .
Размер ядра
.
Размер ядра![]() ,
а
,
а![]() движутся
по круговым орбитам
движутся
по круговым орбитам![]() .
(рис. 11).
.
(рис. 11).![]() - здесь 2 –неизвестных
- здесь 2 –неизвестных![]() и
и![]() ,
поэтому
,
поэтому![]() бесконечное
кол-во пар решения этого ур-ния, т.е
бесконечное
кол-во пар решения этого ур-ния, т.е![]() может
иметь любую
может
иметь любую![]() и
любой
и
любой![]() .
Если
.
Если![]() излучает то
излучает то![]() и
и![]() уменьшаются, но т.к число решении
бесконечно, то
уменьшаются, но т.к число решении
бесконечно, то![]() может излучать любую энергию, т.е спектр
излучения атома непрерывен, однако по
опыту спектр излучения не взаимодействующих
атомов (разряженных газов) линейчатый,
т.е в спектре присутствуют определенные
дискретные значения длин волн при
движении
может излучать любую энергию, т.е спектр
излучения атома непрерывен, однако по
опыту спектр излучения не взаимодействующих
атомов (разряженных газов) линейчатый,
т.е в спектре присутствуют определенные
дискретные значения длин волн при
движении![]() по круговой орбите. Согласно классической
электродинамики
по круговой орбите. Согласно классической
электродинамики![]() должен постоянно излучать энергию, а
значит приближаться к ядру, т.е атом
должен быть не стабилен что не подтверждено
опытом. Т,е модель противоречит законам
классической механики электродинамики.
должен постоянно излучать энергию, а
значит приближаться к ядру, т.е атом
должен быть не стабилен что не подтверждено
опытом. Т,е модель противоречит законам
классической механики электродинамики.
8/Линейчатый спектр атома.
Исследование спектров
излучения и поглощения газов показало
что спектр не взаимодействующих атомов
представляет собой отдельные спектральные
линии – называемые линейчатыми. (рис.
12) Заметим что линии в спектре образуют
группы – серии – это видно в спектре
атома водорода. В атоме водорода эти
серии хорошо разделены друг от друга.
Расстояние между линиями убывает от
более длинных волн к более коротким
волнам сгущаясь к границе серии. В 1885
Бальмер подобрал эмпирически формулу
описывающую все длины волн в водороде
в видимой области спектра.
![]() ,
,![]() ;
;![]() -
постоянная Ридберга.
-
постоянная Ридберга.![]() .
Позже исследовали другие серии в спектре
атома водорода. Серия Лаймона
.
Позже исследовали другие серии в спектре
атома водорода. Серия Лаймона![]() область
УФ, Бальмер
область
УФ, Бальмер![]() область
видимого света, Остальные ИК Пашина
область
видимого света, Остальные ИК Пашина![]() ,
Брекета
,
Брекета![]() ,
Пфунда
,
Пфунда![]() .
.
Бальмер обобщил
формулу:
![]() -
эмпирическая формула. Внутри каждой
серии
-
эмпирическая формула. Внутри каждой
серии![]() .
.
Постулаты Бора.
Бор в 1913 году предпринял 1-ю попытку построения квантовой теории. Он объединил линейный спектр невзаимодействующих атомов, ядерную модель атома Резерфорда и квантовые хар-ки излучения.
Постулаты:
1. В атоме существуют
такие стационарные состояния, находясь
в которых атом не излучает. Этим состояниям
соответствуют определенные дискретные
значения энергии, скорости, радиуса
![]() .
.![]() двигаясь
ускоренно по круговой орбите не излучает.
двигаясь
ускоренно по круговой орбите не излучает.
2. Правило частот –
при переходе
![]() из
одного стационарного состояния в другое,
испускается или поглощается 1
из
одного стационарного состояния в другое,
испускается или поглощается 1![]() .
Его энергия равна разности этих
стационарных состоянии
.
Его энергия равна разности этих
стационарных состоянии![]() .
Если
.
Если![]() переходит
из состояния с большей энергией в
состояние с меньшей (
переходит
из состояния с большей энергией в
состояние с меньшей (![]() )
то происходит испускание, если наоборот
)
то происходит испускание, если наоборот![]() то
поглощение фотона. Таким образом переходы
то
поглощение фотона. Таким образом переходы![]() из1-го
состояния в другое сопровождается
испусканием или поглощением
из1-го
состояния в другое сопровождается
испусканием или поглощением![]() ,
а набор дискретных значении частот и
длин волн определяет линейчатый спектр
атома водорода.
,
а набор дискретных значении частот и
длин волн определяет линейчатый спектр
атома водорода.![]() ,
,![]() .
.
Опыт Франка и Герца.
Существование дискретных
энергетических уровней атома в первые
доказано 1914году Франком и Герцем. (рис.
13) Из трубки откачали воздух. В ней пары
ртути под давлением
![]() .
В трубе 2 электрода (катод и анод) и 2-е
сетки (
.
В трубе 2 электрода (катод и анод) и 2-е
сетки (![]() )
. между катодом и сеткой 1разность
потенциалов (
)
. между катодом и сеткой 1разность
потенциалов (![]() ).
Между анодом и сеткой 2разность потенциалов
(
).
Между анодом и сеткой 2разность потенциалов
(![]() ).
).![]() вылетают
с катода и ускоряются разностью
потенциалов
вылетают
с катода и ускоряются разностью
потенциалов![]() .
.
(гр. 3) Измеряется
зависимость анодного тока от
![]() .
.![]() которые
ускоряются
которые
ускоряются![]() попадают в область между сетками где
происходит столкновение
попадают в область между сетками где
происходит столкновение![]() с атомами ртути. Объяснить ВаХ можно
если предположить что энергия принимает
определенные дискретные значения. Тогда
атомы ртути могут получить определенные
дискретные значения:
с атомами ртути. Объяснить ВаХ можно
если предположить что энергия принимает
определенные дискретные значения. Тогда
атомы ртути могут получить определенные
дискретные значения:![]() ;
;![]() до
тех пор пока энергия
до
тех пор пока энергия![]()
![]() ;
Происходят упругие столкновения с
атомом ртути. Поскольку масса атома
ртути
;
Происходят упругие столкновения с
атомом ртути. Поскольку масса атома
ртути![]() массы
массы![]() ,
то при столкновении
,
то при столкновении![]() не теряет энергию,
не теряет энергию,![]() проходит
сквозь
проходит
сквозь![]() и в цепи наблюдается анодный ток. С
увеличением
и в цепи наблюдается анодный ток. С
увеличением![]() все
больше
все
больше![]() достигают
анода, увеличение до 4,86эВ. С этого момента
достигают
анода, увеличение до 4,86эВ. С этого момента![]() при столкновении с атомом ртути может
передать энергию
при столкновении с атомом ртути может
передать энергию![]() при этом теряет энергию (не упругое
столкновение) и не может пройти сквозь
при этом теряет энергию (не упругое
столкновение) и не может пройти сквозь![]() между
анодом и 2-ой сеткой, поэтому ток резко
уменьшается. С увеличением
между
анодом и 2-ой сеткой, поэтому ток резко
уменьшается. С увеличением![]() увеличивается энергия после столкновения
увеличивается энергия после столкновения![]() с атомом ртути,
с атомом ртути,![]() может преодолеть
может преодолеть![]() и
ток снова возрастает. Атом ртути получив
и
ток снова возрастает. Атом ртути получив![]() переходит в возбужденное состояние и
при переходе в обычное излучает фотон
с энергией
переходит в возбужденное состояние и
при переходе в обычное излучает фотон
с энергией![]() ,
,![]()
![]()
![]() ;
;![]() ,
,![]() .
.
При кратных 4,86эВ
значениях энергии, электроны могут
испытывать неупругие столкновения
несколько раз. Если атом ртути находится
в более разряженном состоянии то
![]() может перенести атом ртути из состояния
может перенести атом ртути из состояния![]() в
в![]() .
Т.о опыт показывает что спектр поглощаемой
атомом энергии дискретен.
.
Т.о опыт показывает что спектр поглощаемой
атомом энергии дискретен.
Правила квантования круговых орбит.
Условия стационарных
орбит Бор получил из гипотез Планка,
излучение и испускание
![]() происходит
квантами. Энергия:
происходит
квантами. Энергия:![]() ,
,![]() энергия
гармонического осциллятора. Энергия
гармонического осциллятора:
энергия
гармонического осциллятора. Энергия
гармонического осциллятора:![]() ,
где
,
где![]() -
масса ч-цы,
-
масса ч-цы,![]() -
импульс,
-
импульс,![]() координата.
координата.![]() ,
,![]() ,
,![]() - ур-ние эллипса по оси координат полуоси:
- ур-ние эллипса по оси координат полуоси:![]() ;
;![]() ;
;![]()
![]() ,
,![]() -
частицы движущиеся по окружности
-
частицы движущиеся по окружности![]() ,
,![]() ,
,![]() .
Поскольку на
.
Поскольку на![]() движущийся
по круговой орбите действует постоянная
сила, например в центре окружности, то
движущийся
по круговой орбите действует постоянная
сила, например в центре окружности, то![]() .
.![]() ;
;![]() ,
,![]() .
Т.о из всех возможных орбит, возможны
лишь те для которых момент импульса
принимает определенные дискретные
значения.
.
Т.о из всех возможных орбит, возможны
лишь те для которых момент импульса
принимает определенные дискретные
значения.
Спектр атома водорода по Бору.
Постулаты Бора позволили
рассчитать спектр водорода и
водородоподобных атомов. Водородоподобные
атомы – это атом который состоит из
ядра зарядом
![]() вокруг
которого вращается один
вокруг
которого вращается один![]() .
(рис. 14)
.
(рис. 14)
 решение
системы:
решение
системы:![]() ,
,![]() ,
,![]() ,
чем больше
,
чем больше![]() тем
больше радиус орбиты. При
тем
больше радиус орбиты. При![]() ,
,![]() ,
при
,
при![]()
![]() и т.д .
и т.д .
![]() ,(
,(![]() ),
чем больше
),
чем больше![]() тем меньше скорость.
тем меньше скорость.
Кинетическая энергия:
![]() .
.
Потенциальная энергия:
![]() ,
,![]()
![]()
![]() ;
;![]()
![]()
![]() .
Потенциальная энергия отрицательна
это значит что
.
Потенциальная энергия отрицательна
это значит что![]() притягивается
к ядру .
притягивается
к ядру .
Полная энергия
![]()
![]()
![]() .
.
Полная энергия
отрицательна это значит что
![]() и ядро составляют связанную схему, т.е
притягиваются друг к другу. С увеличением
и ядро составляют связанную схему, т.е
притягиваются друг к другу. С увеличением![]() энергия
увеличивается уменьшаясь по величине.
При
энергия
увеличивается уменьшаясь по величине.
При![]() .
.![]()
![]()
![]() Т.е с ростом
Т.е с ростом![]() расстояние
между энергетическими уровнями
уменьшается. При
расстояние
между энергетическими уровнями
уменьшается. При![]() спектр
квазинепрерывен. (рис. 15)
Состояние с
наименьшей энергией называется основным
состоянием, все остальные – возбужденные
состояния. Переход из одного состояния
в другое сопровождается испусканием
спектр
квазинепрерывен. (рис. 15)
Состояние с
наименьшей энергией называется основным
состоянием, все остальные – возбужденные
состояния. Переход из одного состояния
в другое сопровождается испусканием![]() с
энергией
с
энергией![]() ,
, .
.
Эмпирическая ф-ла
Бальмера:
![]() .
Сравним эти 2 формулы:
.
Сравним эти 2 формулы: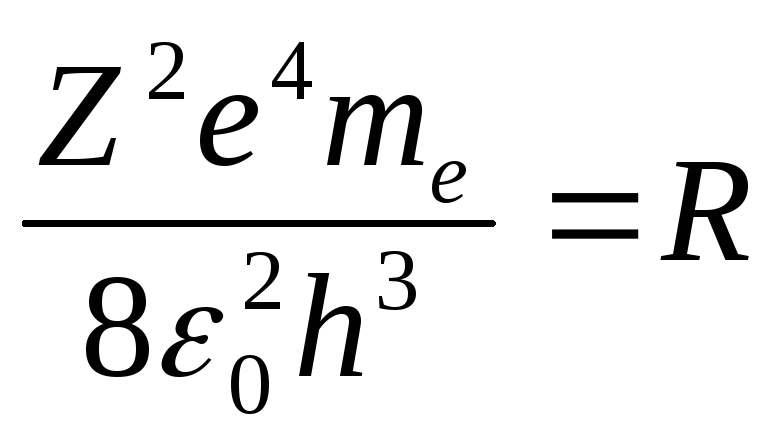 -
постоянная Ридберга. Серия Лаймона
соответствует переходам на 1-ый ур.,
Бальмера на 2, Пашина -3 и т.д. Это серии
испускания. В серии поглощения – в
спектре поглощения есть одна единственная
серия Лаймона. Переход с уровня
-
постоянная Ридберга. Серия Лаймона
соответствует переходам на 1-ый ур.,
Бальмера на 2, Пашина -3 и т.д. Это серии
испускания. В серии поглощения – в
спектре поглощения есть одна единственная
серия Лаймона. Переход с уровня![]() соответствует
границе серии.
соответствует
границе серии.
Ионизация![]() -
это отрыв
-
это отрыв![]() от ядра из атома, т.е соответствует
энергии перехода с 1-го уровня на
от ядра из атома, т.е соответствует
энергии перехода с 1-го уровня на![]() .
.
![]() это
связанное состояние
это
связанное состояние![]() движется
вокруг ядра.
движется
вокруг ядра.
![]() это
свободное состояние.
это
свободное состояние.
Энергия возбуждения
это энергия которую надо сообщить
![]() чтобы
перевести его из основного состояния
в возбужденное.
чтобы
перевести его из основного состояния
в возбужденное.
Энергия связи данного
состояния - это энергия которую надо
сообщить
![]() чтобы
перевести его в состояние
чтобы
перевести его в состояние![]() .
.
Энергия ионизации
- это энергия которую надо сообщить![]() чтобы
перевести его из основного состояния
в состояние с
чтобы
перевести его из основного состояния
в состояние с![]() .
.
![]() -
главное факторное число.
-
главное факторное число.
