
- •Механика (общая характеристика).
- •Кинематика поступательного движения (способы описания).
- •Кинематика прямолинейного движения (уравнение, характеристика основных величин).
- •Кинематика вращательного движения (уравнение, характеристика основных величин).
- •Кинематика сложного движения (общая характеристика).
- •Инерциальная система отсчета (исо). Законы динамики в исо.
- •Определение момента инерции материальной точки и твердого тела.
- •Определение момента силы относительно неподвижной оси вращения.
- •Определение момента силы относительно точки.
- •Выведите формулу момента инерции диска.
- •Формулировка теоремы Штейнера. Поясните величины, входящие в формулу Штейнера.
- •Определение момента импульса материальной точки и твердого тела относительно неподвижной оси вращения.
- •Напишите таблицу аналогий для поступательного и вращательного движений и поясните соответствующие величины.
- •Уравнение динамики движения тела в поступательно движущейся неинерциальной системе отсчета.
- •Силы инерции во вращающихся системах отсчета.
- •Работа силы в поступательном движении.
- •Работа силы во вращательном движении.
- •Сформулируйте три условия консервативности силового поля.
- •Потенциальная энергия.
- •Работа силы и ее связь с принципами симметрии.
- •Закон сохранения момента импульса. С каким принципом симметрии он связан?
- •Гравитационное поле, его характеристики: напряженность и потенциал.
- •Принцип относительности Галилея.
- •Систематические ошибки измерений.
- •Статистические характеристики случайных погрешностей.
- •Доверительный интервал. Коэффициент Стьюдента. С какой целью он вводится?
- •Как определяются ошибки при косвенных измерениях?
- •Суммарная ошибка прямых измерений. Частные случаи.
- •Постулаты специальной теории относительности.
- •Пространственно-временной интервал. Что означает инвариантность?
- •Запишите, сформулируйте и объясните закон Кулона.
- •Дайте определение напряженности электрического поля. Каково направление вектора напряженности? Нарисуйте вид поля для заряженных а) плоскости; б) сферы; в) цилиндра. Принцип суперпозиции.
- •Как определяется вектор электрического смещения? Что он характеризует?
- •Дайте определение потенциала и разности потенциалов электрического поля.
- •Связь напряженности электрического поля с разностью потенциалов.
- •В чем заключается явление поляризации диэлектрика? Виды поляризации. Характеристики поляризации.
- •Дайте определение дипольного момента.
- •Запишите и сформулируйте теорему Гаусса для вектора напряженности электрического поля.
- •Запишите, сформулируйте и объясните теорему Гаусса для вектора электрического смещения.
- •Проводники в электрическом поле (общая характеристика).
- •Дайте определение емкости уединенного проводника и конденсатора.
- •Энергия электрического поля.
- •Электрический ток: определение, его виды и характеристики.
- •Что такое сторонние силы? Какова их природа? Дайте определение эдс.
- •Когда напряжение и разность потенциалов совпадают?
- •Обобщенный закон Ома. Рассмотрите частные случаи.
- •Эдс, напряжение, разность потенциалов (физический смысл).
- •Законы Кирхгофа.
- •Импульс. Закон сохранения импульса.
- •Закон Джоуля-Ленца.
- •Закон Менделеева-Клапейрона.
- •Формулы скорости молекул, среднего числа столкновений, средней длины свободного полета.
- •Закон Больцмана, теплоемкость.
- •Применение первоначала термодинамики к изопроцессам. Адиабатический процесс.
-
Законы Кирхгофа.
Произвольно задаем направление тока. Для любого узла сумма входящих I равна сумме выходящих.
Для любого замкнутого контура сумма IR равна сумме ЭДС. Произвольно задаем направление обхода контура. Если направление I совпадает с ним, ставим плюс. Если направление ЭДС совпадает с ним, ставим плюс.
-
Импульс. Закон сохранения импульса.
Импульс (количество движения) — векторная физическая величина, являющаяся мерой механического движения тела. В классической механике импульс тела равен произведению массы m этого тела на его скорость v, направление импульса совпадает с направлением вектора скорости:
 =m
=m
Закон сохранения импульса: векторная
сумма импульсов всех тел (или частиц)
системы есть величина постоянная, если
векторная сумма внешних сил, действующих
на систему, равна нулю:
 =
= =const.
=const.
-
Закон Джоуля-Ленца.
dQ=I2Rdt, где dQ – количество выделенного тепла за dt, измеряется в джоулях
P=dQ/dt=I2R – мощность, измеряется в ваттах
-
Закон Менделеева-Клапейрона.
Уравнение Клапейрона: pV/T=B=const, где В – газовая постоянная. При одинаковых p и T молярные объемы Vm одинаковы, поэтому постоянная В будет одинакова для всех газов. Эта общая постоянная обозначается R и называется молярной газовой постоянной.
Уравнение состояния идеального газа (Менделеева-Клапейрона): pVm=RT, где R=8,31 Дж/моль*К
V=Vm*m/M
Уравнение Менделеева-Клапейрона для массы m газа: pV=m/M *RT=vRT, где v – количество вещества.
Часто используют постоянную Больцмана k=R/NA=1,38*10-23Дж/К
Тогда p=RT/Vm=nkT, где n=NA/Vm – концентрация молекул, NA=6,02*1023 – число Авогадро
Число молекул, содержащихся в 1 м3 газа при н.у., называется числом Лошмидта: NL=2,68*1025 м-3
P=ρRT/M, где ρ – плотность газа.
Нормальные условия: p=105 Па; T=273К; Vm=22,4 л.
-
Формулы скорости молекул, среднего числа столкновений, средней длины свободного полета.
vв = ;
vср =
;
vср =
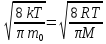 ;
vср.кв=
;
vср.кв=
V=πd2эфvср*1с;
z=nV/1с=nπd2эфvср
без движения других молекул;
z= nπd2эфvср
– молекулы движутся.
nπd2эфvср
– молекулы движутся.
Средняя длина свободного пробега:
l=vср/z=1/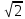 nπd2эф
nπd2эф
-
Закон Больцмана, теплоемкость.
dQ=dU+dA (количество теплоты=изменение внутренней энергии+элементарная работа)
Закон Больцмана о равномерном распределении
энергии по степеням свободы: E= kT
kT
U=NE=ν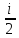 RT;
dU= ν
RT;
dU= ν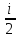 RdT
RdT
С – теплоемкость: C=dQ/dT; dQ=CdT; CM=MCm
-
Применение первоначала термодинамики к изопроцессам. Адиабатический процесс.
Изобарный процесс – процесс при постоянном давлении.
p=const; dQ=
νCMpdT;
dU= ν RdT;
dA=pdV=
νRdT
RdT;
dA=pdV=
νRdT
Изохорный процесс – процесс при постоянном объеме.
V=const; dQ= νCMVdT=
ν RdT=dU;
dA=pdV=0
RdT=dU;
dA=pdV=0
Изотермический процесс – процесс при постоянной температуре.
T=const, dT=0; dQ=dA, Q=A; dU=0; dA=pdV, A=νRT ln(V2/V1)
pdV= νRdT; CМр-СМV=R (формула Майера)
Адиабатический процесс – процесс без теплообмена с окружающей средой.
dQ=0; dU=
ν RdT;
dA= –dU= –ν
RdT;
dA= –dU= –ν RdT.
RdT.
