
- •Маханика, молекулярная физика, электричество и магнетизм
- •2. Виды ошибок
- •3. Обработка результатов прямых измерений
- •4. Надежность измерений
- •5. Исключение промахов
- •6. Пример обработки результатов прямых измерений
- •7. Некоторые советы и рекомендации к расчетам и вычислениям
- •Литература
- •Индивидуальное задание
- •Проверка основного закона динамики вращательного движения
- •Описание экспериментальной установки
- •Измерения
- •Литература
- •Сложение взаимно перпендикулярных гармонических колебаний
- •Теория метода
- •Измерения
- •Литература
- •Определение отношения теплоемкостей газов сp/сv методом Клемана и Дезорма
- •Теория метода
- •Порядок выполнения работы
- •Порядок выполнения работы
- •Контрольные вопросы
- •Литература
- •Изучение электростатического поля Теоретические сведения Электростатическое поле
- •Напряженность электрического поля
- •Потенциал электрического поля
- •Связь между напряженностью электрического поля и потенциалом
- •Экспериментальные исследования электростатических полей
- •Выполнение работы
Теория метода
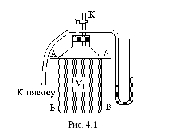 Стеклянный
баллон (рис. 4.1) наполнен воздухом при
атмосферном давлении. С помощью насоса
в баллон через осушитель накачивается
дополнительная порция воздуха, пока
разность уровней воды в манометре М не
составит
25–30 см.
Кран K
закрывается и через некоторое время
температура газа в баллоне сравняется
с температурой окружающей среды, разность
уровней перестанет меняться и будет
равной h1.
Стеклянный
баллон (рис. 4.1) наполнен воздухом при
атмосферном давлении. С помощью насоса
в баллон через осушитель накачивается
дополнительная порция воздуха, пока
разность уровней воды в манометре М не
составит
25–30 см.
Кран K
закрывается и через некоторое время
температура газа в баллоне сравняется
с температурой окружающей среды, разность
уровней перестанет меняться и будет
равной h1.
Выделим в сосуде некоторое количество z воздуха (объем V1) и рассмотрим процессы, которые с ним происходят. Первое состояние характеризуется параметрами P1, V1, T1, где P1 = Р0 + gh1. Откроем и быстро закроем кран К так, чтобы давление в баллоне сравнялось с атмосферным. Часть газа из баллона (но не из объема V1) выйдет через кран. Так как процесс расширения выбранного нами количества воздуха происходит быстро, а процесс теплообмена с окружающей средой, благодаря малой теплопроводности стенок баллона, идет медленно, этот процесс можно считать адиабатическим. Температура газа при этом уменьшается.
Второе состояние характеризуется параметрами Р0, V2, Т. Далее за счет теплообмена с окружающей средой газ медленно нагревается до тех пор, пока его температура не сравняется с температурой окружающей среды. Разность уровней в манометре не перестанет меняться и станет равной h2.
Третье состояние характеризуется параметрами Р2, V2, Т0, где Р2 = Р0 + gh2. Разность давлений P1 – Р0 и P2 – Р1 во много раз меньше атмосферного давления. Действительно, атмосферному давлению соответствует высота водяного столба, примерно равная 103 см, а указанные разности не превышают 30 см. Поэтому для упрощения вычислений с этими разностями можно обращаться как с бесконечно малыми дифференциалами. То же относится и к изменению объема выделенной порции газа.
Напишем первое начало термодинамики:
Q = zCVdT + PdV, (4.1)
где z – число молей газа.
Для адиабатического перехода из состояния 1 в состояние 2 Q = 0, значит
zCVdT + PdV = 0. (4.2)
Продифференцируем уравнение Менделеева-Клапейрона
PdV + VdP = zRdT.
Найдем dT и подставим в формулу (4.2). Получим
![]() ,
,
откуда
![]() , (4.3)
, (4.3)
где
![]() –
показатель адиабаты.
–
показатель адиабаты.
Это уравнение адиабатического процесса в дифференциальной форме, его решение дает формула Пуассона. Учитывая сказанное ранее о разностях давлений и объемов, окончательно запишем:
Р(V2 – V1) +V(P0 – P1) = 0. (4.4)
В состояниях 1 и 3 температуры газа одинаковы, поэтому, как это следует из уравнения Менделеева-Клапейрона, Р1V1 = Р2V2, т. е. PV = const. Продифференцируем это выражение PdV + VdP = 0 и перейдем к разностям объемов и давлений
Р(V2 – V1) +V(P2 – P1) = 0. (4.5)
Решая совместно уравнения (4.3) и (4.5) относительно , получим уравнение
![]() .
.
В результате получается расчетная формула для определения СР/СV:
![]() . (4.6)
. (4.6)
Порядок выполнения работы
1. Накачать в сосуд воздух. После установления равновесия измерить разность уровней воды в манометре h1.
2. Открыть и быстро закрыть кран К. После установления равновесия измерить разность уровней в манометре h2.
3. Проделать 10 измерений, вычислить среднее значение СР/СV, абсолютную и относительную погрешности.
Контрольные вопросы
1. Какие процессы имеют место в эксперименте?
2. Почему СР > СV?
3. Как теоретически определить СР/СV?
4. Почему экспериментальные результаты систематически меньше теоретически вычисленной величины?
Литература
1. Яковлев, В.Ф. Курс физики. Теплота и молекулярная физика / В.Ф. Яковлев. М., 1976, §§7, 19–23, 37.
2. Сивухин, Д. В. Курс физики. Т. 2 / Д. В. Сивухин. М.: «Наука», 1986, §§20–22.
Лабораторная работа № 5
Определение коэффициента внутреннего трения жидкостей и газов
Краткие теоретические сведения
В объеме жидкости, ограниченном параллельными
поверхностями А и В, движущимися с
различными скоростямиv1
и v2
устанавливается
такое состояние движения, при котором
слои жидкости А и В, имеют одинаковые с
ним скорости, равномерно возрастающими
от скорости v1
до скорости v2.
Вязкость или внутреннее трение проявляется
в форме силы, препятствующей относительному
движению пластинок. Сила внутреннего
трения может быть вычислена по формуле
Ньютона
объеме жидкости, ограниченном параллельными
поверхностями А и В, движущимися с
различными скоростямиv1
и v2
устанавливается
такое состояние движения, при котором
слои жидкости А и В, имеют одинаковые с
ним скорости, равномерно возрастающими
от скорости v1
до скорости v2.
Вязкость или внутреннее трение проявляется
в форме силы, препятствующей относительному
движению пластинок. Сила внутреннего
трения может быть вычислена по формуле
Ньютона
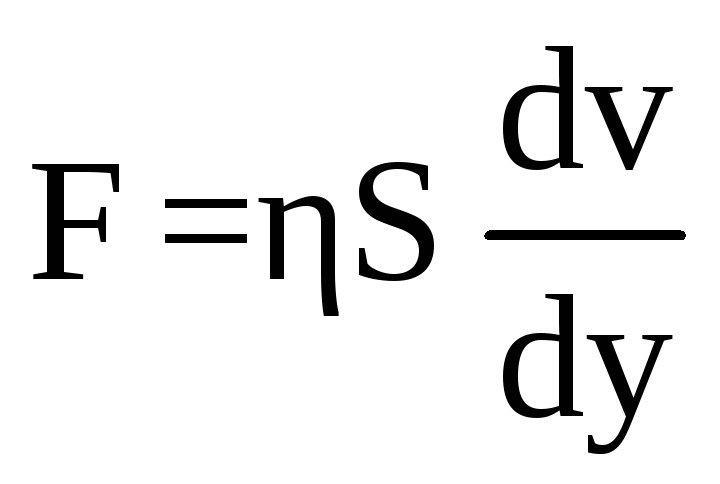 , (5.1)
, (5.1)
где
S
– поверхность соприкосновения слоев,
![]() – градиент скорости,
– коэффициент внутреннего трения или
динамической вязкости. Единицу измерения
коэффициента динамической вязкости
найдем по формуле:
– градиент скорости,
– коэффициент внутреннего трения или
динамической вязкости. Единицу измерения
коэффициента динамической вязкости
найдем по формуле:
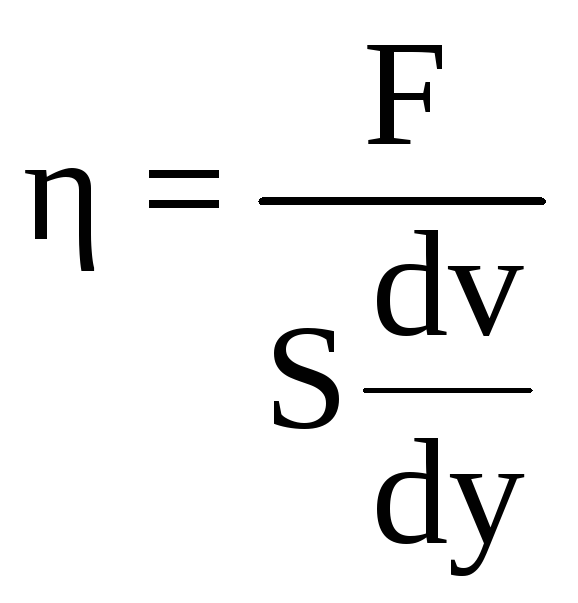 . (5.2)
. (5.2)
Положив
в (5.2) А = 1 Н, S
= 1 м2,
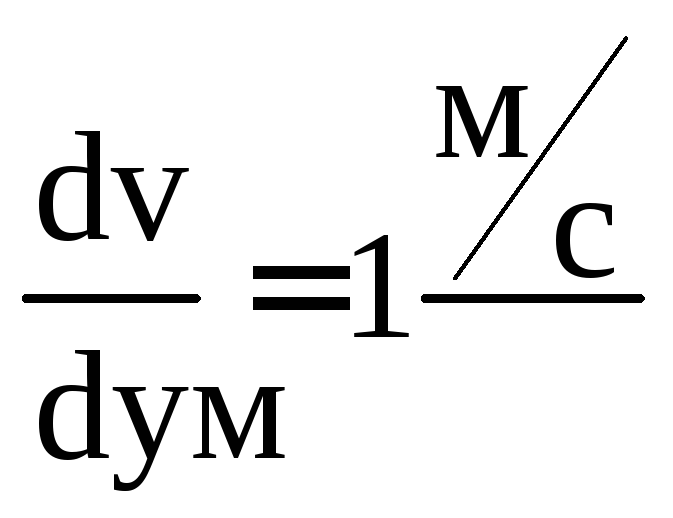 ,
получим:
,
получим:
1
единица динамической вязкости равняется
 .
.
Э
Рис.
1.
![]() –коэффициент
динамической вязкости такой жидкости,
в которой один метр слоя (1м2)
испытывает силу 1 Н при градиенте скорости
1 м/с. В системе СГС единица коэффициента
вязкости носит название пуаз. 1 пуаз =
10–1Нс/м2.
–коэффициент
динамической вязкости такой жидкости,
в которой один метр слоя (1м2)
испытывает силу 1 Н при градиенте скорости
1 м/с. В системе СГС единица коэффициента
вязкости носит название пуаз. 1 пуаз =
10–1Нс/м2.
Молекулярно-кинетическая теория объясняет вязкость движением и взаимодействием молекул.
В газах расстояние между молекулами существенно больше радиуса действия молекулярных сил, поэтому вязкость газов – следствие хаотического (теплового) движения молекул, в результате которого происходит обмен между движущимися относительно друг друга слоями газа. Это приводит к переносу от слоя к слою определенного количества движения, в результате чего медленные слои ускоряются, а более быстрые замедляются.
Вязкость газа не зависит от его плотности (давления), т. к. при сжатии газа общее количество молекул, переходящих из слоя в слой увеличивается, но зато каждая молекула менее глубоко проникает в соседний слой и переносит меньшее количество движения. Вязкость идеальных газов определяется соотношением
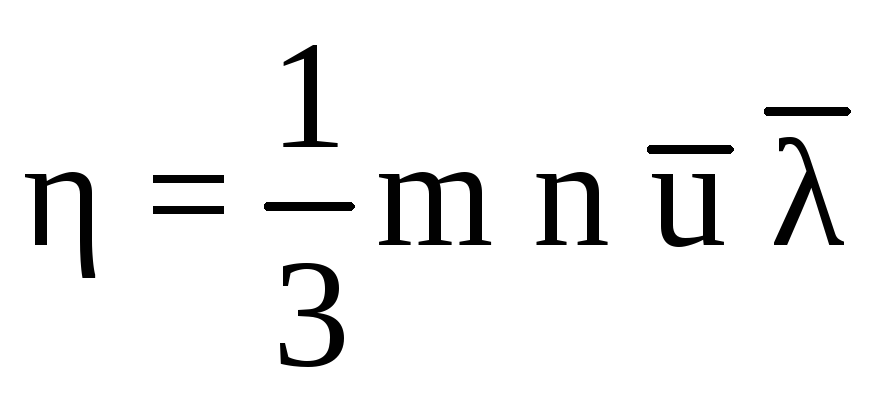 , (5.3)
, (5.3)
m
– масса молекулы, n
– число молекул,
![]() – средняя арифметическая скорость
молекулы,
– средняя арифметическая скорость
молекулы,![]() – длина свободного пробега молекулы.
– длина свободного пробега молекулы.
Т.
к.
![]() возрастает с повышением температуры
Т, вязкость газов увеличивается при
нагревании (пропорционально
возрастает с повышением температуры
Т, вязкость газов увеличивается при
нагревании (пропорционально![]() ).
Для очень разреженных газов понятие
вязкости теряет смысл.
).
Для очень разреженных газов понятие
вязкости теряет смысл.
В жидкостях, где расстояние между молекулами много меньше, чем в газах, вязкость обусловлена в первую очередь межмолекулярным взаимодействием, ограничивающим подвижность молекул. В жидкостях молекула может проникнуть в соседний слой лишь при образовании в нем полости, достаточной для перескакивания в нее молекулы. На образование полости расходуется т. н. энергия активации вязкого течения. Энергия активации уменьшается с ростом температуры и увеличивается с ростом давления. В этом состоит одна из причин резкого снижения вязкости жидкости с повышением температуры и роста ее при очень высоких давлениях.
Явление внутреннего трения имеет большое практическое значение. Например, смазка маслами трущихся поверхностей в машинах позволяет заменить внешнее трение (сухое) значительно меньшим – внутренним трением масла.
Для определения коэффициента внутреннего трения жидкостей и газов применяются приборы, называемые вискозиметрами. Основными методами измерения являются:
метод Стокса,
метод капиллярных трубок,
метод затухающих колебаний, совершаемых диском или шаром, подвешенным на упругой нити в исследуемой среде,
метод двух вращающихся цилиндров, установленных коаксиально, если внешний цилиндр приводится во вращение, то внутренний цилиндр, подвешенный на упругой нити, поворачивается под действием силы внутреннего трения на некоторый угол, величина которого измеряется.
В данной работе изучается метод Стокса для определения коэффициента внутреннего трения глицерина.
Задание. Определение коэффициента вязкости жидкости по методу Стокса. Приборы и принадлежности: вискозиметр Стокса, стальные шарики, микрометр, линейка, секундомер, ареометр.
Метод Стокса основан на измерении скорости падения тяжелого шарика в исследуемой жидкости. На движущийся в жидкости шарик действует сила внутреннего трения, тормозящая его движение. Эта сила по закону Стокса равна
![]() ,
,
где r – радиус шарика, v – его скорость.
Если шарик свободно падает в вязкой жидкости, то на него будут действовать: сила тяжести Р = mg = pVg и выталкивающая сила P1 = 1Vg, равная весу жидкости в объеме шарика (V – объем шарика, – плотность шарика, p1 – плотность жидкости). При падении в вязкой среде шарик, двигаясь ускоренно, приобретает такую скорость, при которой силы, действующие на него, взаимно уравновесятся. В этом случае имеет место равенство
P = P1+FТ
или
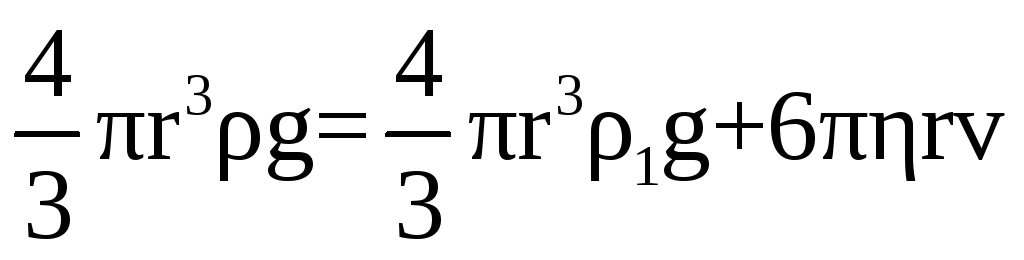 . (5.4)
. (5.4)
При равновесии всех сил, действующих на шарик, его дальнейшее движение становится равномерным.
Решая уравнение (5.4) относительно коэффициента трения , получаем следующую формулу для его расчета
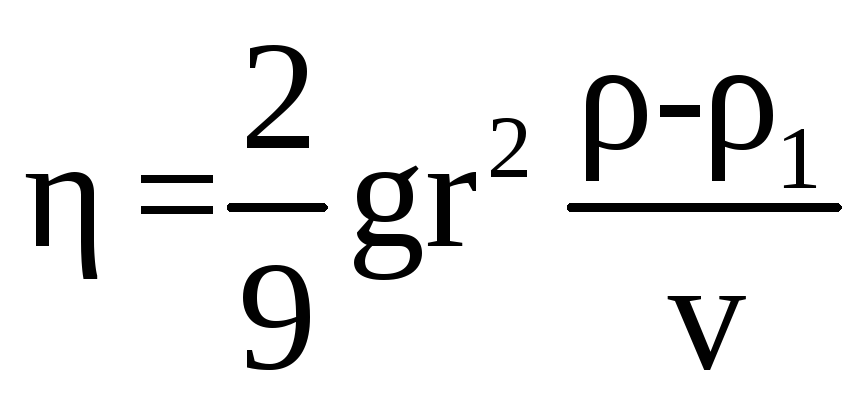 . (5.5)
. (5.5)
К оэффициент
внутреннего трения при помощи указанного
метода можно измерить на вискозиметре
Стокса. Он представляет собой стеклянный
цилиндр А, заполненный исследуемой
жидкостью (рис. 5.2). Вверху и внизу цилиндра
имеются две метки:n
и m.
Падающий шарик вначале движется
ускоренно, а далее равномерно. Метка n
ставится в том месте, где движение шарика
наверняка становится равномерным.
оэффициент
внутреннего трения при помощи указанного
метода можно измерить на вискозиметре
Стокса. Он представляет собой стеклянный
цилиндр А, заполненный исследуемой
жидкостью (рис. 5.2). Вверху и внизу цилиндра
имеются две метки:n
и m.
Падающий шарик вначале движется
ускоренно, а далее равномерно. Метка n
ставится в том месте, где движение шарика
наверняка становится равномерным.
Формула (5.5) справедлива для шарика, падающего в безгранично простирающейся жидкости. Поэтому в формулу для вводятся поправки на влияние близости стенок цилиндра. С внесением указанных поправок формула (5.3) принимает следующий вид:
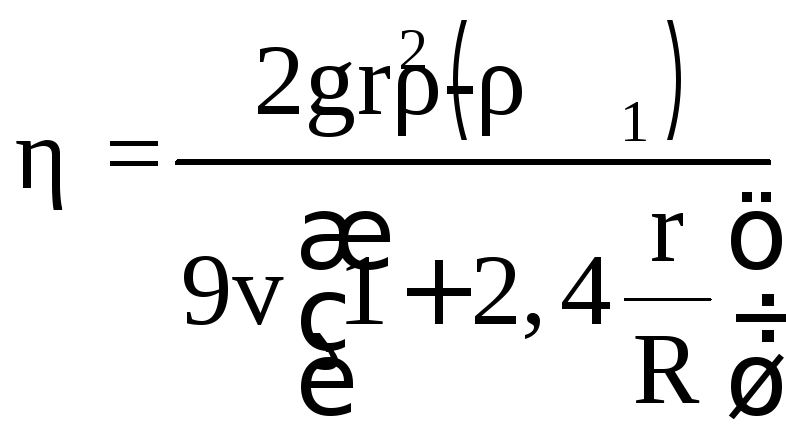 . (5.6)
. (5.6)
где R – радиус цилиндра
Вискозиметр Стокса применяется для измерения коэффициентов внутреннего трения сравнительно вязких жидкостей, например, масел.
