
Fizika 10 klas - Goncharenko S.U
..pdf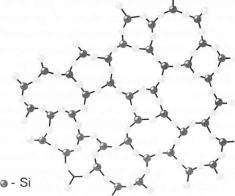
а
^ґ А у А у
у-^ґ
А у А
а |
б |
|
|
|
Мал. 60 |
властивості аморфних речовин пояснюються особливостями їх молекулярної будови, завдяки яким їх можна віднести швидше до рідин, ніж до твердих тіл.
Атоми або молекули аморфних тіл, як і молекули рідини, мають певний час «осілого життя» — час коливань біля положення рівноваги. Проте на відміну від рідин цей час у них досить великий. У цьому відношенні аморфні тіла наближаються до кристалічних, оскільки переходи атомів з одного положення рівноваги в інше відбуваються рідко.
У аморфних тіл на відміну від кристалів немає точного порядку в розміщенні атомів. Тільки найближчі атоми — сусіди — розміщуються за деяким порядком. Проте точного повторення в усіх напрямах того самого елемента структури (елементарної комірки), характерного для кристалів, в аморфних тіл немає.
Часто одна й та сама речовина може перебувати і в кристалічному, і в аморфному станах. Наприклад, кварц (8Ю2) може бути в кристалічній і в аморфній формі (кремнезем). Кристалічну форму кварцу схематично зображають у вигляді решітки з правильних шестикутників (мал. 60, а). Аморфна структура кварцу також має вигляд решітки, але неправильної. Крім шестикутників, у ній бувають п'яти- і семикутники (мал. 60, б).
Таким чином, за своєю внутрішньою будовою аморфні тіла близькі до рідин, відрізняючись від них лише меншими середніми відстанями між молекулами і в зв'язку з цим більшими силами молекулярного притягання. Тому аморфні тіла можна вважати переохолодженими рідинами.
90
Аморфний стан речовини нестійкий: через певний час аморфна речовина переходить у кристалічну. Часто цей перехід буває дуже тривалим і вимірюється роками та десятиліттями. Прикладом речовини, яка повільно переходить з аморфного стану в кристалічний, може бути скло. Спочатку прозоре, воно через багато років мутніє: в ньому утворюються дрібні кристалики силікатів різних матеріалів, які входять до складу скла.
? 1. Чим відрізняються аморфні тіла від кристалічних? 2. Чи мають аморфні тіла дальній порядок у розміщенні частинок? 3. Чому аморфні тіла з часом можуть переходити в кристалічні?
§ 29. Рідкі кристали
Більшість речовин може перебувати в трьох агрегатних станах — твердому, рідкому й газоподібному. Однак деякі органічні речовини, молекули яких мають ниткоподібну форму або форму плоских пластин, можуть перебувати в особливому стані, маючи одночасно властивості анізотропії і текучості. Цей стан, який поєднує властивості кристала і рідини, називають рідкокристалічним. А речовини, які досить дивовижно поєднують властивості рідин і кристалів, дістали назву рідких кристалів. Вони текучі і утворюють краплі. Правда, їхні краплі можуть мати не сферичну, а видовжену форму. Детальне дослідження показало, що розміщення молекул у них має порядок, не властивий звичайним рідинам і твердим тілам. Якщо в твердих кристалах спостерігається дальній порядок у розміщенні частинок в будь-яких трьох взаємно перпендикулярних напрямах, то в рідких — в одному напрямі (одновісний дальній порядок).
Маючи впорядковану орієнтацію молекул в одному з напрямів, рідкі кристали характеризуються анізотропією фізичних властивостей: поверхневого натягу, електропровідності, магнітних і оптичних характеристик тощо. За механічними властивостями вони нагадують рідини, в'язкість яких коливається від рідкого клею до «твердого» скла.
Існують рідкі кристали в певному інтервалі температур, різному для різних речовин. Нагріваючись, вони перетворюються у звичайну рідину, від охолодження стають твердими кристалами. Розрізняють два основних типи рідких кристалів: нематичний (від грецького «нема» — нитка) і смектичний (від грецького «смекма» — мило). В нематичних рідких кристалах впорядкованість розташування молекул полягає в тому, що в певному об'ємі, який відповідає одному «монокристалу», поздовжні осі всіх молекул паралельні (мал. 61), а
91

Мал. 61 Мал. 62
будь-який інший дальній порядок у розміщенні частинок відсутній. У смектичних рідких кристалах молекули розташовані шарами (мал. 62). Найпоширеніший приклад смектичного рідкого кристала — розчин мила у воді. Ті якості мила, які роблять його мийним засобом, безпосередньо пов'язані з його здатністю утворювати рідкі кристали. Мильний розчин складається з великої кількості подвійних шарів молекул мила, розділених шарами води. Коли ми миємо з милом руки, то шари молекул мила легко ковзають один відносно одного і шкіри, забираючи з неї бруд і передаючи його воді.
Вже вивчено понад 3000 речовин, які утворюють рідкі кристали. До них належить багато органічних речовин біологічного походження, наприклад дезоксирибонуклеїнова кислота, яка несе код спадкової інформації, і речовина мозку.
Багато рідких кристалів мають дуже цінну якість: деякі їх властивості різко змінюються за порівняно незначної зміни зовнішніх умов (температури, електричного і магнітного полів тощо). Це явище знайшло вже практичне застосування: на основі рідких кристалів опрацьовано перетворювач інфрачервоного зображення у видиме, лабораторний прилад для вимірювання коливань температури і т. ін.
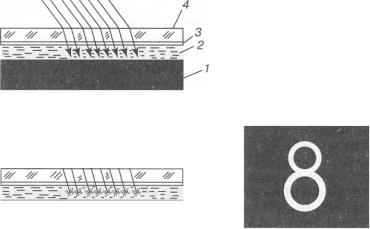
Рідкі кристали використовуються в різних оптичних індикаторах, наприклад у циферблатах наручних годинників, на яких час фіксується не стрілкою, а зміною цифр. Будову і принцип дії таких індикаторів можна пояснити за допомогою малюнка 63.
Рідкокристалічна речовина 2 поміщається в зазор між чорною непрозорою для світла металевою пластинкою І і дуже
92
а
Мал. 63
тонкою, прозорою для світла металевою плівкою 3, нанесеною на покрівне скло 4. Якщо до обкладок конденсатора, що утворився, напруга не прикладена (мал. 63, а), світло, яке падає на циферблат, проходить крізь рідкий кристал і поглинається чорною металевою пластинкою. Циферблат спостерігачеві здається чорним.
Якщо на пластини подати напругу, то під дією електричного поля оптичні властивості рідкого кристала зміняться і він розсіюватиме світло, яке на нього падає. В результаті циферблат світитиметься в тих місцях, де створено електричне поле. Надавши верхньому електроду форму цифри, дістанемо свічення у вигляді цифри (мал. 63, б).
Надзвичайно велике значення рідких кристалів у біології та медицині. Немає сумнівів у тому, що дальші дослідження цих речовин не тільки розширять їх застосування в техніці, а й дадуть змогу проникнути в таємниці біологічних процесів.
§ ЗО. Створення матеріалів із наперед заданими технічними властивостями
Останнім часом у багатьох галузях народного господарства зростають потреби в економічних і високоякісних матеріалах, що мають певні технічні властивості. Для науки й техніки потрібні матеріали досить міцні та особливо стійкі проти нагрівання, дії хімічних реагентів, корозії.
93
В авіації, ракетній, космічній і ядерній техніці, радіоелектроніці прогрес був би просто неможливий без надміцних матеріалів, здатних витримувати температури до 2500 °С і вище.
Багато з використовуваних у техніці матеріалів не існує в природному стані — їх створила людина. В сучасній техніці використовується понад 20 тисяч конструкційних і будівельних матеріалів, і їх асортимент з кожним роком зростає за рахунок створення надміцних, жаростійких, хімічно стійких матеріалів та їх сплавів. Але якщо раніше нові матеріали створювалися в результаті простого відбору природних речовин із необхідними властивостями, то нині на основі знання залежності фізичних і хімічних властивостей речовини від її будови (структури) цілеспрямовано створюють матеріали із заздалегідь заданими механічними, тепловими, електромагнітними, оптичними та іншими властивостями.
Одним із засобів керування властивостями нових матеріалів є утворення різних сплавів. Сплавляючи в певному співвідношенні різні метали, дістають сплави з бажаними технічними властивостями. В розплавленому стані відбувається активне дифузійне перемішування частинок (йонів, атомів, молекул) вихідних речовин, яке у процесі кристалізації сприяє утворенню сплаву із властивостями, які відрізняються від властивостей його компонентів. Тепер виготовляються і використовуються тисячі металевих сплавів з різноманітними властивостями: дюралюміній (сплав алюмінію з міддю, магнієм і манганом), латунь (сплав міді з цинком), бронза (сплав міді з оловом, алюмінієм або свинцем), бабіт (сплав олова, стибію і міді), легована сталь (сплави заліза з нікелем, кобальтом, хромом та іншими металами) тощо. Тверді металеві сплави мають високу пластичність і міцність. Сплавляючи тугоплавкі метали (вольфрам, хром, ванадій, іридій, молібден тощо), дістають особливо тверді сплави, які використовують для виготовлення металорізального інструменту. На основі титану дістають легкі і надзвичайно міцні сплави, здатні працювати за температури 500—600 °С. За густини 4,5 • 103 кг/м3 титан має модуль пружності приблизно в 2 рази більший, ніж залізо, і в 6 раз більший, ніж алюміній. Ці якості титанових сплавів зробили їх незамінними в надзвуковій авіації, космічній техніці та інших галузях науки і техніки.
Для роботи у разі великих механічних навантажень використовувалися переважно метали та їх сплави. Однак метали непридатні в агресивних середовищах або за високих температур, оскільки зазнають корозії, а під час нагрівання стають пластичними і набувають плинності, тобто повільно і безперервно деформуються під впливом навантажень чи механічних напруг. З метою підвищення міцності металів у їх
94
кристалічні решітки вводять атоми інших елементів, таких, як Карбон, Силіцій, Нітроген, Бор. В результаті дістають сполуки металів з Карбоном (карбіди), Силіцієм (силіциди), Бором (бориди), Нітрогеном (нітриди), які дістали назву металоподібних. Ці з'єднання, зберігаючи значною мірою властивості металів (міцність, електропровідність тощо), одночасно набувають і нових (твердість, теплостійкість, хімічна стійкість). Атоми металу і неметалу зв'язуються між собою дуже міцними ковалентно-металевими зв'язками.
Карбіди деяких металів (Титану, Цирконію, Гафнію, Ванадію, Танталу, Ніобію, Молібдену тощо) дуже тверді і тугоплавкі речовини. Підвищення цих цінних якостей досягається в результаті сплавляння між собою різних карбідів чи карбідів з металами: нікелем, кобальтом, хромом тощо. Так, деталі із сплаву карбідів танталу, гафнію і цирконію можуть працювати за температури до 3000 °С. Найтугоплавкішим з усіх відомих матеріалів є сплав карбідів танталу (80 %) і гафнію. Його температура плавлення дорівнює 4215 С.
Металоподібні сполуки знаходять широке і різноманітне застосування у сучасній техніці: захисні покриття під час добування жароміцних волокон, в металургії, енергетиці тощо.
З кожним роком зростає застосування в техніці так званих бінарних сполук неметалів: Карбону, Силіцію, Нітрогену і Бору, тобто продуктів з'єднання між собою двох різних атомів цих елементів. В кристалічній структурі бінарних сполук атоми зв'язані міцними ковалентними зв'язками. Тому ці речовини відзначаються винятковою твердістю, термостійкістю, вогнетривкістю і хімічною стійкістю.
Прикладом такої бінарної сполуки є карбід силіцію 8іС, який в техніці називають карборундом. Його дуже широко використовують для виготовлення абразивів, вогнетривів і напівпровідників. Ниткоподібні монокристали карбіду силіцію використовують для армування металів і полімерів та добування в такий спосіб винятково міцних матеріалів.
Дуже міцний ковалентний зв'язок утворюють атоми Бору і Нітрогену в кристалічній структурі нітриду бору N6, причому існують три різні форми кристалічних решіток, дві з яких аналогічні алмазу і графіту. Нітрид бору, кристалічна решітка якого схожа з графітом — це білий порошок («білий графіт»), слугує кращим, ніж графіт, змащенням. Нітрид бору, що має кристалічну решітку, аналогічну алмазу, за твердістю не поступається йому і перевищує його за міцністю і термостійкістю. В техніці цей матеріал називають ельбором, кубонітом або боразоном. Різальні й абразивні інструменти, виготовлені на основі ельбору, в 10—20 раз перевищують за стійкістю твердосплавні інструменти. Такими інструментами можна обробляти сталь і

чавун, тоді як алмазні інструменти для цієї мети непридатні: під час розігрівання алмаз перетворюється в графіт.
У багатьох галузях науки і техніки широко використовують чудові механічні, електромагнітні й оптичні властивості монокристалів хімічних елементів і багатьох речовин, насамперед алмазу, рубіну, германію, кварцу, силіцію, сапфіру, ісландського шпату тощо. Але, на жаль, ці монокристали трапляються в природі дуже рідко і в більшості випадків мають тріщини, забруднення, дефекти кристалічної структури. У зв'язку з цим швидкими темпами розвиваються техніка і технологія штучного вирощування, або синтезу монокристалів багатьох хімічних елементів і сполук дуже високої хімічної чистоти з досконалою кристалічною структурою.
В Україні виробляються сотні штучних кристалів, у тому числі дорогоцінних і напівдорогоцінних: діамантів, смарагдів, рубінів, гранатів, сапфірів, аметистів, топазів тощо. Вирощені штучні монокристали ні в чому не поступаються природним, а деякі і значно їх перевищують, оскільки в процесі їх виготовлення учені й інженери можуть цілеспрямовано змінювати склад вихідних речовин, умови вирощування і тим самим створювати монокристали з необхідними властивостями.
Існують два основні способи вирощування монокристалів: кристалізація із розплаву і кристалізація із розчину.
Великим досягненням науки й техніки останніх сорока років була організація промислового виробництва синтетичних алмазів. Вони виявилися кращими за природні: твердіші, менш крихкі і стійкіші проти зношування. Наприклад, алмазні підшипники, які працюють без змащення у хронометрах вищого класу для морських кораблів і в інших особливо точних навігаційних приладах, роблять 60 млн обертів без помітного зношування. Синтетичні алмази у вигляді порошків, паст і дрібних кристалів також використовують у приладах і деталях, які вимагають великої твердості. їх застосовують для дуже точної обробки важливих деталей машин і приладів, виробів з твердої сталі, кераміки, природних алмазів. Алмазні різці, свердла, пилки, фільєри і коронки в сотні і тисячі разів довговічніші за звичайні, при цьому обробка ними твердих сплавів і пластиків прискорюється в 6—12 раз. Глибоке буріння свердловин ведеться тепер майже виключно за допомогою алмазного інструменту.
Висновки
Усі тіла складаються з молекул і атомів, які перебувають у безперервному хаотичному русі. Між атомами і молекулами існують сили взаємодії.
96
Дифузія в газах, рідинах і твердих тілах пояснюється тепловим рухом молекул. Броунівський рух є відображенням руху молекул рідини чи газу.
Тиск газу відображає спільний ефект співударянь зі стінкою великої кількості молекул.
Температура тіла — це міра середньої кінетичної енергії поступального руху його молекул.
Основне рівняння молекулярно-кінетичної теорії газів твердить, що тиск ідеального газу пропорційний добуткові числа молекул в одиниці об'єму, маси молекули і середнього квадрата швидкості руху молекул: р =о~птV2.
Це рівняння можна також записати у вигляді
РУ = ИкТ; р = пкТ; рУ = ^ Е к і р = Для даної маси газу добуток тиску на об'єм, поділений на
абсолютну температуру 7\ є величина стала: = сопзі (рівняння стану ідеального газу — рівняння Клапейрона).
З рівняння стану ідеального газу |
= сопзі легко дістати |
закон Бойля—Маріотта (добуток тиску даної маси газу на його об'єм за сталої температури є величина стала: рУ = сопзі;), закон Гей-Люссака (за незмінної маси газу і сталого тиску його об'єм прямо пропорційний абсолютній температурі: ^ = сопзі), закон Шарля (за незмінної маси газу і сталого
об'єму тиск газу прямо пропорційний абсолютній температурі: £ = СОП8І).
З основного рівняння молекулярно-кінетичної теорії випливає, що в однакових об'ємах будь-якого газу за однакових тисків і температур містяться однакові кількості молекул (закон Авогадро). Моль будь-якого газу за нормальних умов містить 6,022 -1023 молекул.
Тиск насиченої пари над її рідиною не залежить від об'єму пари і за незмінної температури сталий. З підвищенням температури тиск насиченої пари зростає і за температури кипіння рідини дорівнює атмосферному тиску.
Стан речовини, за якого густина рідини і густина її насиченої пари однакові, називають критичним. У критичному стані рідина має максимальний об'єм, а насичена пара — максимальний тиск. За температур вищих критичної газ не можна перетворити в рідину ні під яким тиском.
Абсолютна вологість повітря вимірюється кількістю водяної пари, яка міститься в 1 м3 повітря. Відносна вологість вимірюється відношенням кількості водяної пари, яка є
4 |
2—325 |
97 |
в повітрі (абсолютної вологості), до тієї кількості пари, яка необхідна для насичення повітря за тієї самої температури.
Рідини займають проміжне положення між газами і кристалами. В розміщенні частинок рідини є певний порядок, тобто її молекули утворюють щось схоже на кристалічну решітку. На відміну від кристалів у рідинах цей порядок не поширюється на весь об'єм, а обмежується областю, яка містить лише невелику кількість частинок навколо даної (існує так званий ближній порядок).
Внаслідок взаємодії молекул виникає поверхневий натяг рідини. Його характеризують силою, прикладеною до контуру, який обмежує поверхню рідини. Цю силу називають силою поверхневого натягу. Кількісною характеристикою рідини є поверхневий натяг, який дорівнює відношенню сили поверхневого натягу до довжини межі поверхневого шару.
Поверхневий натяг рідини є причиною явища капілярності — підняття (опускання) рідини в трубках малого перерізу. Його широко використовують у техніці, зокрема в агротехніці.
Речовини у твердому стані за їх властивостями поділяють на дві групи: кристалічні й аморфні. Кристалічні тіла на відміну від аморфних мають певну температуру плавлення, незмінну за сталого тиску. Основна макроскопічна особливість монокристалів — анізотропія їх фізичних властивостей (механічних, електричних, магнітних, оптичних). Полікристалічні й аморфні тіла ізотропні.
Кожне тіло під дією зовнішніх сил змінює свій розмір чи форму. Це явище називають деформацією. Деформації бувають пружними (для них справджується закон Гука) і пластичними (непружними). Важливими характеристиками властивостей матеріалів є: а) межа пружності — напруга, за якої в тілі виникає залишкова деформація; б) межа текучості — напруга, за якої починається пластична деформація; в) межа міцності — напруга, яку витримує тіло перед руйнуванням.
ОСНОВИ ТЕРМОДИНАМІКИ
Молекулярно-кінетична теорія пояснює властивості тіл і явища, які відбуваються в речовині, виходячи з характеру руху і взаємодії частинок — молекул або атомів, і досягає в цьому значних успіхів. Наприклад, тиск ідеального газу пояснюється бомбардуванням величезної кількості молекул стінок посудини, а кількісна залежність тиску від температури ґрунтується на зв'язку тиску з середньою кінетичною енергією поступального руху молекул газу.
Однак у ряді випадків методи молекулярної фізики виявляються занадто складними для кількісного опису явищ. Зокрема, для того щоб методами молекулярно-кінетичної теорії дістати кількісний зв'язок між параметрами реального газу, рідини або твердого тіла, слід враховувати сили, які діють між частинками речовини. Це в більшості випадків зробити складно, а часто взагалі неможливо.
Між тим багато співвідношень між параметрами стану речовини можна вивести, нічого не знаючи про внутрішній «механізм» явищ, які зумовлюють цей зв'язок. Розділ фізики, в якому вивчаються властивості тіл без врахування їх атомно-молекулярної будови, без використання уявлень про характер руху і взаємодії частинок, з яких ці тіла складаються, називається термодинамікою.
Термодинаміка розглядає властивості тіл і явища, які відбуваються в них, спираючись на певні загальні закони (начала) термодинаміки, які є узагальненням величезної кількості дослідних фактів. Закони термодинаміки і молекуляр- но-кінетична теорія доповнюють одне одного, розширюють можливості вивчення загальних властивостей макроскопічних систем, які складаються з великої кількості частинок.
Для опису явищ у термодинаміці використовуються поняття «термодинамічна система» і «термодинамічний про-
