
Grishina
.pdf
|
C dU . |
|
(4) |
||
|
V |
dT |
|
|
|
|
|
|
|
|
|
Изобарический процесс. |
Процесс |
называется изобарическим, |
когда |
||
= const и = const. При этом |
⁄ = const. Согласно уравнению (3) |
|
|||
СP dU |
p dU . |
|
(5) |
||
|
dT |
|
dT |
|
|
Из уравнения состояния (1) получим |
+ |
. |
|
||
В рассматриваемом случае |
= |
|
(6) |
||
Подставляя (7) в (5) и заменяя dU=на CV.dT, |
|
(7) |
|||
получим, что CP CV R. |
|||||
Теплоемкость газа при постоянном давлении CP больше теплоемкости того же газа при постоянном объеме CV, так как при изобарическом процессе теплота расходуется не только на увеличение внутренней энергии газа, но и на совершение работы против внешних сил.
Изотермический процесс. Изотермическим называется процесс, протекающий при постоянной температуре (Т = const). Для такого процесса dT = 0, dU = 0, dQ = dA, т. е. внутренняя энергия газа остается постоянной, а все подводимое тепло расходуется на работу.
Адиабатический процесс. Адиабатическим называется процесс, протекающий без притока и отдачи теплоты, т. е. при полной тепловой изоляции. Для него dQ = 0. Уравнение первого начала термодинамики примет вид
Q dU A 0 или dA dU .
Это означает, что в данном процессе работа расширения (или сжатия) газа совершается исключительно за счет изменения запаса внутренней энергии. Выведем уравнение, выражающее зависимость между объемом и давлением газа при адиабатическом процессе. Первое начало термодинамики для одного моля газа представим в виде
С |
+ |
= 0; |
= − |
, |
(8) |
уравнение Менделеева–Клапейрона (1) в виде |
= |
. Из последнего урав- |
|||
анения следует, что |
|
41 |
|
||
|
|
|
|
|
|

+ |
= . |
(9) |
Определяя из (8) значение dТ и подставляя его в уравнение (9), получим:
+= −
или
С |
+С |
= − |
. |
Учитывая, что R CP CV , упростим полученное выражение:
= − ,
откуда
С |
= − |
. |
(10) |
Уравнение (10) приведем к виду
= − |
|
|
|
. |
|
|
Известно, что отношение
CP . CV
Тогда
= − .
Интегрируя последнее выражение в соответствующих пределах, получим
ln |
|
= ln |
|
. |
|
|
Переходя от логарифмов к основаниям, получим
42

=.
Откуда
== const.
Последнее уравнение известно как уравнение адиабаты (или уравнение Пуассона) в координатах и V.
Применяя молекулярно-кинетическую теорию теплоемкости, вычислим значение показателя адиабаты. В частности, закон равномерного распределения энергии по степеням свободы (числом степеней свободы тела называется наименьшее число независимых координат, которые необходимо задать для того, чтобы полностью определить положение тела в пространстве) позволяет вычислить молярную теплоемкость вещества при постоянном объеме, принимая во внимание лишь изменение внутренней энергии системы.
При нагревании одного моль газа на 1К при V = const затраченное количество тепла численно равно CV . В этом случае работа газа равна нулю, и моляр-
ная теплоемкость численно равна изменению внутренней энергии одного моля газа при повышении его температуры на 1 К, т. е.
|
|
C |
i |
R T 1 |
i |
RT |
i |
R. |
|
||
|
|
|
|
|
|
||||||
|
|
V |
2 |
2 |
|
2 |
|
|
|
||
Отсюда следует, что для одноатомного газа |
= |
|
, для двухатомно- |
||||||||
го газа |
|
и для трехатомного газа |
Молярная теплоемкость |
||||||||
газа, таким= (5⁄2) |
|
|
|
|
|
= 3 |
|
|
|||
|
образом, определяется числом степеней свободы молекул. Вычис- |
||||||||||
лим теперь для соответствующих случаев значения теплоемкости CP и коэффициента . С учетом соотношения CP CV R имеем для одноатомного газа
= (3⁄2) + = (5⁄2) |
, для двухатомного газа |
= (7⁄2) |
и для трех- и |
|
. |
|
|||
многоатомного газа |
= 4 |
|
|
|
Известно, что |
|
|
|
|
CP CV R i 2 .
CV CV i
Отсюда для одноатомного газа
3 2 1.67, 3
43
для двухатомного газа
5 2 1.40, 5
и для трех- и многоатомного газа
6+2 = 6 = 1.3.
Установлено теоретически и подтверждено экспериментально, что отношениеCP 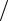 CV тем меньше, чем сложнее молекула.
CV тем меньше, чем сложнее молекула.
Экспериментальная часть работы
В данной работе величина определяется с помощью прибора Клемана-
Дезорма. Экспериментальная установка (рис. 1) состоит из стеклянного баллона А, к которому подведена трубка В, соединяющая баллон с насосом С. Давление в баллоне измеряется с помощью водяного манометра М.
Рис. 1. Схема экспериментальной установки
Адиабатический процесс можно осуществить быстрым сжатием или расширением газа. При быстром сжатии температура газа повышается, а при быстром расширении – понижается. Закрыв кран К, с помощью насоса быстро создают внутри баллона А давление выше атмосферного. При этом температура газа в баллоне повышается. Через две минуты газ охлаждается до комнатной
44
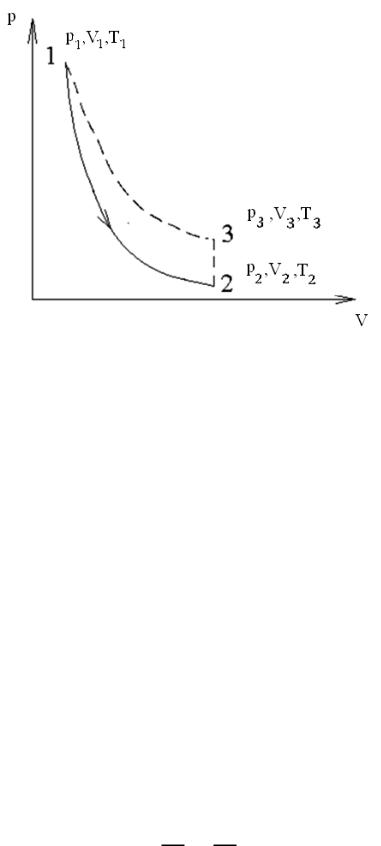
температуры T1 и давление немного падает. Это состояние соответствует точке 1 на графике (рис. 2).
Рис. 2. Графики изопроцессов
Откроем кран К. Газ начнет быстро расширяться. Через промежуток времени, равный 2–3 с, когда давление в баллоне сравняется с атмосферным, за-
кроем кран. Конечное состояние газа изобразится точкой 2. Если за V2 принять
объем баллона, то состояние 1 можно рассматривать как начальное для оставшейся в баллоне массы газа. Для этой массы процесс 1–2 представляет адиабатическое расширение. Следовательно,
= |
. |
(10) |
При расширении температура газа уменьшается |
T2 T1 . Однако через |
|
2–3 минуты газ нагреется до температуры окружающего воздуха T1 . Так как |
||
объем при этом не меняется, давление повысится до |
. Новое состояние будет |
|
соответствовать точке 3. Соответственно, точки 1 и 3 находятся на одной изотерме. По закону Бойля–Мариотта
= . |
(11) |
Возведя обе части уравнения (11) в степень γ и разделив полученный результат на (10), получим
= .
45

После логарифмирования имеем |
|
|
|
|
Упростим формулу (12), учитывая=, |
|
|
. |
(12) |
что |
|
|||
= + , |
= + , |
(13) |
||
где h1 и h2 – соответствующие избыточные давления, измеряемые манометром
в миллиметрах водного столба. Логарифмы выражений (13) разложим в ряд Тейлора, ограничиваясь при этом двумя первыми членами ряда. Имеем
ln = ln( + ) ≈ ln +
и
ln = ln( + ) ≈ ln + .
Подставив эти значения в формулу (12), окончательно получим
|
|
h1 |
. |
(14) |
|
h |
h |
||||
|
|
|
|||
|
1 |
2 |
|
|
Порядок выполнения работы
1. Нагнетают насосом немного воздуха в баллон при закрытом кране К. При накачивании воздух, сжимаемый под поршнем насоса, нагревается. Поэтому надо подождать 2–3 минуты пока, благодаря теплообмену, температура в баллоне не сравняется с комнатной. После этого измеряют манометром избыточное давле-
ниеh1 воздуха в сантиметрах водного столба.
2. Открывают кран К. В момент, когда уровни жидкости в обоих коленах манометра М сравняются, быстро его закрывают. Выждав 2–3 минуты, пока газ, охлажденный при адиабатическом расширении, нагревается до комнатной темпе-
ратуры, измеряют избыточное давление h2 . Следует помнить, что h1 и h2 отсчи-
тываются как разность высот жидкости в обоих коленах манометра.
3. По формуле (14) вычисляют . Результаты расчетов и погрешности заносятся в таблицу.
46

|
|
Таблица 1. Определение отношения теплоемкостей газа |
|
|||||
№ h1, |
h2 , |
|
|
S |
|
, |
|
|
|
||||||||
см |
см |
|
|
|
% |
|
|
|
1. |
|
|
|
|
|
|
|
|
2. |
|
|
|
|
|
|
|
|
3. |
|
|
|
|
|
|
|
|
4. |
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
|
|
Контрольные вопросы |
|
|
|
||
1.Написать и объяснить первое начало термодинамики.
2.Что такое CP и CV ? Почему CP >CV ?
3.Какой процесс называется адиабатическим? Вывести уравнение Пуассона в
координатах |
и в координатах |
. |
|
4. Как зависят, |
молярные теплоемкости, |
газа CP и CV от числа степеней свобо- |
|
ды? Что понимают под числом степеней свободы?
5.Объясните график, изображенный на рис. 2.
6.Чему равняется теоретическое значение для воздуха? Объясните возмож-
ное расхождение теоретического и экспериментально полученного в данной работе значений .
47
ЛАБОРАТОРНАЯ РАБОТА № 7
ОПРЕДЕЛЕНИЕ ПРИРАЩЕНИЯ ЭНТРОПИИ ПРИ ПЛАВЛЕНИИ ОЛОВА
Цель работы: экспериментально определить приращение энтропии при плавлении олова.
Краткие теоретические сведения
В термодинамике широко используется понятие обратимого и необратимого процессов. Тепловой процесс называют обратимым, если он допускает возвращение системы в первоначальное состояние без того, чтобы в окружающей среде произошли какие-либо изменения. Иными словами, процесс обратим, если при совершении его системой сначала в прямом, а затем в обратном направлениях в исходные состояния возвращается как сама система, так и все внешние тела, с которыми система взаимодействует. Всякий процесс, не удовлетворяющий этому условию, называют необратимым. Необходимым и достаточным условием обратимости теплового процесса является его равновесность. Это означает, что система при обратимом тепловом процессе должна проходить ряд последовательных равновесных состояний.
Обратимых процессов в природе не существует, хотя с точностью, доступной опыту, можно осуществить множество процессов практически неотличимых от обратимых. Необратимые процессы протекают в одном направлении. Так, например, газ может расширяться сам по себе, но не может сжиматься без приложения внешних сил. Тепло может самопроизвольно переходить от горячего тела к холодному. Только при затрате энергии (например, электроэнергии) тепло может переходить от холодного тела к более нагретому. При трении кинетическая энергия микроскопического движения всегда превращается во внутреннюю, но никогда не происходит самопроизвольный обратимый процесс. Необратимость всех остальных процессов в конечном счете связана с тем, что в каждом из них в той или иной степени присутствует один из перечисленных выше процессов. Что общего у всех этих необратимых, односторонних процессов? Общим является то, что в них возрастает некоторая физическая величина – энтропия. Энтропией S называется функция состояния системы, дифференциал которой в элементарном обратимом процессе равен отношению бесконечно малого количества теплоты, сообщенной системе при изотермическом процессе, к абсолютной температуре последней:
dS |
Q . |
(1) |
|
T |
|
48
Если переход системы осуществляется не между бесконечно близкими состояниями, то изменение энтропии при переходе из состояния 1 в состояние 2 при условии обратимости процесса будет определяться как
S |
S |
|
2 |
Q. |
(2) |
2 |
1 |
|
1 |
T |
|
|
|
|
|
Если переход между двумя состояниями системы необратим, то вместо знака равенства в выражениях (1) и (2) необходимо поставить знак «больше». Таким образом, для произвольного элементарного процесса
dS |
Q . |
(3) |
|
T |
|
Для теплоизолированной системы Q 0 и выражение (3) примет вид
dS 0. |
(4) |
Это неравенство справедливо для любого элементарного изменения состояния замкнутой системы.
Дело в том, что при передаче теплоты Q от одного тела системы к дру-
гому в обратимом процессе температуры обоих тел равны друг другу. Поэтому убыль энтропии тела 1, отдающего теплоту Q , в точности равна увеличению
энтропии тела 2, получающего эту теплоту:
− = ; + = 0.
Если же процесс теплообмена необратим (например, происходит при конечной разности температур, так что T1 T2 ), то убыль энтропии первого тела меньше, чем увеличение энтропии второго тела:
− < ; + > 0.
Из уравнения (1) следует, что количество теплоты, сообщенной рабочему телу при бесконечно малом обратимом изменении его состояния,
Q TdS,
где T – температура рабочего тела. В случае необратимого процесса
dS TQ ; Q TdS,
49
где T – температура того источника теплоты, который сообщает рабочему телу энергию Q в рассматриваемом процессе бесконечно малого изменения со-
стояния этого тела.
Для произвольного процесса
Q TdS.
Знак равенства относится к обратимым процессам, знак неравенства – к необратимым. Выражая элементарную теплоту Q из первого закона термодинамики:
Q dU A,
приведенное выше неравенство можно записать в следующей форме:
TdS dU A.
Если процесс обратимый, то из последнего неравенства следует, что
A dU TdS
или
A d U TS SdT.
Обозначим
F U TS.
Функция F представляет собой разность двух функций состояния тела, а поэтому также является новой функцией его состояния. Эту величину называют свободной энергией.
Если рабочее тело совершает обратимый изотермический процесс, то dT 0 и из уравнения
A dF SdT
имеем
Aизот dF.
Интегрируя это равенство в пределах обратимого изотермического перехода тела из состояния 1 в состояние 2, получим
Aизот F1 F2 .
50
