
- •Кафедра органической, физической и коллоидной химии
- •Ю.И.Блохин
- •Оглавление
- •Введение
- •1. Классификация галогенопроизводных
- •2.Изомерия и номенклатура
- •3.Методы получения
- •4. Физические свойства
- •5. Химические свойства
- •1. Реакции нуклеофильного замещения (sn1 и sn2)
- •2.Реакции β-элиминирования (е1 и е2).
- •6. Отдельные представители
- •7. Вопросы для контроля
- •Литература
- •Заказ №
2.Реакции β-элиминирования (е1 и е2).
Отщепление галогеноводородов
Галогенопроизводные способны также отщеплять галогеноводороды с образованием олефинов. Отщепление происходит под действием на галогеналканы спиртовых растворов щелочей:

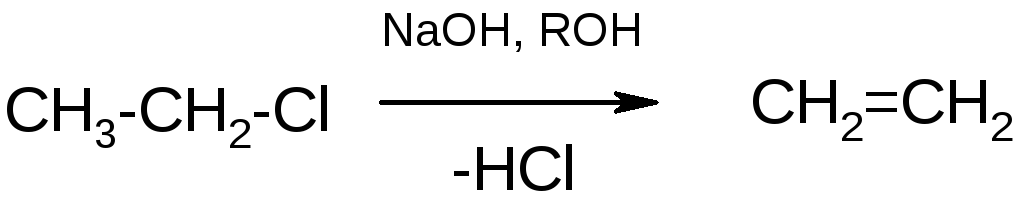
Элиминирование происходит по ионным механизмам Е1 и Е2.
Реакции, протекающие по Е1 – механизму, не требуют каких – либо реагентов, но необходим ионизирующий растворитель. Стадией определяющей скорость реакции, является образование интермедиата – карбкатиона, который переходит в стабильное состояние (олефин), отщепляя протон под действием появляющегося в реакционной смеси более основного алкоксил – иона (RO-).

эта стадия протекает быстро
Реакции отщепления Е1 обычно сопровождаются процессами замещения SN1.
Разветвленность алкильной группы способствует увеличению выхода олефина.
Реакции отщепления, протекающие по бимолекулярному механизму Е2, требуют присутствия основания. Отрыв протона и потеря галогена происходят одновременно (без промежуточного соединения), через переходное состояние, в котором нуклеофил образует связь с протоном в той мере, в какой происходит отщепление галогена:

изопропилбромид переходное состояние
Скорость Е2 реакции пропорциональна концентрации обоих реагентов. Обычно на ряду с отщеплением происходит и нуклеофильное замещение по механизму SN2. Для первичных алкилгалогенидов преобладают реакции замещения, а для третичных – реакции элиминирования, причем в продуктах реакции всегда содержатся более замещенные алкены, энергетически более выгодные (правило Зайцева).
Активность оснований в реакциях, протекающих по механизму Е2, изменяется в том же направлении, что и их сила:
-NH2>C2H5O->-OH>CH3COO-
При обоих механизмах скорость отщепления Н – Х убывает в ряду: третичные > вторичные > первичные и I >Br > Cl.
Кроме указанных реакций нуклеофильного замещения (SN1 и SN2.) и β – элиминирования (Е1 и Е2) для галогенопроизводных характерны и другие превращения.]
3. Замещение атомов галогена водородом.
Это происходит при каталитическом гидрировании галогенопроизводных или действии на них водородом в момент выделения, а также иодоводородом:
H2,
катализатор
RI → RH + HI
C2H5I + HI → C2H6 + I2
4. Взаимодействие с солями галогеноводородной кислоты.
При этом если заменяют хлор бромом или иодом, то следует вести реакцию с солями щелочных металлов, хлориды которых труднее растворимы, чем бромиды и йодиды. При замещении галогена с большей атомной массой галогеном с меньшей массой необходимо применять соли серебра, т.к. иодид серебра менее растворим, чем бромид и особенно хлорид:
![]()
5.Реакция Вюрца
При взаимодействии галогеналкилов с металлическим натрием образуются алканы с удвоенным числом углеродных атомов:
2СН3(СН2)3Br + 2Na → CH3(CH2)6CH3 + 2 NaBr
1-бромбутан октан
6. Получение магнийорганических соединений.
При действии на алкилгалогениды магния в среде абсолютного эфира образуются магнийорганические соединения, называемые реактивами Гриньяра, например: эфир
СН3СН2I + Mg → CH3CH2MgI
йодэтан этилмагнийиодид
7. Реакции с алкоголятами
При взаимодействии алкилгалогенидов с алкоголятами образуются простые эфиры:
С2Н5Br + NaOC2H5 → С2Н5OC2H5 + NaBr
бромистый этилат диэтиловый
этил натрия эфир
При этом возможно образование непредельных углеводородов.
8. Взаимодействие с аммиаком и аминами
Продуктами реакции являются первичные, вторичные или третичные амины, а также соли аммониевых оснований:
NH3
CH3I + NH3 → [CH3NH3]+I- → CH3NH2 + NH4I и т.д.
первичный амин
(метиламин)
9. Взаимодействие с солями синильной кислоты
KCN
СН4 + Сl2 → CH3Cl → CH3CN (ацетонитрил)
Тем самым можно перейти от предельных углеводородов к карбоновым кислотам.
10. Взаимодействие с солями органических кислот:
t0C
C2H5I + AgO-C(O)CH3 → CH3C(O)OC2H5 + AgI
ацетат серебра этиловый эфир уксусной
кислоты(этилацетат)
11. Реакции с нитритом серебра:

1-нитроэтан, 2-этилнитрит
В этой реакции атакующая нуклеофильная частица – NO2- проявляет двойственную реакционную способность (амбидентные свойства), т.е. может присоединять радикал по азоту (механизм SN2) или кислороду (механизм SN1):

1-нитросоединение, 2-нитрит
Механизм и направление реакции зависят от природы растворителя. Так, сольватирующие растворители (вода, спирты) способствуют образованию эфира.
12. Взаимодействие с металлами
При действии на галогенопроизводные многих металлов (двухкратный избыток) галоген замещается металлом. Это важный метод синтеза металлорганических соединений:
эфир
C2H5Br + 2 Li → C2H5Li + LiBr
этиллитий
