
- •Кафедра органической, физической и коллоидной химии
- •Ю.И.Блохин
- •Оглавление
- •Введение
- •1. Классификация галогенопроизводных
- •2.Изомерия и номенклатура
- •3.Методы получения
- •4. Физические свойства
- •5. Химические свойства
- •1. Реакции нуклеофильного замещения (sn1 и sn2)
- •2.Реакции β-элиминирования (е1 и е2).
- •6. Отдельные представители
- •7. Вопросы для контроля
- •Литература
- •Заказ №
4. Физические свойства
Физические свойства галогенопроизводных зависят от строения радикала (линейное или разветвленное), вида и количества атомов галогена в молекуле. В частности, для моногалогенопроизводных температура кипения и плотность возрастают с увеличением длины углеродной цепи и при переходе от фтора к йоду. Дигалогенопроизводные представляют собой тяжелые масла или твердые вещества.
Все галогенопроизводные в воде практически не растворяются, но хорошо растворяются в органических растворителях. Они имеют специфический, как правило резкий запах, раздражающий слизистую оболочку. Некоторые из них обладают анестезирующим действием (СН2Сl2, СНСl3), токсичны и являются антисептиками (СНI3).
5. Химические свойства
Галогенопроизводные углеводородов являются одним из наиболее реакционноспособных классов органических соединений. Наиболее характерны для этого класса соединений реакции нуклеофильного замещения (SN) и отщепления (элиминирования, Е). Высокая реакционная способность галогенопроизводных в этих реакциях обусловлена строением их молекул. Так, в молекуле СН3Сl ковалентная связь между атомом углерода и галогеном поляризована из-за большой электроотрицательности атома хлора (-I- эффект). Поэтому электронная плотность у атома углерода понижается:

Вследствие этого углеродный атом легко атакуется молекулами или ионами, представляющими свою электронную пару (нуклеофильный реагент) для образования новой связи. Электроны разрывающейся связи уходят вместе с освобождающимся ионом:
 - (нуклеофильное
замещение SN)
- (нуклеофильное
замещение SN)
Субстрат нуклеофил продукт уходящая группа
Нуклеофильными реагентами называют атомы или группы атомов, а также молекулы, которые являются донорами электронной пары при образовании связи с любым элементом, кроме водорода.
Нуклеофильные реагенты (примеры)
а) отрицательно заряженные ионы:
:OH-, :I-, :CN-, CH3O:-, CH3C(O)O:-, :Br-, :Cl-
б) нейтральные молекулы, имеющие неподеленную электронную пару (НЭП) на гетероатомах:
H2O, CH3OH, NH3, CH3NH2, C6H5OH, C6H5NH2
реакционная способность галогеналканов в реакциях нуклеофильного замещения зависит от нескольких факторов:
а) от строения углеводородного радикала (линейное или разветвленное);
б) от галогена;
в) от атакующего нуклеофила;
г) от условий реакции (температура, наличие или отсутствие катализатора);
д) от характера растворителя, в котором идет реакция.
Указанные факторы влияют и на механизм реакции.
1. Реакции нуклеофильного замещения (sn1 и sn2)
Реакции нуклеофильного замещения в галогенах могут протекать по двум механизмам: SN1 – реакции мономолекулярного нуклеофильного замещения и SN2 – реакции бимолекулярного нуклеофильного замещения.
Реакции SN2 протекают при действии на субстраты* сильных нуклеофильных реагентов.
Одним из характерных примеров реакции SN2 является щелочной гидролиз метилбромида:
CH3-Вr + NaOH → CH3OH + NaBr
(NaOH + H2O)
Механизм реакции:
Скорость реакции SN2 подчиняется кинетическому уравнению второго порядка:
V = K[CH3Br][OH-]
т.е. пропорциональна концентрации субстрата и нуклеофилов – -ОН.
Таким образом в данной реакции в стадии, определяющей ее скорость, участвуют две частицы – Гидроксид – ион и метилбромид.
__________
*Субстрат – это один из реагентов, имеющий, как правило, более сложное строение.
Гидроксид – анион атакует атом углерода, имеющий частичный положительный заряд, со стороны, противоположной атому брома («с тыла»), как пространственно наиболее доступной стороны:

переходное состояние
(активированный комплекс)
По мере приближения к углеродному атому нуклеофильного реагента, последний оказывает все большее влияние на атомы водорода метильной группы – отталкивая их, что сопровождается постепенным удалением этих атомов друг от друга (атомы «раздвигаются»). В переходном состоянии атом углерода и три атома водорода метильной группы располагаются в одной плоскости, перпендикулярной плоскости доски. Угол между связями составляет 120ºС (sp2 - гибридизация). В переходном состоянии образование связи углерод – кислород и разрыв связи углерод – бром происходят одновременно. Отрицательный заряд в этом переходном состоянии распределен между вступающей (OH-) и уходящей (Br-) группами, а атом углерода остается практически незаряженным. Углы между связями в молекуле CH3ОН составляют, как и в субстрате, 109º (sp3 - гибридизация), но при этом происходит обращение конфигурации на противоположную (инверсия).
В реакциях SN2 реакционная способность галогеналканов определяется главным образом пространственными факторами и снижается с увеличением числа заместителей у атома углерода, связанного с галогеном:
СН3Х >СН3СН2Х>(СН3)2СНХ>>(СН3)3СХ
галогеналканы первичные вторичные третичные
галогеналканы галогеналканы галогеналканы
Реакции SN1 принципиально отличаются от реакций SN2 . Реакции SN1 часто протекают при действии на субстраты слабыми нуклеофильными реагентами, которые, как правило, являются и растворителями. Так, при использовании в качестве растворителя воды или спиртов протекают реакции гидролиза или алкоголиза соответственно. Примером реакции SN1 может быть, гидролиз трет – бутилбромида:

Механизм реакции:
В данном случае скорость реакции не зависит от концентрации воды, т.к. нуклеофил не участвует в первой стадии процесса. Реакция SN1 идет в соответствии с кинетическим уравнением 1 – го порядка V=K[(CH3)3CBr].
Это двухстадийный процесс. Первая стадия – диссоциация галогеналкана на ионы (мономолекулярная реакция):
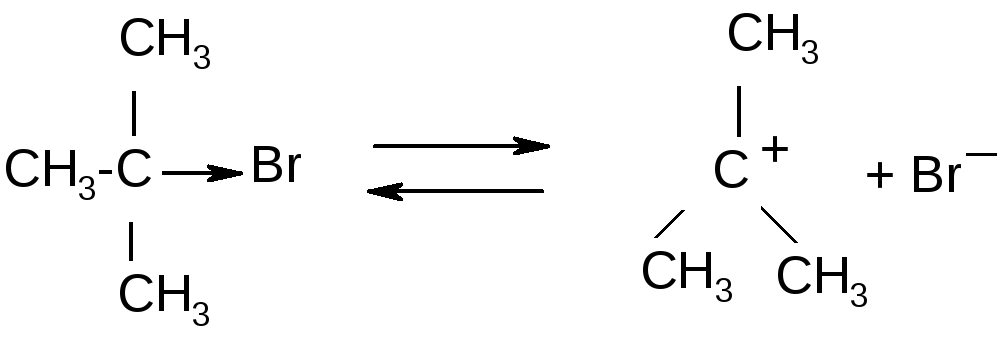
карбкатион – стабилизирован
внутримолекулярными электронными эффектами (+Iэффект)
Далее карбкатион быстро реагирует с молекулами реагента или растворителя, способными предоставлять пару электронов для заполнения вакантной орбитали положительно заряженного углеродного атома.
 - эта стадия реакции
протекает быстро
- эта стадия реакции
протекает быстро
ОН-- реагент
 - процесс H2O– растворитель
протекает быстро
- процесс H2O– растворитель
протекает быстро
 Карбкатион
имеет плоское строение, поэтому он
атакуется нуклеофилом равновероятно
с обеих сторон образуются продукты –
спирты одинаковой конфигурации с
исходным бромалканом, и обратной
конфигурации т.е. образуется эквимолекулярная
смесь анантиомеров (рацемическая смесь).
Карбкатион
имеет плоское строение, поэтому он
атакуется нуклеофилом равновероятно
с обеих сторон образуются продукты –
спирты одинаковой конфигурации с
исходным бромалканом, и обратной
конфигурации т.е. образуется эквимолекулярная
смесь анантиомеров (рацемическая смесь).
Реакционная способность галогеналканов в реакциях SN1 изменяется в обратном порядке по сравнению с SN2.
Третичный > вторичный >> первичный > СН3
Таким образом реакция замещения SN2 характерна для СН3X и первичных галогенпроизводных, а SN1 для третичных. В случае вторичных галогеналканов наблюдается смешанный механизм реакции.
Активность галогенопроизводных возрастает с увеличением молекулярной массы галогена: атом йода более подвижен чем хлора. Это связано с тем, что по мере увеличения размера атома уменьшается прочность связи между ядром и электронами внешней электронной оболочки, участвующими в образовании связи С-X. В ряду связей С-F, С-Cl, С-Br, С-I реакционная способность в процессах SN возрастает, поскольку в этом ряду увеличивается длина связи С-X, ее поляризуемость и легкость отщепления галогена.
Если атом галогена находится у ненасыщенного атома углерода или связан с углеродным атомом бензольного кольца, например, в молекулах винилхлорида (СН2=СНСl) или хлорбензола (С6Н5Сl), где С – атомы находятся в sp2 – гибридизации, происходит сопряжение орбиталий π- электронов двойной связи или бензольного ядра с НЭП атома галогена (+М эффект). Поэтому подвижность атома галогена в таких соединениях резко снижается. Если же галоген находится у атома углерода, расположенного в
α –положении к двойной связи (СН2=СН–СН2Cl - аллилхлорид) «аллильное» положение или – к углеродному атому бензольного кольца (С6 Н5 СН2Cl - бензилхлорид) – «бензильное» положение, то этот галоген обладает повышенной реакционной способностью в реакциях SN1. Это связано с более легкой диссоциацией связи С-X и дополнительной стабилизацией катиона за счет сопряжения.

Когда атом галогена еще больше удален от двойной связи или бензольного кольца, то он по своей реакционной способности не отличается от галогеналканов, например,
CH2=CH-(CH2)4-CH2-Cl; С6Н5-СН2-СН2-СН2-Cl
7-хлор-1-гептен 1-хлор-3-фенилпропан
При проведении реакции нуклеофильного замещения подбирают такой растворитель, в котором растворяются оба реагирующих вещества и который способствует разрыву связи С-X.
Используя реакцию нуклеофильного замещения, можно получать из галогеналканов не только спирты, но и другие классы органических соединений (нитрилы, амины, нитросоединения). Во всех этих реакциях в молекулу нового соединения вводится алкил, поэтому галогенпроизводные являются алкилирующими реагентами.
