
- •Кафедра органической, физической и коллоидной химии
- •Ю.И.Блохин
- •Оглавление
- •Введение
- •1. Классификация галогенопроизводных
- •2.Изомерия и номенклатура
- •3.Методы получения
- •4. Физические свойства
- •5. Химические свойства
- •1. Реакции нуклеофильного замещения (sn1 и sn2)
- •2.Реакции β-элиминирования (е1 и е2).
- •6. Отдельные представители
- •7. Вопросы для контроля
- •Литература
- •Заказ №
3.Методы получения
1. Замещение атомов водорода в углеводородах на галоген.
Таким образом галогенируют алканы, циклоалканы, бензол и его гомологи, алкены.
В частности, хлорирование метана широко применяется в промышленности. Реакция идет на свету (под действием УФ-облучения; hv) и в темноте (при нагревании 250-4000С или в присутствии катализаторов - хлориды меди, сурьмы, олова или йод). При этом газообразный хлор последовательно замещает в молекуле метана все четыре атома водорода с образованием соответствующих галогенопроизводных:
CH4 + Cl2 → CH3Cl + HCl
метан хлорметан
(хлористый метил)
CH3Cl + Cl2 → CH2Cl2 + HCl
дихлорметан
(хлористый метилен)
CH2Cl2 + Cl2 → CHCl3 + HCl
трихлорметан
(треххлористый углерод,хлороформ)
CHCl3 + Cl2 → CНCl4 + HCl
тетрахлорметан
(четыреххлористый углерод)
В реакциях с алканами галогены располагаются по своей реакционной способности в следующем порядке:
F > Cl > Br > I
При этом фтор реагирует с алканами очень активно и реакции обычно сопровождаются взрывами, а йод вообще не взаимодействует, так как образующийся HI является очень сильным восстановителем и восстанавливает образовавшееся иодпроизводное снова до углеводорода.
Галогенирование алканов как под действием света (реакция металепсии),так и при высоких температурах протекает по радикально-цепному механизму и является реакцией радикального замещения (SR):
на стадии I при УФ-облучении (фотохимическое галогенирование) или повышенных температурах (термическое галогенирование) молекулы галогена распадаются на радикалы:
hν; tºC
I .
Cl
: Cl
Cl
• + Cl
• - инициирование (зарождение) цепи
.
Cl
: Cl
Cl
• + Cl
• - инициирование (зарождение) цепи
На стадии II и III происходит исчезновение одних и появление других свободных радикалов.


I

 I.
СН4
+ Сl
• •CН3
+ НCl
развитие
I.
СН4
+ Сl
• •CН3
+ НCl
развитие
(рост) цепи
I
 II.
•СН3
+ Cl : Cl CH3Cl
+ Cl•
II.
•СН3
+ Cl : Cl CH3Cl
+ Cl•
Рост цепи продолжается до тех пор пока не прекратят свое существование свободные радикалы. При отсутствии свободных радикалов в реакционной смеси происходит обрыв цепи – IV. На стадии IV возможны разные варианты соединения радикалов, содержащихся в реакционной смеси.
I

 V.
• СН3
+ Cl
• CH3Cl;
Cl
• + Cl
• Cl2;
• СН3
+ • СН3
СН3
- СН3
V.
• СН3
+ Cl
• CH3Cl;
Cl
• + Cl
• Cl2;
• СН3
+ • СН3
СН3
- СН3
Аналогично идет, например, хлорирование этана:
СН3 - СН3 + Сl2 → Н3С – СН2Сl + НСl
Однако прямое хлорирование алканов с большей длиной углеродной цепи приводит к смеси продуктов, выделение из которой целевого хлорпроизводного является сложной задачей, в частности:
hv
С Н3
– СН2
– СН3
+ Сl2
CH3
– CH2
– CH2Cl
+ CH3
– CH – CH3
+ HCl
Н3
– СН2
– СН3
+ Сl2
CH3
– CH2
– CH2Cl
+ CH3
– CH – CH3
+ HCl
 пропан
1-хлорпропан
пропан
1-хлорпропан
Cl
2-хлорпропан
Галогенирование циклоалканов происходит в тех же условиях:

циклогексан бромциклогексан
(циклогексилбромид)
Бензол и его гомологи галогенируются (хлорируются) легче, чем алканы. Так, на холоду и в присутствии катализаторов (AlCl3, FeCl3) галоген замещает атомы водорода в бензольном кольце, а при нагревании или на свету без катализатора замещаются атомы водорода в боковой цепи:

1 – о-хлортолуол, 2 – п-хлортолуол, 3 – бензилхлорид, 4 – бензилиденхлорид, 5 – бензотрихлорид
Реакция идёт в газовой среде (пропускание хлора в парах толуола)
При высокой каталитической активности AlCl3 в процессе хлорирования бензола все атомы водорода могут быть замещены на галоген:
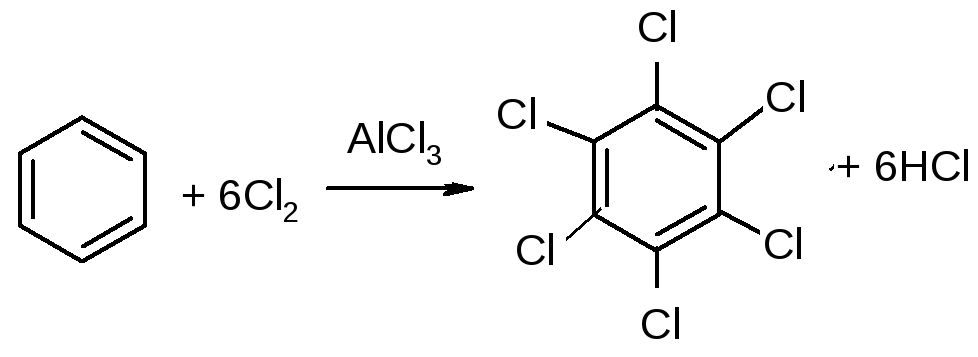
бензол гексахлорбензол
Под действием ультрафиолетового излучения без катализатора к молекуле бензола может присоединяться три молекулы хлора или брома:
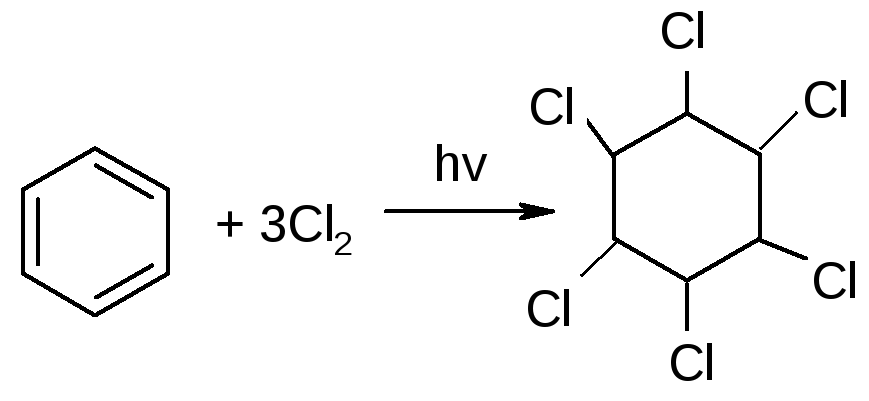
бензол гексахлорциклогексан (гексахлоран) –
промышленный способ получения
При высоких температурах (400-6000С) атомы водорода в алкенах замещаются на атомы галогена, не затрагивая двойной связи:
tºC
 СН2
= СН
– СН3
+ Сl2
CH2
= CH – CH2Cl
+ HCl
СН2
= СН
– СН3
+ Сl2
CH2
= CH – CH2Cl
+ HCl
пропилен аллилхлорид
2. Присоединение галогенов к ненасыщенным углеводородам в среде растворителя при комнатной температуре, в темноте (галогенирование алкенов):
 СН2
= СН2
+ Br2
СН2Br
– CH2Br
СН2
= СН2
+ Br2
СН2Br
– CH2Br
этилен 1,2 – дибромэтан
Механизм реакции начинается электрофильной атакой двойной связи молекулой брома. Молекула галогена поляризуется под влиянием π-электронов двойной связи и конечный атом Br, несущий частичный положительный заряд δ+, выступает как электрофильный агент, захватывая π- электроны двойной связи с образованием неустойчивого π- комплекса (I).

 +
+



 медленно
СН2
– СН2 Н2С
– CH2
быстро
медленно
СН2
– СН2 Н2С
– CH2
быстро







 СН2= СН2+Br2
CH2= СН2
или + + Br-
→ СН2-СН2
СН2= СН2+Br2
CH2= СН2
или + + Br-
→ СН2-СН2

 Вr:
Вr
Br
Br
Вr:
Вr
Br
Br
Br δ+ - Brδ - карбокатион ион бромония 1,2-дибромэтан
π –комплекс (δ-комплекс) (бромониевый катион)
I II III
Затем двойная связь и связь между атомами галогена разрываются гетеролитически с образованием δ-комплекса (II) или бромониевого катиона (III), из которых под действием аниона Br- быстро образуется 1,2-дибромэтан.
3. Присоединение галогеноводородов к ненасыщенным углеводородам
(гидрогалогенирование):
 CH2
= CH2
+ HBr CH3
– CH2Br
CH2
= CH2
+ HBr CH3
– CH2Br
этилен бромэтан

![]() +
НCl
CH2
= CHCl
+
НCl
CH2
= CHCl
ацетилен винилхлорид
К несимметричным олефинам галогеноводороды присоединяются по правилу Марковникова т.е. водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода, а галоген - к другому ненасыщенному углеродному атому:
 СН3
– СН
= СН2
+ НCl
CH3
– CH – CH3
СН3
– СН
= СН2
+ НCl
CH3
– CH – CH3

Cl 2-хлорпропан
Механизм реакции подтверждает правило Марковникова:

I–энергетически не выгодный малоустойчивый карбкатион, т.к. положительный заряд компенсируется +Iэффектом только одного радикала.II– энергетически выгодный устойчивый карбкатион, т.к. положительный заряд на С2– атоме компенсируется +Iэффектом двух СН3– групп. Поэтому реакция идёт через устойчивый карбкатионII.
Необходимо отметить, что правило Марковникова соблюдается только при гетеролитическом механизме присоединения галогеноводородов к алкенам (АЕ). В присутствии перекисей (что характерно только для НBr) эти реакции протекают по радикальному механизму вопреки правила Марковникова (перекисный эффект Хараша):
НBr
 СН3
– СН
= СН2
CH3
– CH2
– CH2Br
СН3
– СН
= СН2
CH3
– CH2
– CH2Br
H2O2 1 - бромпропан
механизм реакции:

 2
НBr
+ O2
2Br • + H2O2;
HBr + H2O2
Br • + [H3O2]
•
2
НBr
+ O2
2Br • + H2O2;
HBr + H2O2
Br • + [H3O2]
•

 CH3
– CHBr –CH2•
CH3
– CHBr –CH2•
CH3 – CH = CH2 +Br •→ I
НBr

 CH3–CH–CH2Br
CH3
– CH2
– CH2Br
+ Br• и
т.д.
CH3–CH–CH2Br
CH3
– CH2
– CH2Br
+ Br• и
т.д.
II
I. менее устойчивый радикал т.к. свободный электрон вступает во
взаимодействие с электронным облаком только одной соседней С – Н
связи.
II. устойчивый радикал т.к. свободный электрон вступает во взаимодействие с
электронными облаками пяти соседних связей С – Н.
4. Получение галогенопроизводных из спиртов.
При действии на спирты галогеноводородом, пятихлористым фосфором (РСl5) или хлористым тионилом (SOCl2) гидроксильная группа замещается на атом галогена:
tºC,CaCl2
 С2Н5ОН
+ НСl
C2H5Cl
+ H2O
С2Н5ОН
+ НСl
C2H5Cl
+ H2O
этанол этилхлорид
(хлористый этил)
 С2Н5ОН
+ РCl5
C2H5Cl
+ РОСl3
+ HCl
С2Н5ОН
+ РCl5
C2H5Cl
+ РОСl3
+ HCl
пятихлористый хлорокись
фосфор фосфора
 С2Н5ОН
+ SOCl2
C2H5Cl
+ SO2↑
+ HCl↑
С2Н5ОН
+ SOCl2
C2H5Cl
+ SO2↑
+ HCl↑
хлористый
тионил
При использовании в качестве галогенирующего реагента галогеноводорода необходимо применять водоотнимающее средство (например CaCl2), которое связывает образующуюся воду и предотвращает гидролиз полученных галогеноалкилов.
В реакциях с РСl5 в качестве побочного продукта образуется хлорокись фосфора- жидкое вещество как и целевой продукт С2Н5Сl. Поэтому разделение этих двух жидкостей составляет дополнительные технологические трудности.
Наиболее удобно использовать в этих реакциях хлористый тионил, так как побочные продукты SO2 и НСl являются газообразными веществами, которые легко удаляются от основного продукта C2H5Cl.
