
Термодинамика ч1 - Сотский А.Б
..pdfМИНИСТЕРСТВО ОБРАЗОВАНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ
Учреждение образования «МОГИЛЕВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
им. А.А. КУЛЕШОВА»
КУРС ЛЕКЦИЙ ПО ТЕРМОДИНАМИКЕ И СТАТИСТИЧЕСКОЙ ФИЗИКЕ
В трех частях
Часть 1
ТЕРМОДИНАМИКА
Для студентов физико-математических факультетов
Могилев 2008
УДК 536.7(075.8) ББК 22.317я73
Печатается по решению редакционно-издательского совета МГУ им. А.А. Кулешова
Автор:
А.Б. Сотский
Рецензенты
доктор физико-математических наук, заведующий кафедрой физики ГУВПО «Белорусско-Российский университет»
А.В. Хомченко,
кандидат физико-математических наук, профессор кафедры ФТД УО «МГУ им. А.А.Кулешова»
Е.Е. Сенько
Лекции по термодинамике и статистической физике. В 3 частях. Часть 1. Термодинамика / Автор: А.Б. Сотский. – Могилев: МГУ им. А.А. Кулешо-
ва, 2008. - с.: ил.
Курс лекций предназначен для студентов всех специальностей физикоматематических факультетов университетов и соответствует действующим учебным программам.
УДК 536.7(075.8) ББК 22.317я73
2
Глава 1. ОСНОВНЫЕ СООТНОШЕНИЯ ТЕРМОДИНАМИКИ
§ 1. Введение
Объектом исследования термодинамики и статистической физики являются макроскопические тела, или макротела, состоящие из большого числа частиц.
В термодинамике состояния макротел характеризуют небольшим числом параметров – P,V ,T , S,... Предметом термодинамики являются соотношения между этими макроскопическими параметрами. Данные соотношения включают уравнения состояния систем и известные начала термодинамики. Последние выполняются независимо от конкретной природы макротел. Они представляют собой результат обобщения огромного числа экспериментальных данных, т.е. имеют феноменологический характер.
Термодинамический метод исследования макротел отличается простотой. В нем используются свойства полных дифференциалов, которые при условии экспериментального задания небольшого числа коэффициентов в уравнениях состояния позволяют решить множество теплотехнических задач.
Статистический метод изучения свойств макротел, в противоположность термодинамическому, основан на определенных модельных представлениях о микроскопической структуре тел. Его цель состоит в том, чтобы, зная законы поведения отдельных частиц, из которых состоит макротело, установить законы поведения макроскопического количества вещества. Статистический метод значительно сложнее термодинамического и ограничен рамками применимости той или иной микроскопической модели вещества. Однако этот метод позволяет решить проблемы, недоступные термодинамическому методу. Наиболее важная из них – обоснование термодинамических уравнений состояния и установление границ их применимости.
Статистический и термодинамический методы изучения свойств макротел не имеют точной разделяющей их границы. Поэтому иногда эти методы рассматривают вместе как статистическую термодинамику. Но обычно, согласно сложившейся традиции, под статистической физикой понимают раздел физики, посвященный изучению свойств макроскопических тел на основе моделей, в которых эти тела состоят из большого числа одинаковых частиц (молекул, атомов, электронов, фотонов и т.д.), исходя из свойств этих частиц и взаимодействий между ними. Термодинамикой называется физическая наука о наиболее общих свойствах макроскопических тел, находящихся в состоянии термодинамического равновесия и о процессах перехода между этими состояниями.
3
Начнем изучение нашего курса с термодинамики. Это позволит лучше усвоить понятия, которыми оперируют и термодинамика и статистическая физика.
§ 2. Основные понятия термодинамики
Термодинамика, как и любая другая теоретическая схема, использует некоторые физические величины являющиеся членами линейных пространств, т.е. представимые точками на соответствующих числовых осях и некоторые законы, связывающие эти величины. Сами термодинамические величины и связывающие их законы являются обобщением опытных данных.
В основе термодинамики лежат три экспериментальных принципа: принцип температуры, который иногда называют нулевым началом термодинамики, принцип энергии, или первое начало термодинамики и принцип энтропии, или второе начало термодинамики.
Перед рассмотрением этих принципов следует обсудить понятия равновесных состояний и процессов.
Очевидно, что формулировка законов термодинамики предполагает существование однозначно заданных термодинамических параметров, которые эти законы связывают. Однако указать такие параметры удается не всегда. Трудности возникают при рассмотрении быстро протекающих процессов. Например, представим себе сосуд с перегородкой, одна часть которого заполнена газом, находящимся при давлении P и температуре T , а вторая часть – пустая. Пусть в какой-то момент времени перегородка устраняется. Газ, естественно, начнет расширяться, и в процессе этого расширения ни его объем, ни давление, ни температура не могут быть заданы однозначно.
Другой пример, в котором термодинамические параметры не могут быть заданы однозначно – это системы с локальным нагревом. В частности, можно рассмотреть кусок стекла, нагреваемый сфокусированным лазерным пучком. Температура такого объекта не может быть охарактеризована одним числом.
Подобная ситуация имеет место и при распространении звука в среде. В этом случае в каждой точке среды в данный момент времени будет свое давление.
Названные ситуации представляют собой примеры так называемых неравновесных систем. В некотором приближении такие системы могут быть описаны локальными значениями термодинамических параметров, которые, очевидно, будут полевыми переменными. При этом в неравновесных системах присутствуют пространственные градиенты термодинамических параметров.
4
Опыт показывает, что наличие этих градиентов порождает пространственные потоки вещества и энергии. Результатом таких потоков, при неизменных внешних условиях, является постепенное исчезновение градиентов термодинамических параметров. Таким образом, с течением времени любая термодинамическая система, при неизменных внешних условиях, приходит в состояние, которое может быть однозначно охарактеризовано конкретными значениями термодинамических параметров.
Термодинамические системы, в которых термодинамические параметры имеют одно и то же значение во всех точках и остаются неизменными сколь угодно долго при неизменных внешних условиях, называются равновесными.
Время перехода неравновесной системы в состояние равновесия называется временем релаксации. Для каждого термодинамического параметра характерно свое время релаксации. При этом временем релаксации для всей системы будет максимальное из времен релаксации ее термодинамических параметров.
Термодинамика обычно рассматривает процессы, которые протекают достаточно медленно, так что выполняется неравенство
θ >> θr , |
(2.1) |
|||
где θ − характерный временной масштаб протекания процесса, т.е. |
||||
∂ p |
|
p |
|
|
∂ t |
~ |
|
, |
|
θ |
|
|||
где р – любой термодинамический параметр, θr |
− время релаксации этого |
|||
параметра. При выполнении условия (2.1) значения всех термодинамических параметров будут успевать выравниваться на всех этапах процесса. Поэтому такие процессы представляют собой цепочку бесконечно близких друг к другу равновесных состояний. Данные достаточно медленные процессы называются равновесными.
Вследствие того, что равновесные процессы могут рассматриваться как последовательность статических состояний, в них невозможно указать значения временных производных параметров. Это означает, что любой равновесный процесс может быть обращен во времени. При этом в обратном процессе система пройдет через те же состояния, что и в прямом процессе. В связи с этим равновесные процессы называют также обратимыми.
Еще надо отметить, что значения термодинамических параметров равновесных систем не могут быть заданы независимо друг от друга. Эти параметры оказываются связанными некоторыми уравнениями. Такие уравнения называют уравнениями состояния.
В термодинамике вводится опытный постулат, ограничивающий возможную структуру уравнений состояния.
Чтобы его сформулировать, надо отметить, что все термодинамические параметры разделяются на внутренние и внешние.
5
Величины, определяемые положением внешних по отношению к рассмотренной системе тел, называют внешними параметрами системы. Примеры таких параметров – объем системы, напряженность внешнего электрического или магнитного поля, и т.д.
Величины, определяемые положениями и состояниями частиц системы, называют внутренними параметрами системы. Примеры таких параметров – давление, внутренняя энергия, энтропия, магнитный момент, и т.д.
Рассматриваемый постулат звучит так: каждый внутренний параметр однородной (гомогенной) равновесной термодинамической системы, содержащей неизменное количество вещества, является функцией всех внешних параметров и температуры.
Термодинамические системы подразделяются на моновариантные и поливариантные. В моновариантных системах имеется всего один внешний параметр, а в поливариантных системах таких параметров может быть несколько.
Последний постулат означает, что моновариантная система имеет две степени свободы, т. е. характеризуется двумя независимыми переменными, в качестве которых могут быть выбраны два любых термодинамических параметра. Например, в качестве таких параметров могут быть взяты объем V и температура T . Но согласно постулату, внутренняя энергия системы E является функцией E = E(V ,T ) . Если выразить отсюда T через
V и E , то независимыми переменными станут V и E , и т. п. Число же степеней свободы для поливариантной системы равно числу внешних параметров плюс единица, т.е. больше двух.
Для моновариантной термодинамической системы сформулированный постулат может быть записан в виде
f (P,V ,T ) = 0 |
, |
(2.2) |
ϕ (E,V ,T ) = 0 |
, |
(2.3) |
где f и ϕ - некоторые функции указанных аргументов. Уравнение (2.2),
которое содержит в качестве внутреннего параметра давление P , называется термическим уравнением состояния, а уравнение (2.3), содержащее внутренний параметр E - калорическим уравнением состояния. Например, для моля классического идеального газа термическое и калорическое уравнения состояния имеют соответственно вид
PV − RT = 0, E − 1.5RT = 0 ,
где R = 8.31Дж/ ( К моль) − универсальная газовая постоянная, T − абсо-
лютная температура. В термодинамике уравнения (2.2), (2.3) являются феноменологическими, то есть они постулируются на основании обобщения экспериментальных данных.
Перед формулировкой основных законов термодинамики, связывающих термодинамические параметры, надо остановиться на понятиях
6
самих термодинамических параметров. Достаточно специфичны такие параметры, как температура и энтропия.
Наиболее просты для восприятия физические величины, которые могут быть ассоциированы с геометрическими образами. Это неудивительно, поскольку измерение любой непрерывной физической величины так или иначе сводится к измерению длин отрезков (метризация). Но, ни температура, ни энтропия геометрических образов не имеют, поэтому на их введении следует остановиться особо. Эти параметры могут быть измерены только косвенно, на основании их связи с параметрами, допускающими геометрическое измерение. Последними могут быть давление, объем, длина волны теплового излучения, и т.д. Ниже, при количественном определении температуры и энтропии, мы будем использовать их связь с давлением и объемом газа.
§ 3. Температура
Исходным пунктом при введении температуры является ощущение нагретости тела. Согласно самому общему определению, температура есть физическая величина, характеризующая меру нагретости тела. Для того, чтобы эту величину охарактеризовать количественно, введем понятие термостата.
Термостатом называется тело, масса которого много больше массы любых пробных тел, которые приводятся с ним в контакт. Будем считать, что при соприкосновении с любыми системами температура термостата не изменяется, а после перехода таких систем в состояние равновесия с термостатом за время релаксации их температура совпадает с температурой термостата.
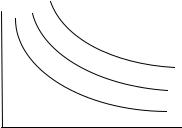
Возьмем в качестве пробного тела сосуд с газом, который находится в термостате. С помощью поршня изменим его объем и измерим давление. Повторяя такие измерения, мы на плоскости переменных P,V получим кривую, которая называется изотермой. Изменяя температуру, или степень нагретости термостата, мы получим семейство изотерм (рис. 3.1).
P
τ3
τ2 τ1
Рис. 3.1 V
7
Опыт показывает, что более нагретому термостату соответствует изотерма, дальше отстоящая от начала координат. Таким образом, можно считать, что изотермы газа представляют собой семейство кривых, различающихся некоторым параметром τ, который называется условной температурой. При этом параметр τ остается постоянным вдоль каждой изотермы и монотонно возрастает при переходе от более близких к более удаленным от начала координат изотермам.
Из экспериментов следует, что изотермы с различными условными температурами нигде не пересекаются. Это означает, что условная температура является однозначной функцией давления и объема.
Надо, однако, отметить, что введенный параметр τ не является однозначно заданным. Любая монотонно возрастающая функция τ будет обладать всеми перечисленными свойствами условной температуры.
Опыт показывает, что для идеального газа изотермы являются равнобочными гиперболами. Математически эти гиперболы могут быть записаны в виде уравнения
PV = f1 (τ ) , |
(3.1) |
где монотонно возрастающая функция f1(τ ) зависит от конкретного спо-
соба задания температурной шкалы. Уравнение (3.1) означает, что для идеального газа условная температура является монотонно возрастающей функцией произведения PV , т.е. τ = τ (PV ) . Если же в качестве рабочего
тела термометра использовать не идеальный газ, то будет иметь место более общая зависимость: τ = τ (P,V ) .
Проведенное рассмотрение допускает обобщение в виде следующего термодинамического постулата, который называется принципом температуры: существует функция состояния системы, которая остается постоянной при любом равновесном процессе, протекающем в термостате, называемая условной температурой.
§ 4. Энтропия
Будем называть сосуд с полностью теплонепроницаемыми стенками адиабатом. Помещая газ в такой сосуд, мы можем следить за протеканием в нем равновесного процесса в условиях теплоизоляции. Такой процесс называется адиабатическим.
Изменяя теплонепроницаемым поршнем объем адиабата и измеряя давление, мы получим некоторую зависимость ψ1 (P,V ) = 0 , которая назы-
вается адиабатой. Если теперь на некоторое время нарушить теплоизоляцию адиабата и привести его в контакт с термостатом, обладающим условной температурой τ, отличной от той, которая была в начале описанного
8
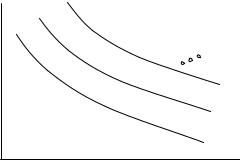
выше процесса, то мы получим другую зависимость ψ 2 (P,V ) = 0 . Многократно приводя на время адиабат в контакт с термостатами имеющими различные условные температуры τ и всякий раз после этого совершая адиабатический процесс, мы получим семейство адиабат, описываемых уравнениями ψ i (P,V ) = 0 .
P
i=3
i=2
i=1
V
Рис. 4.1.
Эти адиабаты графически представлены на Рис. 4.1. Здесь кривая, более удаленная от начала координат, соответствует более высокой условной температуре термостата, с которым контактировал адиабат перед адиабатическим процессом. Каждой из кривых на Рис. 4.1 может быть поставлен в соответствие некоторый параметр σ , который остается постоянным в ходе адиабатического процесса и монотонно возрастает при увеличении температуры термостата перед адиабатическим процессом. Этот параметр называется условной энтропией адиабата. Из опыта известно, что адиабаты, т.е. кривые, представленные на Рис. 4.1., нигде не пересекаются. Это означает, что условная энтропия является однозначной функцией давления и объема.
Следует, однако, отметить, что введенная таким образом энтропия задана не единственным образом. Если мы как-то оцифровали значения σ , то любая монотонно возрастающая функция σ с тем же правом может считаться условной энтропией.
Представленные соображения обобщаются в термодинамике в виде постулата, называемого принципом энтропии: существует однозначная функция состояния системы, остающаяся постоянной при любых равновесных процессах в адиабате, называемая условной энтропией.
§ 5. Абсолютная температура и абсолютная энтропия
Как уже отмечалось, кривые из семейств изотерм, либо адиабат, взаимно не пересекаются. Опыт также показывает, что любая изотерма и любая адиабата пересекаются в одной и только одной точке (P,V ) плоскости.
Это, очевидно, означает, что между точками плоскостей (P,V ) и (τ ,σ )
9
существует взаимно однозначное соответствие. Рассмотрим это соответствие на примере идеального газа.
Для идеального газа, согласно экспериментам, адиабаты описываются уравнением
PV γ = f2 (σ ) , |
(5.1) |
где показатель степени γ > 1 называется показателем адиабаты и является универсальной константой, f2 (σ ) − некоторая монотонно возрастающая
функция условной энтропии. Данная функция может быть задана только при условии конкретизации шкалы измерения σ , которой мы пока не располагаем.
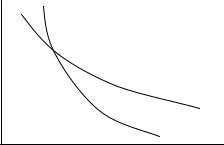
В силу того, что γ > 1, адиабаты на (P,V ) плоскости возрастают бы-
стрее при уменьшении V , чем изотермы, описываемые уравнением (3.1). В результате получается картина, представленная на Рис. 5.1.
P адиабата
изотерма
V
Рис. 5.1.
Таким образом, для идеального газа взаимно однозначное соответствие точек плоскостей (P,V ) и (τ ,σ ) является тривиальным. Действительно, в си-
лу монотонности функций f1(τ ) и f2 (σ ) в уравнениях (3.1) и (5.1), эти уравнения, в принципе, однозначно определяют τ и σ по P,V . И наоборот, из уравнений (3.1) и (5.1) находим:
|
f |
γ |
(τ ) |
(γ −1)−1 |
|
|
|
1 |
|
|
, |
|
|
|
|||
P = |
f2 |
|
|
||
|
(σ ) |
|
|||
|
f |
2 |
(σ ) (γ −1) |
|
|
|
|
|
|
|
|
|
||
V = |
|
|
|
|
f1 |
(τ ) |
|||
−1
,
т.е. давление и объем газа однозначно задаются условной температурой и энтропией.
Для того, чтобы количественно связать температуру и энтропию с давлением и объемом рассмотрим основные свойства якобианов, или функциональных определителей.
Пусть заданы некоторые функции, отображающие точки плоскости (x, y) в точки плоскости (ξ ,η) , и наоборот. Например,
x = x(ξ ,η ), |
y = y(ξ ,η) . |
(5.2) |
Якобианом преобразования (5.2) называется определитель
10
