- ••Особенности ферментов как биологических катализаторов
- •Особенности ферментов как биологических катализаторов
- •Изменение энергии активации в присутствии фермента
- •Каталитический цикл
- •КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА ФЕРМЕНТОВ
- •INTERNATIONAL UNION OF BIOCHEMISTRY AND
- •КЛАССЫ: по типу катализируемой реакции
- •ЕС 1 оксидоредуктазы
- •ЕС 2 трансферазы
- •ЕС 3 гидролазы
- •ЕС 4 лиазы
- •ЕС 5 изомеразы
- •ЕС 6 лигазы
- •Подподкласс – дальнейшее уточнение
- •Индивидуальный номер фермента
- •Номенклатура ферментов
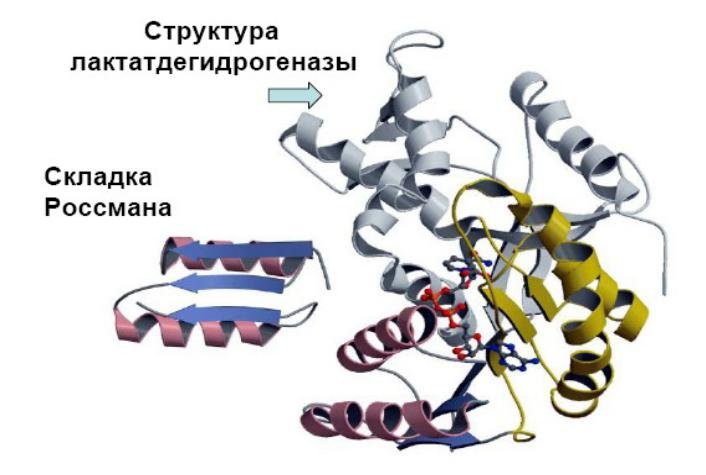
- •СТРУКТУРА ФЕРМЕНТОВ
- •Химотрипсин
- •Свойства активных центров ферментов
- •Пространственная структура химотрипсина
- •Свойства активных центров ферментов
- •Пространственная структура активного центра химотрипсина
- •Формирование активного центра папаина
- •Функции аминокислотных остатков в активном центре фермента
- •Коферменты – производные витаминов
- •Тиамин (витамин В1)
- •Рибофлавин, В2
- •Кофермент ковалентно
- •биотинкарбоксилаза
- •Липоевая кислота
- •Пантотеновая кислота
- •Коферментная
- •Трехмерная структура глутаматмутазы, выделенной
- •Фолиевая кислота
- •Кофакторы – металлы
- •Влияние различных факторов на скорость ферментативной реакции
- •Влияние температуры
- •Влияние рН
- •Активность ферментов
- •Число оборотов некоторых ферментов
- •Влияние концентрации субстрата на скорость ферментативной реакции
- •УРАВНЕНИЕ МИХАЭЛИСА – МЕНТЕН
- •Значения Km некоторых ферментов
- •Преобразования уравнения Михаэлиса - Ментен : двойной обратный график ( уравнение Lineweaver- Burk)
- •График Корниш-Боудена
- •Многие ферменты катализируют реакции с участием 2-х и более субстратов
- •ИНГИБИРОВАНИЕ ФЕРМЕНТОВ
- •I. НЕОБРАТИМОЕ ИНГИБИРОВАНИЕ
- •II. Обратимое ингибирование: конкурентное, неконкурентное, бесконкурентное, смешанное
- •1. КОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ
- •Сульфаниламиды – структурные аналоги п-аминобензойной кислоты
- •Преобразования уравнения Михаэлиса - Ментен : двойной обратный график ( уравнение Lineweaver- Burk)
- •Кинетический тест для определения механизма ингибирования
- •2. БЕСКОНКУРЕНТНОЕ (UNCOMPETIVE) ИНГИБИРОВАНИЕ
- •Кинетический тест для определения механизма ингибирования
- •3. НЕКОНКУРЕНТНОЕ (NONCOMPETIVE) ИНГИБИРОВАНИЕ
- •Кинетический тест для определения механизма ингибирования
Свойства активных центров ферментов
•Составляет малую часть фермента
•Обладает 3-мерной пространственной
структурой
•Образует множественные нековалентные взаимодействия с субстратом
•Специфическое расположение
аминокислотных остатков в а.ц. обеспечивает специфичность взаимодействия с субстратом
•В а.ц. создается особое микроокружение, позволяющее изменять свойства полярных групп
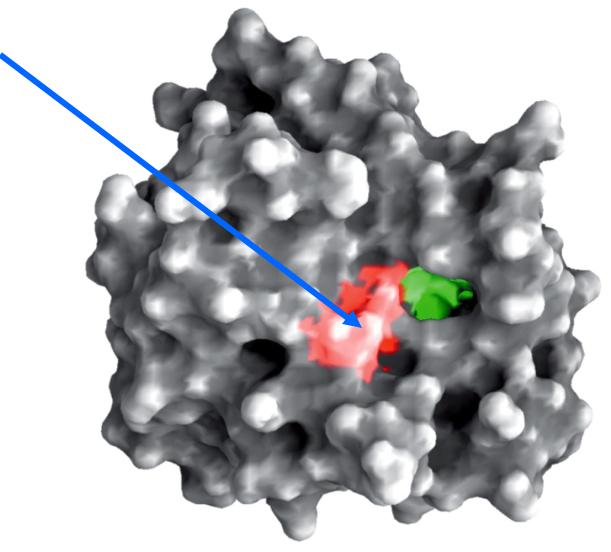
Пространственная структура химотрипсина
Активный центр
Свойства активных центров ферментов
•Составляет малую часть фермента
•Обладает 3-мерной пространственной
структурой
•Образует множественные нековалентные взаимодействия с субстратом
•Специфическое расположение
аминокислотных остатков в а.ц. обеспечивает специфичность взаимодействия с субстратом
•В а.ц. создается особое микроокружение, позволяющее изменять свойства полярных групп
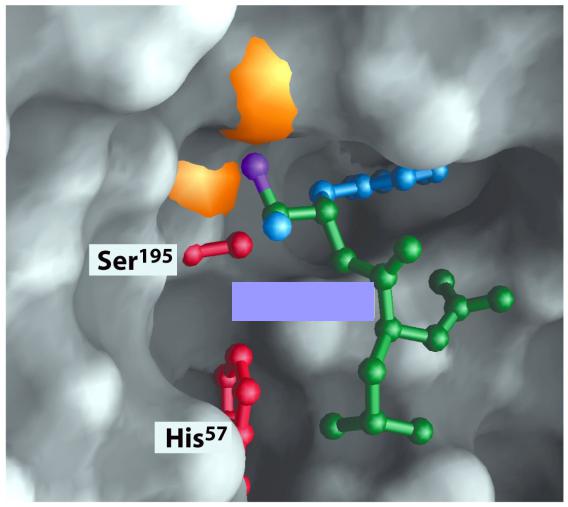
Пространственная структура активного центра химотрипсина
Субстрат
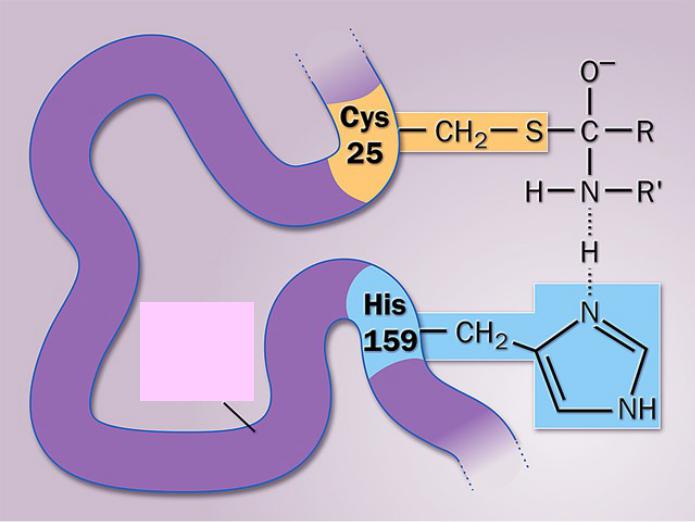
Формирование активного центра папаина
Пептидная
цепь
папаина
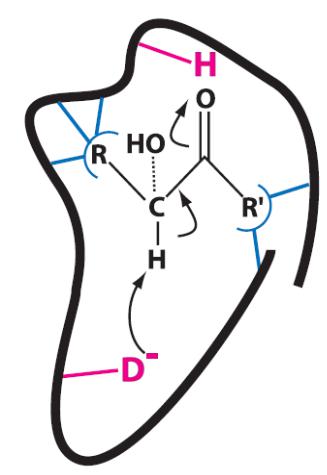
Функции аминокислотных остатков в активном центре фермента
•Структурные
•Связывающие
•Каталитические
Коферменты – производные витаминов
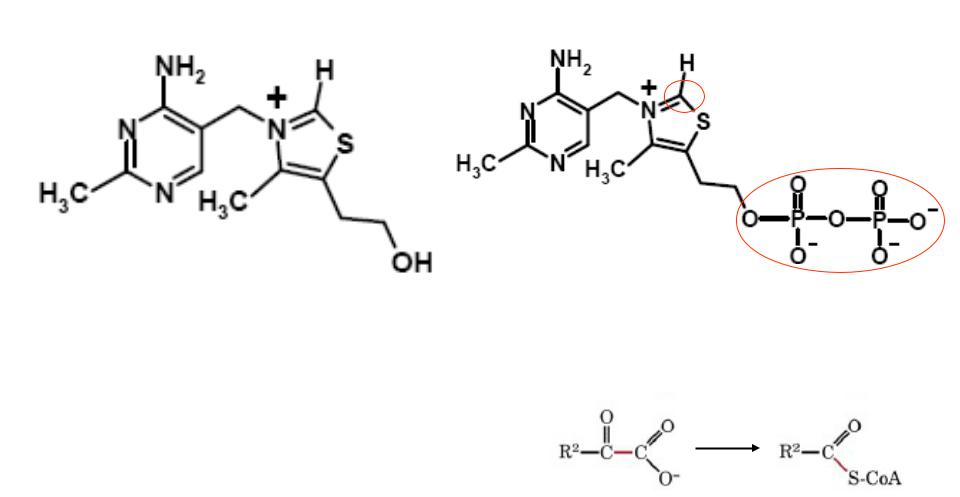
Тиамин (витамин В1) |
Тиаминпирофосфат (ТПФ) |
Участвует в реакциях
декарбоксилирования α-кетокислот (напр.: пируватдекарбоксилаза)
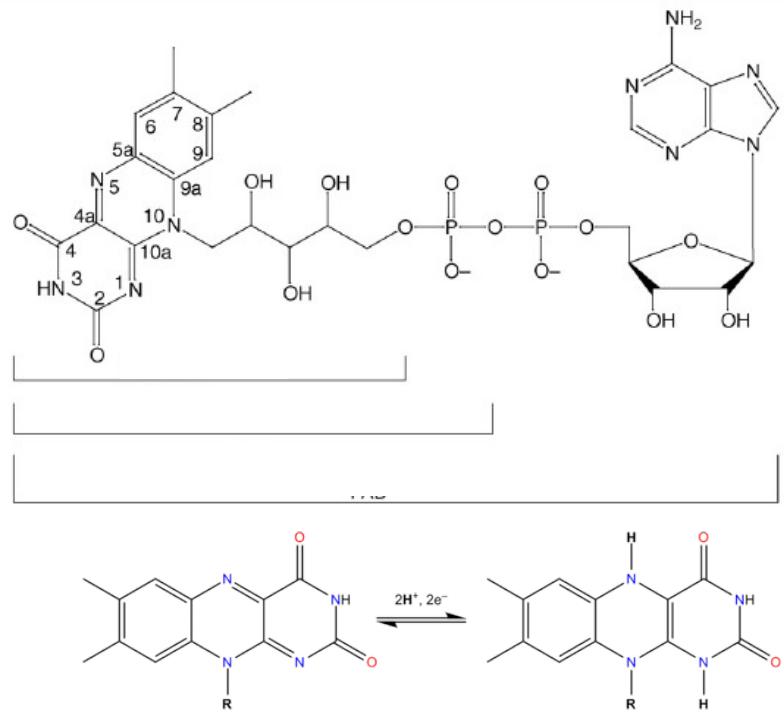
Рибофлавин, В2
Флавинмононуклеотид FMN
Флавинадениндинуклеотид FAD
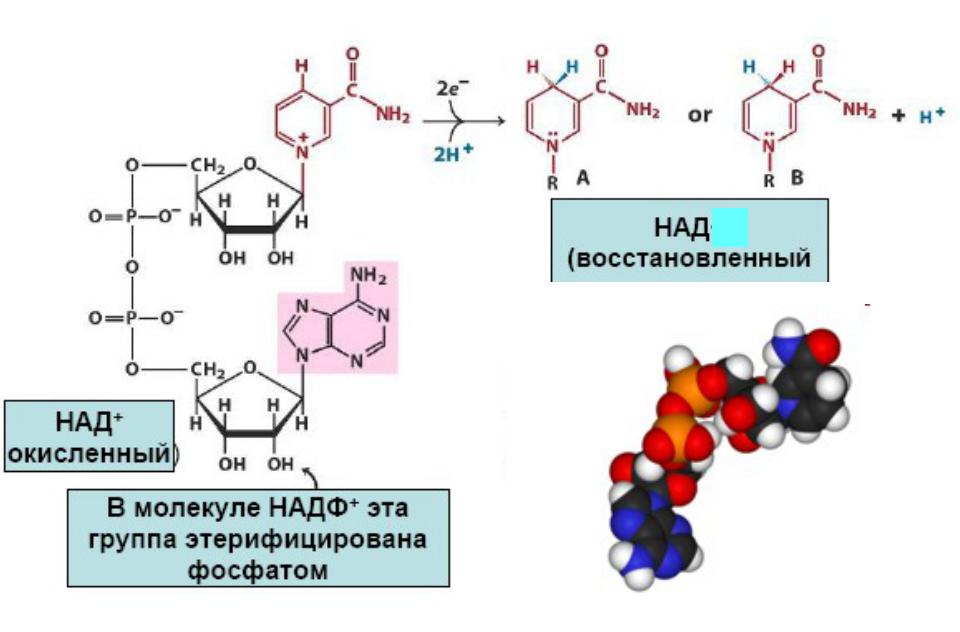
Н
Кофермент NADH