
- •IV часть курса физики Молекулярная физика и термодинамика Введение
- •Лекция 1,2. Молекулярно - кинетическая теория газов
- •1.1. Основные понятия. Уравнение состояния
- •1.2. Вывод основного уравнения мокулярно-кинетической теории
- •1. 3. Молекулярно-кинетическое толкование температуры
- •1.4. Статистические распределения
- •1.5. Барометрическая формула. Классическое распределение Максвелла-Больцмана
- •1.6. Явления переноса
- •Лекция 3. 4. Основы термодинамики
- •3.1. Основные понятия
- •3.2. Работа в термодинамике
- •3.4. Количество теплоты. Первое начало термодинамики
- •Для бесконечно малых процессов
- •3.5. Теплоёмкость
- •3.6. Внутренняя энергия и теплоёмкость идеального газа
- •3.7. Адиабатный процесс
- •3.8 Обратимые и необратимые процессы. Второе начало термодинамики
- •1) (Формулировка Клазиуса) Невозможен процесс, единственным результатом которого является передача теплоты от холодного тела к горячему.
- •3.9. Циклы. Тепловая и холодильная машины
- •3.10. Цикл Карно
- •Энтропия
- •Статистический смысл энтропии и второго начала термодинамики
- •Лекция 5. Фазовые равновесия и фазовые превращения
- •Взаимодействие молекул реальных газов
- •Уравнение состояния Ван-дер-Ваальса
- •Изотермы реальных газов. Фазы. Фазовые переходы.
- •1. Участок ее` соответствует газообразному состоянию вещества. По мере сжатия газа давление растет до точки е.
- •Фазовые диаграммы р - т. Тройная точка
- •Поверхностное натяжение жидкости
- •Элементы физики твердого тела Лекция 6. Элементы квантовой статистики
- •6.1. Особенности квантовых статистик
- •6.2. Фазовое пространство. Ячейка фазового объема.
- •6.3. Принцип неразличимости тождественных частиц. Фермионы и бозоны
- •6.4. Функции распределения Ферми –Дирака и Бозе –Энштейна
- •6.5. Понятие о вырождении.
- •6.6. Вырожденный Ферми-газ в металлах
- •Лекция 7,8. Тепловые свойства кристаллов
- •7.1. Строение кристаллов. Дефекты
- •7.2. Классическая теплоемкость кристаллов по Дюлонгу и Пти
- •7.3. Квантовая теория теплоемкости Дебая
- •7.4. Теплоемкость электронного газа в металлах
- •9.3. Недостатки классической теории Друде-Лоренца
- •9.4. Понятие о квантовой теории электропроводности металлов
- •Элементы зонной теории кристаллов
- •9.6. Собственная проводимость проводников. Электроны проводимости и дырки
- •9.7. Примесная проводимость п/п. Электронный и дырочный п/п.
- •9.8. Р / n переход.
- •9.10. Понятие о сверхпроводимости
- •Лекция 11. Атомное ядро
- •11.1. Строение атомных ядер
- •Свойства ядер
- •11.3 Ядерные силы.
- •Законы радиоактивного распада
- •Ядерные реакции
- •Лекция12. Элементарные частицы и современная физическая картина мира
- •Элементарные частицы
- •Элементарные частицы
- •Свойства элементарных частиц
- •Классы элементарных частиц.
- •Физическая картина мира
- •Основные формулы
- •Вопросы для подготовки к зачету
IV часть курса физики Молекулярная физика и термодинамика Введение
Молекулярная физика изучает физические - свойства веществ исходя из представления об их молекулярном строении. Её основной метод - физическая статистика, в котором не следят за поведением каждой молекулы, а используют средние величины, осреднённые по огромному массиву молекул.
В молекулярной физике происходит переход наших представлений в новое качество: от точного знания мы переходим к знанию усреднённому, приближённому. Мы не знаем (да и не стремимся узнать) как движется каждая из 1020 молекул и не только потому, что (как пишут в литературе) рассчитать движение каждой молекулы технически сложно (1020 диф. уравнений). Главное в том, (и об этом, почему-то в учебниках не пишут), что указать точное движение даже 1-2 молекул в замкнутом сосуде принципиально невозможно, т. к. свойства молекул и параметров движения носят вероятностный характер (квантовая механика).
На наше счастье в телах настолько огромное число молекул, что знать о движении каждой и не нужно, потому что их совместное результирующее действие с очень высокой точностью можно описать средними величинами.
Рассмотрим
пример давления
газа на поршень,
которое обусловлено
ударами молекул.
В молекулярной физике давление описывается
одним числом Р. Насколько это обосновано?
Отметим, что в действительности сила
давления флуктуирует
вокруг некоторого среднего значения.
Причём, чем больше число молекул, тем
меньше относительные флуктуации и тем
с большим основанием можно вводить
понятие давления и считать его константой.
(Относительные флуктуации
![]() ,гдеn
– концентрация молекул, и при
,гдеn
– концентрация молекул, и при
![]()
![]() ).
Таким образом, чем больше число молекул,
тем меньше относительные флуктуации.
).
Таким образом, чем больше число молекул,
тем меньше относительные флуктуации.
Аналогично температура является мерой интенсивности (энергии) хаотического движения молекул и тем более точно описывает систему, чем больше в ней частиц.
Принципиально иным подходом к свойствам веществ является термодинамика. Термодинамику, в отличие от молекулярной физики, не интересует строение тел. Термодинамика изучает количественные и качественные соотношение между макроскопическими характеристиками объектов (энергию, температуру, давление, фазовые переходы и т.д.), исходя из трех экспериментально установленных законов (начал), обладающих большой общностью. Поэтому термодинамический подход можно применять к большому кругу явлений (газы, твердые тела, электромагнитные поля и др.).
Термодинамика, как и молекулярная физика, не учитывает флуктуации и при малом числе частиц теряет смысл.
Лекция 1,2. Молекулярно - кинетическая теория газов
1.1. Основные понятия. Уравнение состояния
Напомним школьный курс.
Основные положения молекулярно-кинетической теории:
Вещества состоят из атомов и молекул.
Атомы и молекулы находятся хаотическом тепловом движении.
Свойства макроскопических тел объясняются взаимодействием молекул.
Основные термодинамические параметры состояния:
1.Объём
![]() V
[м3]
V
[м3]
2.Давление P=dF/dS – численно равно силе, действующей на единицу площади перпендикулярно к ней). [Н/м2]=Па (паскаль)
3.Температура Т [К] Кельвин
4.Масса газа m [Кг]
Равновесное состояние - состояние системы, которое с течением времени не изменяется (пример неравновесного состояния - горячее тело внесли в комнату).
Идеальный газ – это газ, в котором молекулы не взаимодействуют на расстоянии, а лишь при столкновениях. Размеры молекул исчезающе малы.
Моль
- это набор из
![]() элементов (Это число называют числом
Авогадро и обозначаютА)
элементов (Это число называют числом
Авогадро и обозначаютА)
Молярная масса - это масса 1 моля вещества.
Закон Авогадро (опыт): В равных объёмах различных газов при равных температурах и равных давлениях содержится одинаковое число молекул. Из него следует
![]()
![]() Уравнение
состояния идеального газа
(1.1)
Уравнение
состояния идеального газа
(1.1)
Клапейрона - Менделеева
где
R=8,3![]() - универсальная газовая постоянная,
- универсальная газовая постоянная,![]() - число молей.
- число молей.
Напомним основные изопроцессы, которые можно проводить с идеальным газом:1. Изотермический (Т = const) PV = const (см. рис.1.1 а)
2. Изобарический (P = const) V = CT (см. рис.1.1 б)
 3.
Изохорический (V = const) P = C1Т
(см. рис.1.1 в)
3.
Изохорический (V = const) P = C1Т
(см. рис.1.1 в)
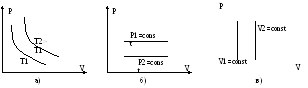
Рис.1.1 Графики изопроцессов: а) изотермический;
б) изобарический; в) изохорический.
