
учебное пособие БРИЛЛЬ
.pdfВ нейтрофилах и других клетках крови имеются кальцийзависимая и кальцийнезависимая формы липоксигеназы, которые функционируют с образованием радикального интермедиата. Активность липоксигеназы поддерживается β липопротеидами, подавляется арахидоновой и другими ненасыщенными жирными кислотами, токоферолом.
Субстратами животных липоксидаз могут быть эфиры холестерина. Липоксигеназа и циклоксигеназа инактивируются избытком своих продуктов — перекисей арахидоната. Ферментативное перекисное окисление компартментализировано физиологически, а неферментное свободнорадикальное окисление структурно не упорядочено и может индуцироваться в любом компартменте клетки, приводя к разрушению не только липидов, но и белков, нуклеиновых кислот, углеводов.
ПОЛ в основном затрагивает фосфолипиды мембран клеток и поэтому вызывает выраженные нарушения мембранного транспорта.
Касаясь патологических эффектов воздействия продуктов ПОЛ, следует отметить, что накопление в гидрофобном слое мембран клеток гидрофильных группировок ROOH вызывает появление своеобразных пор, резко нарушает мембранный транспорт, в том числе и селективный.
Одновременно имеет место повреждение мембраносвязанных ферментов с ингибированием их активности, что приводит к нарушению трансмембранного переноса ионов, аминокислот, глюкозы с последующим нарушением трофики, электрогенеза, возбудимости и функциональной активности клеток. Индуцируемое свободными радикалами повреждение клеточных мембран неизменно сопровождается увеличением концентрации свободного кальция в цитозоле за счет снижения работы кальциевых насосов и патологического открытия пор и кальциевых каналов в цитоплазматических мембранах. Одновременно усиливается освобождение кальция из внутриклеточных депо — митохондрий и эдоплазматического ретикулума. Мембранопротекторные и метаболические эффекты многих природных и синтетических антиоксидантов реализуются за счет эффективного воздействия на трансмембранный перенос кальция и нормализацию его внутриклеточного содержания.
Обращает на себя внимание тот факт, что цитотоксические эффекты различны у различных соединений, относимых к АФК. Известно, что супероксидный анионрадикал дает ограниченный токсический эффект и скорее является восстанавливающим, чем окисляющим агентом. Перекись водорода оказывает ограниченное повреждающее действие, вызывая, в частности, нарушение гомеостаза Ca2+ в клетке. Гидроксильный радикал считается наиболее активной формой O2, поскольку он чрезвычайнореактогененпоотношениюковсеммакромолекулярнымсоединениям клетки, включая ДНК, белки, липиды, углеводы. Константа скорости окисления липидов для HO· составляет 10-9М-1с-1, что в 106 раз выше, чем для супероксидного анион-радикала. Гидроксильный радикал является не только самым реактогенным, но и самым короткоживущим. Супероксидный анион-радикал и перекись водорода (H2O2) относятся к наиболее стабильным соединениям, могут диффундировать с места их генерации через клеточные и внутриклеточные мембраны путем прямой диффузии либо по анионным каналам. Реакционная способность АФК может
51
меняться в зависимости от места их генерации. Так, активность супероксидного анион-радикала возрастает в гидрофобном окружении. Биологическая активность АФК связана с синтезом простагландинов, лейкотриенов, тромбоксанов, а также с окислительной модификацией белков, нуклеиновых кислот, липидов.
Степень выраженности окислительной модификации макромолекул под влиянием АФК зависит от соотношения емкости антиоксидантной системы и интенсивности образования прооксидантов.
Следует отметить, что характер вызываемых свободными радикалами повреждений определяется не только агрессивностью продуцируемых радикалов, но
иструктурными и биохимическими особенностями объектов воздействия. Так, во внеклеточном пространстве свободные радикалы разрушают гликозаминогликаны основного вещества соединительной ткани, что приводит к развитию деструктивного процесса.
Как известно, цитопатогенное действие АФК на молекулы клетки может быть обусловлено прямым ковалентным связыванием с белками мембран или опосредованным через активацию процессов ПОЛ.
Взаимодействуя с белками, АФК снижают уровень мономеров, образуют продукты белковой интеграции и липопротеиновые комплексы. Образование межмолекулярных белковых сшивок, скорее всего, не связано с окислением сульфгидрильных групп, а обусловлено соединениями типа альдегидов, выступающих в качестве сшивающих агентов. Степень устойчивости белков к цитопатогенному воздействию АФК зависит от аминокислотного состава белка, причем наиболее чувствительны циклические и серусодержащие аминокислоты, в частности цистеин и цистин, а наиболее устойчивы — пролин и оксипролин. Однако под действием HO-радикалов гидролизируются и устойчивые белки.
Характер окислительной модификации белка зависит от типа АФК. Так, радикал OH· чаще вызывает агрегацию белков, а в комбинации с супероксидным анион-
радикалом или O2 — фрагментацию. В процессе агрегации белков под влиянием АФК образуются димеры, тримеры, тетрамеры. Установлено, что образование 90 % агрегатов белков под действием HO· обусловлено не образованием C–C связей, а битирозинобразованием.
Процесс фрагментации белка под влиянием OH· или супероксидного анионрадикала связан с отщеплением H+ от карбоксильной группы аминокислот за счет OH· с последующим образованием перекисных соединений, при взаимодействии с
супероксидным анион-радикалом или O2 фрагментация белков сопровождается образованием низкомолекулярных фрагментов, 98 % которых имеют ММ около 5 кДа.
Комбинация OH· и супероксидного анион-радикала вызывала изменение первичной, вторичной и третичной структуры белков. Окислительным превращениям подвергаются все аминокислоты, но особенно триптофан, тирозин, гистидин.
Одним из проявлений токсического действия АФК является окислительная мо-
дификация около 240 различных ферментов под влиянием свободных радикалов O2. Касаясь значимости отдельных типов АФК в инактивации ферментов, следует отметить, что H2O2 вызывает инактивацию СОД, ацетил-КоА-гидролазы, каталазы
имиелопероксидазы, цитохрома P-450.
52
Обнаружено инактивирующее действие OH· на активность ГПО, гексокиназы, лактатдегидрогеназы, трипсина, химотрипсина.
Супероксидный анион-радикал ингибирует активность каталазы, ацетилхолинэстеразы, ГПО и других ферментов.
Интенсивность окислительной модификации белков определяется особенностями аминокислотного состава белка. Акцепторными группами, способными захватывать электроны при взаимодействии с АФК и образовывать анион-радикалы, служат дисульфидные, сульфгидрильные, карбонильные, карбоксильные и аминогруппы. Среди аминокислот наибольшей реакционной способностью обладают цистеин и цистин. Показано, что триптофан, гистидин, серосодержащие аминокислоты обладают реакционной способностью по отношению к продуктам миелпероксидазы, в том числе HClO. Известно, что фрагментацию белков могут вызывать радикалы липидов.
Увеличение содержания АФК сопровождается разрушением основных ферментов антиоксидантной защиты за счет окислительной модификации и инактивации ферментов-антиоксидантов. Последнее приводит к истощению антиоксидантной системы и гибели клеток. Показано, что три основных фермента — СОД, каталаза, ГПО инактивируются последовательно. Каждый из этих ферментов защищает друг друга от повреждающего воздействия АФК. Так, СОД, разрушая супероксидный анион-радикал, снижает тем самым восстановление Fe3+ и возможность образования радикала OH·. Каталаза и ГПО предохраняют СОД от инактивации, устраняя H2O2.
Вфизиологическихусловияхивусловияхпатологиивозможнотакназываемое металлокатализируемое окисление белков, затрагивающее ту часть белковой молекулы, которая участвует в связывании металлов переменной валентности (Fe, Cu). К числу таких белков относят ряд ферментов: ацетилхолинэстеразу, алкогольдегидрогеназу, каталазу, СОД, креатинкиназу, пируватдегидрогеназу, лактатдегидрогеназу.
К металлокатализируемому окислению чувствительны пролин, гистидин, агринин, лизин, что приводит к разрыву пептидных связей, снижению изоэлектрической точки белка. АФК вызывают окислительную деградацию белков в интактных клетках и интрацеллюлярных органеллах, так как окисленные белки служат субстратом действия для протеолитических ферментов (трипсина, химотрипсина, пепсина, катепсина D, субтилопептидазыA).
Скорость оборота внутриклеточных белков зависит от соотношения окисленной модификации белков с последующим их протеолизом и синтеза их de novo.
Окислительная модификация белков — один из ранних признаков поражения тканей при оксидативном стрессе, воспалительных процессах, при ишемии, реперфузионном синдроме, атеросклерозе, при старении организма.
Как известно, цитотоксические эффекты АФК могут приводить к модификации, разрыву нитей ДНК и соответственно к возникновению хромосомных мутаций. Высокую реактогенность в отношении ДНК проявляют радикалы OH·, быстро реагирующие с дезоксирибозой и азотистыми основаниями ДНК в водных растворах.
Продукты липопероксидации, в частности МДА, контролируют клеточное деление на стадии репликации ДНК.
53
Касаясь функциональной значимости избыточного накопления свободных радикалов и продуктов липопероксидации в крови и тканях в условиях патологии, следует отметить универсальность повреждающего действия на клеточные структуры различных органов и тканей и полиморфизм клинических проявлений на клеточном, органном, системном уровнях.
Установлено, что АФК способствуют переходу протромбина в тромбин, что приводит к развитию гиперкоагуляции. Выяснено, что усиление продукции АФК различными химическими соединениями способствует десиализации мембран эритроцитов. При этом обнажаются терминальные остатки β галактозы, которые входят в антиген Томпсена-Фриденрейха, являющийся сигналом для разрушения и удаления объекта из организма.
Воздействие кислородных радикалов на ДНК служит промотором соматических мутаций, канцерогенеза.
Как известно, важнейшая роль в регуляции активности клеток различной локализации, в том числе тромбоцитов, эндотелиальных клеток, клеток мононуклеарной фагоцитирующей системы, печени, играющих важную роль в регуляции коагуляционного потенциала крови, отводится рецепторному аппарату, обеспечивающему трансформацию сигнала. Под влиянием АФК возникает сбрасывание фрагментов мембран, так называемый шеддинг. В числе сбрасываемых компонентов мембран имеются и ганглиозиды — важнейшие составные компоненты многих мембранных рецепторов. При этом, с одной стороны, нарушается нервная и гуморальная регуляция функциональной активности клеток. С другой стороны, ганглиозиды, обладая иммуногенной активностью, стимулируют через липоксигеназу цитотоксичность лимфоцитов.
Впоследние годы высказывается точка зрения о значении активации процессов пероксидации в развитии аутоиммунных заболеваний, поскольку перекисная деструкция белков, нуклеиновых кислот, липидов приводит к образованию значительного количества вторичных аутоантигенов.
Вэкспериментальных исследованиях показано, что активация процессов липопероксидации в условиях индукции микросомального окисления феноксигербицитом сопровождалось развитием цитолиза макрофагов. Использование комплекса витаминов-антиоксидантов (А, С, Е) обеспечивало мембранопротекторный эффект
иповышение функциональной способности макрофагов.
Избыточное образование свободных радикалов составляет основу так называемой теории свободно радикального старения, имеющей солидную экспериментальную основу.
В ряде работ имеются указания на наличие прямой коррелятивной взаимосвязи процессов липопероксидации, дестабилизации биологических мембран и расстройств коагуляционного потенциала крови.
Резюмируя в целом приведенные выше данные литературы о функциональной и метаболической значимости активации процессов липопероксидации при различных формах патологии инфекционной и неинфекционной природы необходимо акцентировать внимание на следующих закономерностях:
1. Дестабилизация цитоплазматических мембран в связи со структурными изменениями белковых и липидных компонентов приводит к нарушениям транс-
54
мембранного переноса ионов, электролитного баланса клеток, их возбудимости. Одновременно возникает утрата мембранных рецепторов, гуморального и нервного контроля за внутриклеточной метаболической активностью.
2.Дестабилизация лизосомальных мембран клеток на фоне активации процессов липопероксидации, повышение активности протеаз, фосфолипаз сопровождается каскадом реакций активации циклоксигеназной и липоксигеназной систем, усилением синтеза лейкотриенов, простагландинов, тромбоксана, активацией калликреин-кининовой системы, расстройствами коагуляционного потенциала крови, реологии, микроциркуляции. В процессе метаболизма избыточных концентраций эйкозаноидов, простаноидов, дефицита кислорода в тканях образуется новый пул свободных радикалов, процесс приобретает замкнутый и в ряде случаев необратимый характер.
3.Избыточное образование свободных радикалов может индуцировать развитие генных и хромосомных мутаций, канцерогенеза, ускорение процессов старения организма.
4.Активация процессов липопероксидации при заболеваниях инфекционной природы, с одной стороны, усиливает цитопатогенные эффекты бактериальных токсинов, а с другой стороны, способствует образованию вторичных аутоантигенов
итрансформации токсической фазы инфекционного процесса в аллергическую. Выяснение особенностей нарушения взаимосвязи прокоагулянтной, антикоа-
гулянтной и фибринолитической систем, активации процессов липопероксидации при бактериальных инфекциях и интоксикациях, в частности при холерной, позволит разработать патогенетически обоснованные принципы медикаментозной коррекции вторичных неспецифических метаболических расстройств, коагуляционного потенциала крови, микроциркуляции, оксигенации и трофики тканей и соответственно предотвратить развитие полиорганной недостаточности, свойственной эндотоксиновому шоку.
55
Глава 4
ПАТОФИЗИОЛОГИЯ КИСЛОТНО-ОСНОВНОГО СОСТОЯНИЯ
Кислотно-основноесостояние(КОС)организмаявляетсяоднимизважнейших и наиболее строго стабилизируемых параметров гомеостаза. От соотношения водородных и гидроксильных ионов во внутренней среде организма зависят активность ферментов,интенсивностьинаправленностьокислительно-восстановительныхре- акций, процессы обмена белков, углеводов и жиров, функции различных органов и систем, постоянство водного и электролитного обмена, проницаемость биологических мембран и т.д. Активность реакции среды влияет на способность гемоглобина связывать кислород и отдавать его тканям.
Активную реакцию среды принято оценивать по содержанию в жидкостях ионов водорода.
Величина рН является одним из самых «жестких» параметров крови и колеблется у человека в норме в очень узких пределах — 7,35–7,45. Более значительные изменения рН крови связаны с патологическими нарушениями обмена. В других биологических жидкостях и в клетках рН может отличаться от рН крови. Так, в эритроцитах рН составляет 7,18–7,20, а в моче — 4,5–5,5.
Сдвиг рН крови даже на 0,1 за указанные границы обусловливает нарушения со стороны функции сердечно-сосудистой, дыхательной и других систем; сдвиг на 0,3 может вызвать коматозные состояния, а на 0,4 — зачастую несовместим с жизнью.
4.1. Регуляция кислотно-основного гомеостаза
Кислотно-основное состояние поддерживается мощными гомеостатическими механизмами. В их основе лежат особенности физико-химических свойств буферных систем крови и физиологические процессы, в которых принимают участие системы внешнего дыхания, почки, печень, желудочно-кишечный тракт и др.
Буферной системой называют смеси, которые обладают способностью препятствовать изменению рН среды при внесении в нее кислот или оснований. Буферными свойствами обладают смеси, которые состоят из слабой кислоты и ее соли, содержащей сильное основание, или из слабого основания и соли сильной кислоты.Наиболееемкимибуфернымисистемамикровиявляютсябикарбонатный, фосфатный, белковый и гемоглобиновый. Первые три системы особенно важную роль играют в плазме крови, а гемоглобиновый буфер, самый мощный, действует в эритроцитах.
Бикарбонатный буфер состоит из слабой угольной кислоты Н2СО3 и соли ее аниона — сильного основания HCO3−. В плазме крови основной щелочной солью является бикарбонат натрия, а в клетках — бикарбонат калия. В нормальных условиях (при рН крови около 7,4) в плазме бикарбоната в 20 раз больше, чем углекислоты. При образовании в плазме избытка кислореагирующих продуктов ионы водорода соединяются с анионами бикарбоната (HCO3−). Образующийся при этом в плазме избыток углекислоты поступает в эритроциты и там с помощью угольной
56
ангидразы разлагается на углекислый газ и воду. Углекислый газ выделяется в плазму, возбуждает дыхательный центр и избыток СО2 удаляется из организма через легкие. Это быстрое преобразование бикарбонатом любой кислоты в угольную, которая легко удаляется легкими, делает бикарбонатный буфер самой лабильной буферной системой.
Бикарбонатный буфер способен нейтрализовать и избыток оснований. В этом случае ионы ОНˉ будут связаны углекислотой и вместо самого сильного основания ОНˉ образуется менее сильное HCO3−, избыток которого в виде бикарбонатных солей выделяется почками.
Бикарбонатный буфер является одним из самых важных. До тех пор, пока количество угольной кислоты и бикарбоната натрия изменяется пропорционально и соотношение между ними сохраняется 1:20; рН крови остается в пределах нормы, поэтому содержание составных частей бикарбонатного буфера является важнейшим показателем состояния кислотно-основного баланса организма.
Фосфатный буфер представлен солями одно- и двузамещенных фосфатов. Фосфатная буферная система является основной буферной системой клеток. Механизмы компенсации сводятся к образованию подвижных фосфатов в клетке и фосфорных солей мочи. Однозамещенная соль обладает кислыми свойствами, так как при диссоциации дает ион H2PO–4 , который далее способен выделять ион водоро-
да: NаН2РО4 Nа+ + H2PO–4 ; H2PO–4 Н+ + HPO24− . Двузамещенный фосфат обладает свойствами основания, так как диссоциирует с образованием иона HPO24− ,
который может связывать ион водорода: HPO24− + Н+ H2PO–4.
При нормальном рН в плазме соотношение фосфатных солей NаН2РО4: Nа2НРО4 = 1:4. Этот буфер имеет значение в почечной регуляции КОС, а также в регуляции реакции некоторых тканей. В крови же его действие главным образом сводится к поддержанию постоянства и воспроизводства бикарбонатного буфера. Так, при избытке в крови Н2СО3 происходит обменная реакция: Н2СО3 + Nа2НРО4NaHCO3 + NaH2PO4, т.е избыток Н2СО3 устраняется, а концентрация NаНСО3 увеличивается, поддерживая постоянство отношения компонентов бикарбонатного буфера.
Белковая буферная система является довольно мощным буфером. Белки плазмы крови содержат достаточное количество кислых и основных радикалов, поэтому эта буферная система действует в зависимости от среды, в которой происходит диссоциация белков. Так, при сдвиге рН в щелочную сторону диссоциация основных групп угнетается и белок ведет себя как кислота. Связывая основание, эта кислота дает соль. С увеличением рН возрастает количество белков в форме соли, а при уменьшении растет количество белков плазмы в форме кислоты.
Гемоглобиновый буфер является самой емкой буферной системой. На ее долю приходится до 75 % всей буферной емкости крови. Свойства буферной системы гемоглобину придает главным образом его способность постоянно находиться в виде двух форм — восстановленного (редуцированного) гемоглобина ННb и окисленного (оксигемоглобина) НbО2. Огромная роль гемоглобинового буфера в поддержании постоянства реакции крови при переходе ее из артериальной в венозную зависит от его способности особым образом связывать углекислый газ и
57
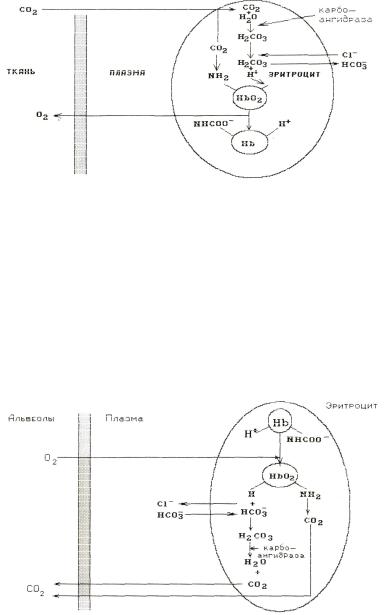
переносить его к месту его выделения — к легочным капиллярам, оплетающим альвеолы. В кровь из клеток идет непрерывный поток СО2.
Рис. 4.1. Действие гемоглобинового буфера в тканевых капиллярах
При протекании крови по легочным капиллярам все процессы идут в обратном направлении. Венозная кровь через легочную мембрану контактирует с воздухом альвеол, где парциальное давление кислорода выше, а рСО2 — ниже, чем в крови. Кислород воздуха насыщает плазму и поступает в эритроциты, а часть растворенного в плазме СО2 покидает ее через стенку альвеол, поэтому сразу же падает напряжение СО2 и в эритроцитах. Вследствие этого ферментативный процесс синтеза Н2СО3 из СО2 и Н2О прекращается. Карбоангидраза теперь стимулирует обратный процесс — расщепление Н2СО3 до воды и углекислого газа. Концентрация Н2СО3 в эритроцитах падает, а поэтому снижается концентрация ионов HCO3− и Н+ в эритроцитах. Из плазмы в них усиленно поступают ионы HCO3− (в обмен на ионы хлора), а ионы водорода освобождает гемоглобин.
Рис. 4.2. Действие гемоглобинового буфера в легочных капиллярах
58
Таким образом, переход окисленной формы гемоглобина в восстановленную форму предупреждает сдвиг рН в кислую сторону во время контакта крови с тканями, а образование оксигемоглобина в легочных капиллярах предотвращает сдвиг рН в щелочную сторону за счет выхода из эритроцитов СО2 и иона хлора и образования в них бикарбоната.
Из всего сказанного ясно, что все буферные системы играют важную роль в регуляции КОС. Однако помимо буферных систем в поддержании постоянства рН активное участие принимают физиологические системы, среди которых основными являются легкие, почки, печень, желудочно-кишечный тракт.
Система дыхания играет значительную роль в поддержании кислотнощелочного баланса организма, однако для нивелирования сдвига рН крови им требуется 1–3 минуты, в то время как буферной системе для этого достаточно 30 сек. Роль легких сводится к поддержанию нормальной концентрации углекислоты, и основным показателем функционального состояния легких является парциальное напряжение углекислого газа в крови.
Свободные ионы водорода не выделяются легкими. Однако при усиленном образовании их в организме нормально функционирующая бикарбонатная система, связывая с помощью бикарбоната натрия ионы водорода, переводит сильные кислоты в слабую угольную кислоту с последующим образованием из нее воды и углекислогогаза,которыйвыводитсясвыдыхаемымвоздухом.Необходимопомнить,что углекислый газ образуется не только в результате реакции бикарбонатного буфера, но и является конечным продуктом ряда метаболических процессов в организме.
При устойчивом состоянии газообмена легкие выводят углекислого газа столько, сколько его образуется (около 850 г в сутки). В нормальных условиях напряжение углекислого газа артериальной крови поддерживается на уровне 35–45 мм рт. ст. (4,66–5,99 кПа). Адекватные изменения вентиляции регулируются дыхательным центром, который очень чувствителен к изменениям рН и рСО2. Если напряжение углекислого газа повышается сверх нормы на 10 мм рт. ст., вентиляция увеличивается в 4 раза. Активность дыхательного центра возрастает также при снижении рН крови, а также при ряде других воздействий.
Таким образом, повышение напряжения углекислого газа и сдвиг рН в кислую сторону увеличивают вентиляцию и элиминацию углекислоты; буферное соотношение бикарбонатной системы выравнивается; концентрация ионов водорода нормализуется.
При избыточном накоплении щелочных веществ в организме возникает повышенная потребность в угольной кислоте, идущей на нейтрализацию этих щелочей. При уменьшении запасов угольной кислоты падает и концентрация углекислого газа и при этом интенсивность стимуляции дыхательного центра уменьшается, возникают брадипноэ и гиповентиляция. Это приводит к сохранению углекислого газа в организме и восполнению запасов угольной кислоты в крови. Таков физиологический механизм регуляции КОС с участием легких.
Роль почек в регуляции активной реакции крови не менее важна, чем деятельность дыхательной системы. Экскреция кислот при обычной смешанной пище у здорового человека превышает выделение оснований, поэтому моча имеет кислую реакцию (рН 5,3–6,5) и концентрация в ней ионов водорода примерно в 800 раз выше, чем в крови. Кислотность мочи возрастает при увеличении экскреции
59
слабых органических кислот — ацетоновых тел, молочной, лимонной и др. Значительное их количество выделяется лишь при очень тяжелых нарушениях кислотноосновного баланса (например, при сахарном диабете), когда рН мочи может доходить до 4,2–4,4. Почки вырабатывают и выделяют с мочой количество ионов водорода, эквивалентное их количеству, непрерывно поступающему в плазму из клеток организма, совершая при этом замену ионов водорода, секретируемых эпителием канальцев, на ионы натрия первичной мочи. Этот механизм осуществляется с помощью нескольких химических процессов.
Первым из них является процесс реабсорбции натрия при превращении двузамещенных фосфатов в однозамещенные.
Второй процесс, который обеспечивает задержку натрия в организме и выведение излишка ионов водорода, — это превращение в просвете канальцев бикарбонатов в угольную кислоту.
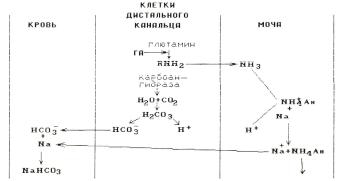
Третьим процессом, который способствует сохранению натрия в организме, является синтез в дистальных почечных канальцах аммиака (аммониогенез) и использование его для нейтрализации и выведения кислых эквивалентов с мочой.
Рис. 4.3. Образование иона аммония (аммониогенез) в почках ГА – глютаминаза Ан – анион
Образовавшийся свободный аммиак легко проникает в просвет канальцев, где, соединяясь с ионом водорода, превращается в плохо диффундирующий аммонийный катион NH +4 , не способный вновь вернуться в клетку стенки канальца. Таким образом, для осуществления эффективной экскреции аммония необходима активность в клетках канальцев не только глютаминазы, но и карбоангидразы, обеспечивающей образование угольной кислоты. Важно, что, выделяясь в составе аммонийныхсолей,ионыводороданеснижаютрНмочиинеоказываютгубительного действия на клетки канальцев. Одновременно в плазму (вместе с натрием) поступают ионы бикарбоната, образованные в процессе секреции водородных ионов.
В общем итоге концентрация водородных ионов в моче может превышать концентрацию водородных ионов в крови в несколько сотен раз.
60
